綠原酸對H2O2致小鼠RGC-5細胞損傷的保護作用
姜 逸, 胡 娜, 袁 琳, 林 敏, 鐘霄毓, 陸 敏, 陸 雄
(上海中醫藥大學科技實驗中心,上海 201204)
糖尿病視網膜病變是糖尿病患者最常見的并發癥[1],也是可預防性視力障礙和失明的主要原因之一[2],其病變成因復雜,微血管病變長期被認為是其核心病理機制[3]。研究證實,糖尿病視網膜神經變性是糖尿病視網膜病變的早期事件,早在微血管病變之前神經節細胞層就已經出現了結構性與功能性的改變,如視網膜神經節細胞數減少、神經纖維層變薄和電生理異常等[4-5]。此外糖尿病患者機體持續的高血糖狀態會導致細胞代謝失衡,引發葡萄糖氧化過多、ROS產生、細胞凋亡等。視網膜神經組織需要較多能量以維持神經細胞膜極化,而這種特性使得其極易受到氧化應激的影響[6-7]。在生理或病理條件下自噬能促進受損的細胞器更新,分解代謝產物重回物質循環,引導細胞作出雙向適應性應答[8-9]。因此,越來越多有關糖尿病視網膜病變致病機理和藥物有效性的研究靶向自噬在氧化應激條件下的作用。
綠原酸是金銀花、杜仲、野菊花等多種中藥的活性成分,現代藥理研究發現其通過降低ROS水平,上調抗氧化酶活性進而降低或阻止氧化應激的發生,具有較強的抗氧化作用[10-11],但其是否具有保護視網膜神經節細胞的作用尚不明確。本實驗采用H2O2體外間接模擬高血糖誘導的氧化應激環境,探究綠原酸對小鼠視網膜神經節細胞系RGC-5的作用。
1 材料
1.1 細胞 小鼠視網膜神經節細胞(RGC-5,上海富衡生物科技有限公司,貨號FH0369)。
1.2 試劑與藥物 綠原酸(HPLC≥98%,大連美倫生物技術有限公司,貨號J0120AS)。3% H2O2、MTT(美國Sigma公司,貨號88597、MKCD4805);DMEM高糖培養基、細胞培養級PBS(大連美侖生物技術有限公司,貨號MB4372、MA0016);0.25%Trypsin-EDTA、胎牛血清(美國Gibco公司,貨號1869505、2045677RP);DMSO[生工生物工程(上海)股份有限公司,貨號BB02BA001];LC3抗體、p62抗體、β-actin抗體、辣根過氧化酶(HRP)標記的IgG抗體(美國CST公司,貨號12741、23214、5125、7074);RIPA裂解液、SDS-PAGE凝膠快速配制試劑盒、SDS-PAGE蛋白上樣緩沖液、ECL特超敏化學發光試劑盒(上海碧云天生物技術有限公司,貨號P0013C、P0012AC、P0015L、P0018AS);BCA蛋白定量試劑盒(上海雅酶生物科技有限公司,貨號ZJ101);0.45 μm PVDF膜(德國Merck公司,貨號R7SA6402D);蛋白Marker(美國Thermo Fisher公司,批號00451236)。鋨酸(美國Alfa Aesar公司,批號10108150);十二烷基琥珀酸酐(DDSA,美國Polysciences公司,批號82714);環氧樹脂E-51(618#)(昆山綠循電子材料有限公司);DMP-30(美國SPI公司,批號1101122);鄰苯二甲酸二丁酯、丙酮、乙醇(國藥集團化學試劑有限公司,批號20160526、20200811、20210728);醋酸鈾(美國Electron Microscopy Sciences公司,批號180926-01)。
1.3 儀器 NU-5510E培養箱(美國Nuair公司);Alpha Clean1300超凈臺[力康精密科技(上海)有限公司];Spectra Max190酶標儀(美國Molecular Devices公司);Tecnai G2 spirit透射電子顯微鏡(美國FEI 公司);705902超薄切片機(德國Leica公司);AI 600超靈敏多功能成像儀(美國GE公司)。
2 方法
2.1 細胞培養、造模及給藥 RGC-5細胞使用含10%胎牛血清的DMEM培養基,日常培養于37 ℃、5%CO2、相對濕度95%的細胞培養箱中。細胞分為正常組、模型組和綠原酸組,細胞接種后培養24 h;正常組更換正常培養基繼續培養,模型組和綠原酸組更換含H2O2(終濃度為30 μmol/L)培養基造模,繼續培養24 h;吸棄原培養基,正常組和模型組更換正常培養基,綠原酸組加入相應濃度含綠原酸(6.25、12.5、25、50、100、200 μmol/L)的培養基,繼續培養12 h,結束后收集細胞進行后續檢測。
2.2 MTT法檢測RGC-5細胞存活率 將RGC-5細胞以5×104/mL的密度接種于96孔板,每孔100 μL,每組設6個復孔,按“2.1”項下方法造模、給藥,每孔加入20 μL MTT溶液(5 mg/mL),培養箱繼續孵育4 h,吸棄孔內液體,每孔加入150 μL二甲基亞砜,置搖床上低速振蕩10 min使甲瓚結晶物完全溶解,使用酶聯免疫檢測儀在490 nm波長處檢測各孔光密度(OD)值,并計算細胞存活率。
2.3 免疫熒光染色觀察RGC-5細胞數 RGC-5細胞按“2.2”項下方法培養、造模、給藥后,4%多聚甲醛固定細胞30 min,加入免疫染色強力通透液,室溫孵育5 min,PBS清洗后用Hochest(10 μg/mL)染核10 min,PBS清洗后于1 h內進行觀察,并記錄細胞數。
2.4 透射電子顯微鏡觀察RGC-5細胞超微結構 RGC-5細胞按“2.1”項下方法造模、給藥后,收集細胞沉淀至綠豆大小,2.5%戊二醛4 ℃前固定2 h,2.5%鋨酸4 ℃后固定2 h,梯度乙醇、丙酮脫水后轉移樣本至環氧樹脂包埋劑中固化烘干,隨后超薄切片80 nm,檸檬酸鉛染色后使用透射電子顯微鏡觀察細胞超微結構。
2.5 Western blot檢測RGC-5細胞LC3、p62蛋白表達 將RGC-5細胞以8×104/mL的密度接種于6孔板,每孔2 mL,每組設3個復孔,按“2.1”項下方法造模、給藥后,收集細胞沉淀,加入RIPA裂解液,冰浴超聲裂解提取總蛋白,BCA法檢測蛋白濃度。采用SDS-PAGE凝膠電泳分離等量蛋白樣本,隨后轉移至PVDF膜上,用含有5%脫脂奶粉的TBST封閉2 h,加入一抗在4 ℃條件下孵育過夜,TBST清洗后,加入二抗在室溫下孵育1 h,滴加ECL化學發光試劑,成像儀成像后用Image J軟件分析條帶灰度值,以β-actin為內參計算目的蛋白相對表達。
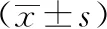
3 結果
3.1 綠原酸對H2O2損傷的RGC-5細胞活性的影響 如表1所示,綠原酸濃度大于25 μmol/L時,可劑量依賴性地增加RGC-5細胞存活率(P<0.05,P<0.01),在100 μmol/L時達到峰值,隨后趨于平穩。本實驗采用30 μmol/L H2O2進行造模,如表2所示,與正常組比較,模型組細胞存活率降低(P<0.01);與模型組比較,綠原酸組細胞存活率增加,其趨勢與不造模時相同,且100 μmol/L時作用最為明顯(P<0.01)。

表1 綠原酸對RGC-5細胞存活率的影響

表2 綠原酸對H2O2損傷的RGC-5細胞存活率的影響
3.2 綠原酸對H2O2損傷的RGC-5細胞數的影響 如圖1、表3所示,與正常組比較,模型組細胞數減少(P<0.01);與模型組比較,綠原酸100 μmol/L組細胞數增加(P<0.01)。

表3 綠原酸對H2O2損傷的RGC-5細胞數的影響

圖1 RGC-5細胞Hochest染色(明場與熒光合成偽彩圖,×200)

注:M為線粒體,ER為內質網。實心箭頭指示腫脹的線粒體,空心箭頭指示腫脹的內質網,方框內為自噬泡。
3.3 綠原酸對RGC-5細胞超微結構的影響 如圖2所示,正常組RGC-5細胞器豐富,偶見自噬小泡,未見其他異常;模型組RGC-5細胞呈現大量內質網和線粒體腫脹,未見自噬泡形成;綠原酸給藥組自噬泡形成,且數量增多。
3.4 綠原酸對RGC-5細胞自噬相關蛋白表達的影響 如圖3所示,與正常組比較,模型組細胞中LC3Ⅱ/Ⅰ蛋白表達比值降低(P<0.01),p62蛋白表達升高(P<0.05);與模型組比較,綠原酸各濃度組LC3Ⅱ/Ⅰ蛋白表達比值呈劑量依賴性升高(P<0.01),p62蛋白表達呈劑量依賴性降低(P<0.01)。

注:與正常組比較,##P<0.01;與模型組比較,**P<0.01。
4 討論
糖尿病視網膜病變的發生是一個復雜的病理過程,高血糖始終是糖尿病視網膜病變發病機制中最重要的起始因素。研究表明,細胞持續處于高血糖狀態容易導致氧化應激,而視網膜需氧量大、葡萄糖氧化性強更易遭受氧化應激的攻擊,最終誘發高代謝需求的視網膜神經節細胞凋亡[12]。既往臨床著重于糖尿病視網膜病變后期增生性階段的微血管病變,但其標準療法——激光光凝術臨床不良反應較多,另一些治療方法如玻璃體內注射VEGF抗體及一些類固醇藥物的效果也不盡人意[13-14]。而中醫藥療法歷史悠久、價格低廉、副作用小,在防治糖尿病視網膜病變方面具有突出優勢[15-16]。因此,本研究對綠原酸的抗氧化能力是否發揮保護視網膜神經節細胞的作用進行了探索。
自噬是真核細胞特有的利用溶酶體降解自身受損的細胞器和大分子物質的生命現象[17]。在正常生理條件下,自噬普遍低水平表達,在細胞生長、發育過程中發揮著重要作用,并有助于維持細胞產物的合成與分解代謝過程之間的平衡[18]。當機體面臨營養匱乏、氧化應激、內質網應激、細胞因子或病原微生物等廣泛的內外壓力時,自噬可以引導細胞做出雙向適應性應答,決定細胞生存或死亡[8,19]。Gon?alves等[20]發現自噬缺陷與神經退行性疾病中的神經元丟失有關,自噬保護神經元免受脫髓鞘和營養匱乏的影響。Li等[21]發現自噬在高葡萄糖引起的神經毒性中起著保護作用。更有研究證實,自噬可以清除氧化應激條件下受損的蛋白質分子及細胞器,維持機體新陳代謝過程以保證衰老和受損細胞器的生理循環。當自噬受阻時,異常的蛋白質及細胞器聚集,進一步加劇氧化應激導致細胞死亡[22]。本實驗結果顯示,H2O2刺激后RGC-5細胞存活率降低,細胞數減少,線粒體和內質網腫脹;綠原酸在一定濃度范圍內呈劑量依賴性地恢復細胞活性,100 μmol/L劑量最佳,且用藥后細胞內出現較多自噬泡。
自噬形成時,胞漿型LC3(即LC3Ⅰ)會酶解掉一段多肽,轉變為(自噬體)膜型(即LC3Ⅱ),LC3Ⅱ是自噬泡膜形成的關鍵組分,因此LC3Ⅱ/Ⅰ比值的大小可評估自噬水平的高低[23]。而p62蛋白作為受體蛋白可以結合異常的蛋白成分與LC3相互作用最終被自噬體識別降解。自噬上游表達增強或者下游降解阻斷,都會導致p62的聚集[23]。本研究結果顯示,模型組細胞LC3Ⅱ/Ⅰ蛋白表達比值降低,綠原酸呈劑量依賴性地上調LC3Ⅱ蛋白表達。而與正常組比較,模型組p62蛋白表達增加;與模型組比較,綠原酸給藥組p62蛋白表達呈劑量依賴性地降低。結果提示,H2O2刺激模擬的氧化應激使線粒體、內質網腫脹破壞,異常的細胞器負載,可能阻斷下游自噬降解途徑,而綠原酸可能通過恢復自噬過程,促使自噬泡形成而發揮保護RGC-5細胞的作用。
綜上所述,綠原酸可以通過調控自噬相關蛋白保護H2O2損傷的小鼠RGC-5細胞,為揭示綠原酸治療糖尿病視網膜病變早期的神經退行性病變的復雜機制提供參考。

