Twist1和血管生成擬態在結直腸癌中的表達和臨床意義*
潘成武,張新鑫,張晨嵩,李 雷,謝 波,李 靖,馬家馳,馮振中
(蚌埠醫學院第一附屬醫院:1.腫瘤外科;2.病理科,安徽蚌埠 233000)
結直腸癌(colorectal cancer,CRC)是最常見的消化道腫瘤。近年來,由于人們生活方式及飲食習慣的改變。CRC在我國的發病率明顯升高,已成為影響我國公民身體健康的重要疾病之一[1]。Twist1是一種在進化上高度保守的螺旋-環-螺旋(basic helix-loop-helix,bHLH)轉錄因子,不僅在胚胎發育、形成過程中具有重要作用,也是誘導腫瘤細胞發生上皮間質轉化(EMT)并促進侵襲轉移的關鍵調控因子[2]。Twist1已被證實是一種在多種腫瘤中過表達的新型致癌基因,可賦予腫瘤細胞更多浸潤性表型特性[3]。血管生成擬態(vasculogenic mimicry,VM)是腫瘤細胞為滿足自身血供需求,通過自身形變及細胞外基質的重塑,形成類似血管樣的血運通道。血管內皮細胞鈣黏連蛋白(VE-cadherin)是其重要的分子。研究表明,VM可以促進多種腫瘤的生長和轉移。然而,Twist1對CRC VM的影響尚不清楚。本研究通過對CRC患者臨床數據進行統計,分析Twist1對CRC侵襲、遷移的影響,探究其對VM的影響。
1 材料與方法
1.1 一般資料
選取本院2011年1月至2014年12月經手術切除CRC,隨訪資料完整并經病理醫生診斷為CRC(術前未行放、化療)的患者124例,取其CRC組織標本,并取30例患者的正常結直腸黏膜標本。患者納入標準:(1)術前經腸鏡活檢確診為原發性CRC;(2)無化療、放療史等其他方法治療史;(3)臨床資料完整。排除標準:(1)合并其他組織起源的惡性腫瘤;(2)死于除CRC以外的其他原因。通過電子病歷系統采集患者臨床資料信息。患者的臨床資料包括年齡、病理分級、淋巴結轉移、血管侵犯、臨床分期等。隨訪至2019年12月或患者死亡。本研究已經通過本院倫理委員會批準并取得患者知情同意。
1.2 主要試劑與材料
HT-29、HCT116、SW480、LOVO直腸癌細胞和HCO正常腸上皮細胞購自上海中科院生物化學研究所。DMEM培養基、胰蛋白酶購自美國Hyclone公司,胎牛血清(FBS)購自浙江天杭生物科技股份有限公司,小干擾RNA(small interfering RNA,siRNA)由上海吉瑪公司設計合成,LipofectaminTM2000購自美國Thermo Scientific公司。Transwell小室、基質膠購自中國碧云天生物技術有限公司;Twist1、VE-cadherin、神經型鈣黏連蛋白(N-cadherin)、Snail、人甘油醛-3 -磷酸脫氫酶(GAPDH)一抗及辣根過氧化物酶標記的羊抗兔/鼠二抗均購于英國Abcam公司。
1.3 免疫組織化學染色
將組織置于4%多聚甲醛中固定4 h,加熱溶解脫水后放入機器組織槽中,隨后3次浸蠟。選取模具,使用機器滴蠟包埋組織。切片機調整切片厚度后均勻切片,隨后將切片置于40 ℃水槽中。切片烤干,于二甲苯溶液及梯度乙醇中脫蠟至水。免疫組織化學實驗步驟參照實驗說明書進行,抗體:Twist1、VE-cadherin(1∶200)。采用已知陽性切片作對照,以PBS代替一抗作為空白對照。由3位病理學醫師采用雙盲法在顯微鏡下觀察組織切片上每個小塊的所有區域,判定染色強度和染色陽性率。判定標準:根據染色強度和染色范圍進行判定。其中染色強度根據顏色分為無染色(0分),淡黃色(1分),棕黃色(2分),深棕色(3分);染色范圍為0分(0~10%)、1分(11%~25%)、2分(26%~50%)、3分(51%~75%)和4分(76%~100%)。用染色強度得分和染色范圍得分的乘積判斷表達結果,積分0~<4分為陰性,4~12分為陽性。
1.4 雙重染色法
CD34免疫組織化學染色,然后將切片置于0.5%高碘酸溶液中氧化5~8 min。流水沖洗2 min,再用蒸餾水洗1次,于暗處置于Schiff液中染色10~20 min,然后用0.5%偏重亞硫酸鈉液滴洗2次,每次1 min,依次蘇木素染色細胞核、鹽酸乙醇分化、返藍、脫水透明及中性樹膠封片。通過CD34與高碘酸-希夫(PAS)雙重染色,在CRC組織切片中觀察到由腫瘤細胞排列形成的管腔樣結構,CD34陽性證實其為VM。
1.5 細胞培養
正常人腸上皮細胞HCO培養于含10% FBS、100 U/mL 青霉素、100 μg/mL 鏈霉素的RPMI-1640培養基,CRC細胞株HT-29、HCT116、SW480、LOVO分別培養于含有10% FBS、100 U/mL 青霉素、100 μg/mL 鏈霉素的DMEM培養基,5% CO2、37 ℃ 條件培養箱中傳代培養。
1.6 細胞轉染
按照脂質體LipofectamineTM2000轉染試劑說明書,將si-NC(si-NC組,陰性對照)、si-Twistl(si-Twistl組)轉染于HCT116細胞。取對數生長期細胞, 于轉染前24 h將細胞以3×105/孔接種于6孔板;轉染時加入相應試劑并混合均勻,將細胞培養基換為無血清培養基,5% CO2、37 ℃ 條件培養箱培養6 h后更換新鮮培養基,然后進行后續實驗。si-Twistl正向:5′-CUG CAG ACG CAG CGG GUC A-3′;反向:5′-UGA CCC GCU GCG UCU GCA G-3′。si-NC 正向:5′-UUC UCC GAA CGU GUC ACG U-3′。反向:5′-ACG UGA CAC GUU CGG AGA A-3′。
1.7 Western blot
收集細胞,加入裂解液完全裂解細胞,12 000×g離心10 min,收集上清液,即為總蛋白溶液。BCA法檢測蛋白濃度,并定量。蛋白上樣,10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,分離后的蛋白轉移至聚偏氟乙烯(PVDF)膜,孵育一抗后,置于冰箱中4 ℃過夜,加入用封閉液稀釋的二抗,室溫孵育60 min。通過凝膠成像系統檢測并計算Twist1、VE-cadherin、EMT和VE相關蛋白表達水平,以GAPDH為內參。
1.8 體外遷移、侵襲實驗
在Transwell下室中加入趨化因子表皮生長因子(EGF,10 ng/mL) 600微升/孔,細胞用無血清培養基制成單細胞懸液,每種細胞做3個復孔,在上室孔中加入200 μL 1×105/L細胞懸液,培養24 h,棄去上室液體,用濕棉簽擦去膜上未穿膜的細胞,蘇木素染色,倒置顯微鏡下觀察穿膜細胞(200×),每張膜中央部分和周圍部分各取3個視野,計數每個視野內穿孔的細胞數。侵襲實驗需要加Matrigel凝膠鋪于Transwell上室。
1.9 統計學處理
2 結 果
2.1 Twist1、VE-cadherin在CRC中的表達及CRC組織中VM形成情況
Twist1在CRC組織中陽性70例,陰性54例,陽性率56.5%;Twist1在正常結直腸黏膜組織中陽性2例,陰性28例,陽性率6.7%。VE-cadherin在CRC組織中陽性60例,陰性64例,陽性率48.4%;VE-cadherin在正常結直腸黏膜組織中陽性1例,陰性29例,陽性率3.3%。Twist1、VE-cadherin在CRC組織中的陽性率較正常結直腸黏膜高,差異有統計學意義(P<0.05)。VM在CRC組織中陽性21例,陰性103例,陽性率16.9%。見圖1。
2.2 CRC中Twist1、VE-cadherin的表達和VM與臨床病理學的關系
為了研究Twist1和VE-cadherin對CRC預后的判斷作用,分析了免疫組織化學結果與患者臨床病例資料的關系,結果表明,Twist1表達與病理分級(P=0.03)、血管侵犯(P=0.04)和淋巴結轉移(P=0.01)有關。VE-cadherin表達與血管侵犯(P<0.01)和淋巴結轉移(P<0.01)有關。VM與病理分級(P<0.01)、TNM分期(P=0.03)、血管侵犯(P<0.01)和淋巴結轉移(P<0.01)有關。見表1。
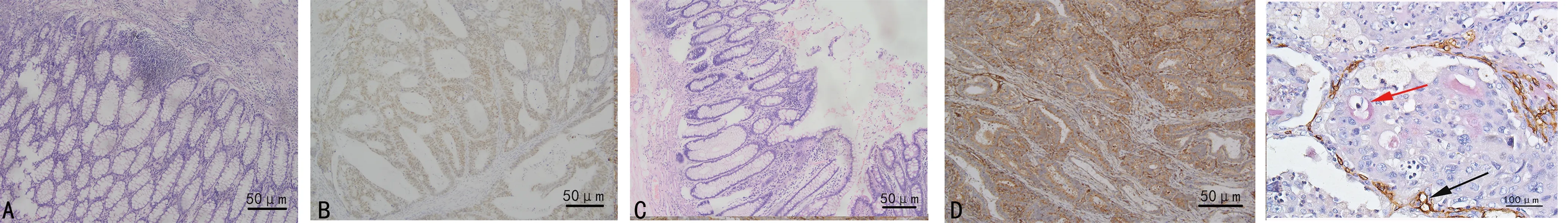
A:Twist1在正常黏膜組織中陰性表達;B:Twist1在CRC組織中陽性表達;C:VE-cadherin在正常黏膜組織中陰性表達;D:VE-cadherin在CRC組織中陽性表達;E:CD34和 PAS雙染,紅色箭頭指示VM結構,黑色箭頭指示血管結構。
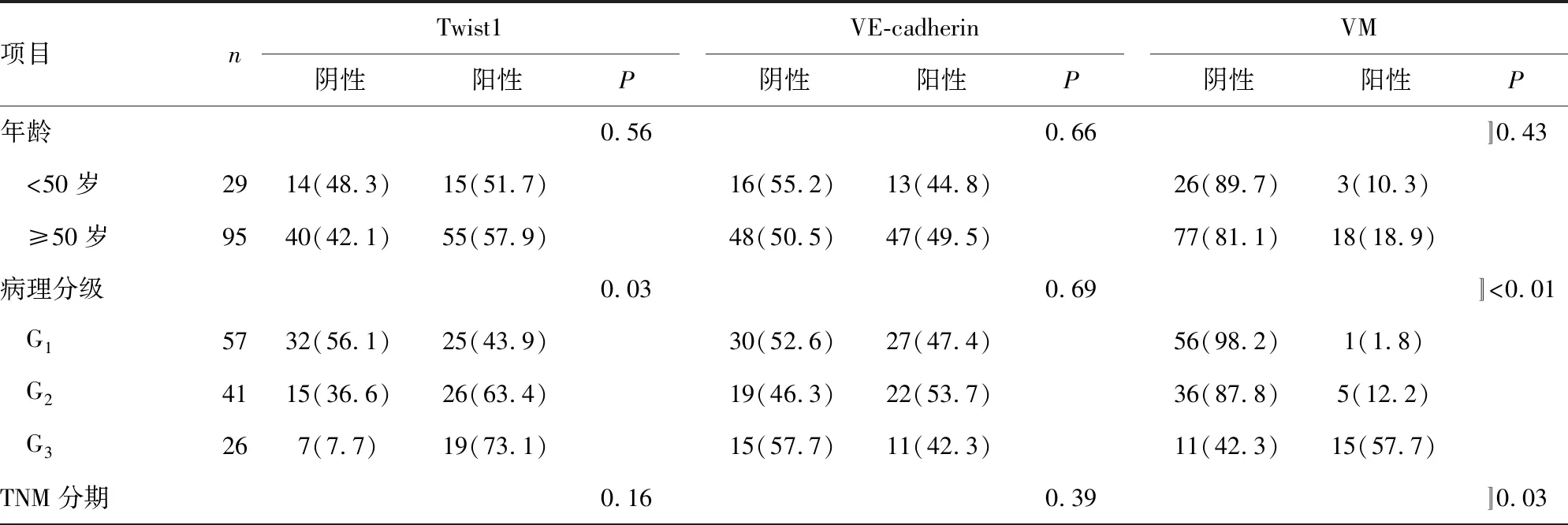
表1 Twist1、VE-cadherin表達和VM與CRC臨床病理因素的關系[n(%)]
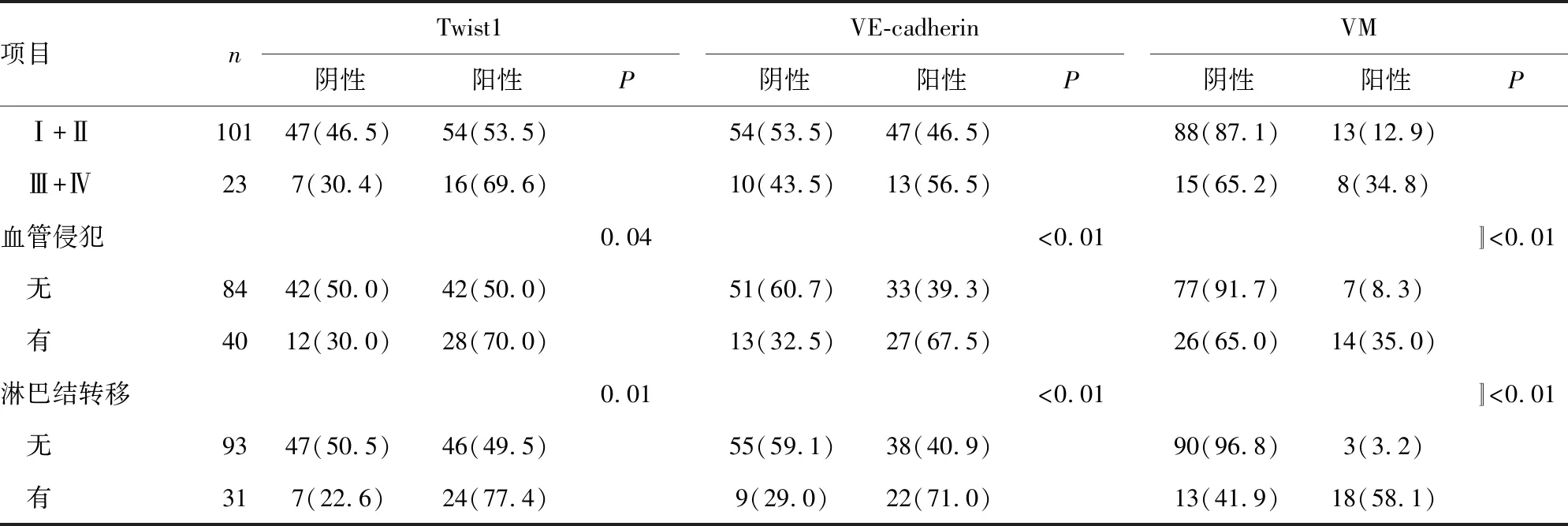
續表1 Twist1、VE-cadherin表達和VM與CRC臨床病理因素的關系[n(%)]
2.3 CRC組織Twist1高表達與低表達組術后5年生存率比較
124例CRC患者隨訪數據分析結果表明,Twist1高表達組(n=69)術后5年生存率明顯低于Twist1低表達組(n=62),差異有統計學意義(P<0.01),見圖2。
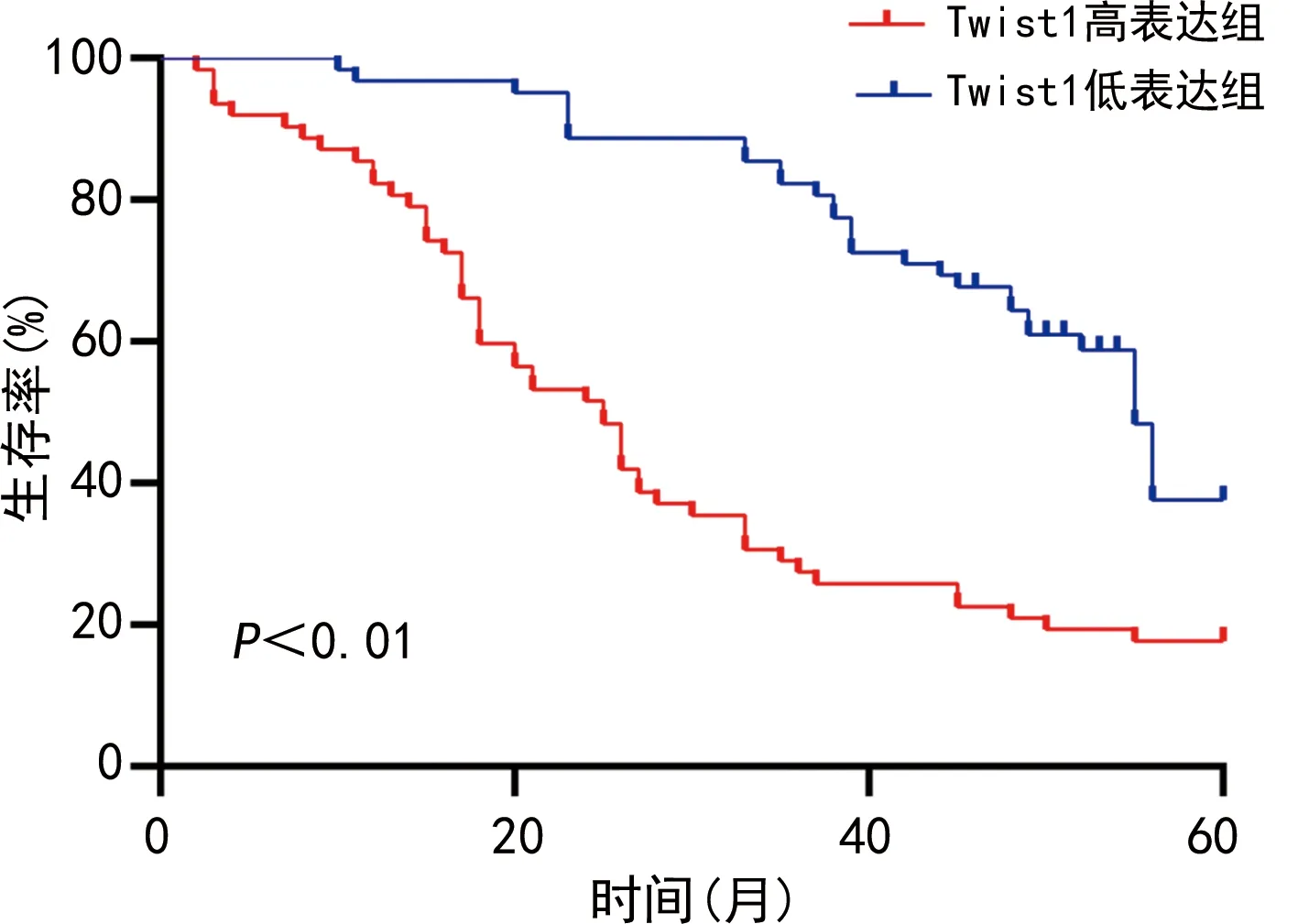
圖2 Twist1高表達組與低表達組術后5年生存率比較
2.4 Twist1在CRC細胞株中的表達
Western blot檢測顯示,與正常腸上皮細胞HCO比較,CRC細胞株HCT116、HT-29、SW480、LOVO中Twist1的表達水平分別是其5.1、4.3、3.4、3.9倍。見圖3。根據細胞株表達情況,選擇表達水平最高的HCT116細胞進行后續實驗。
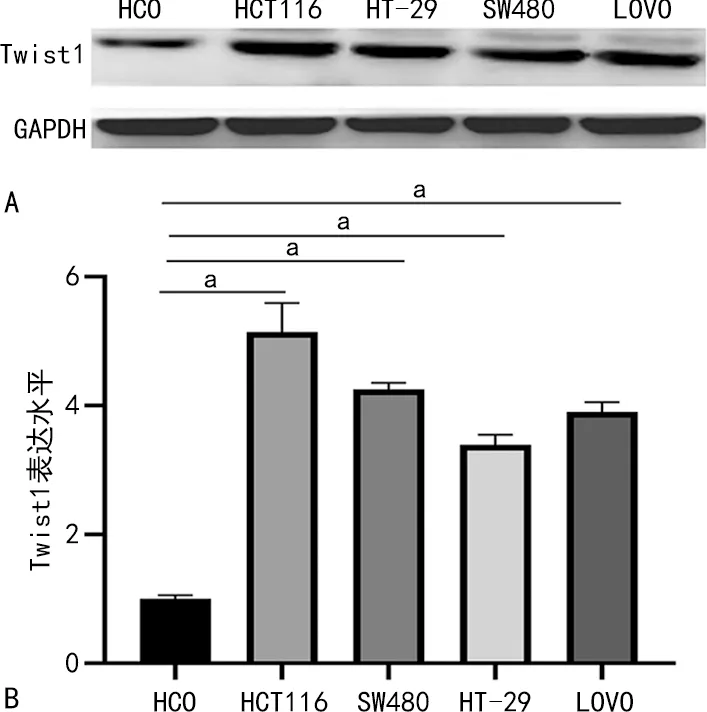
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.5 siRNA沉默Twist1表達后檢測CRC細胞中Twist1表達水平
Western blot檢測顯示,與si-NC組比較,si- Twist1組HCT116細胞中Twist1水平降低,差異有統計學意義(P<0.05)。見圖4。
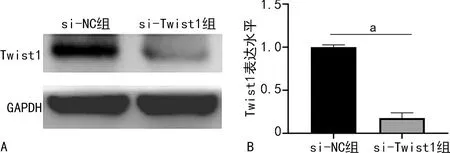
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.6 Twist1對CRC細胞EMT的影響
Western blot檢測結果顯示,與si-NC組比較,si-Twist1組HCT116細胞中N-cadherin、Snail的表達水平下降,差異有統計學意義(P<0.05)。見圖5。
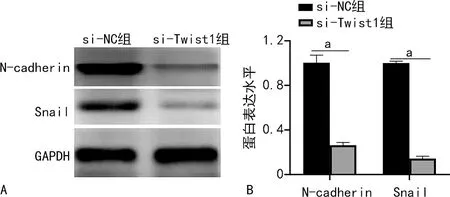
A:Western blot;B:Western blot定量分析;a:P<0.05。
2.7 Twist1對CRC細胞VM的影響
Transwell遷移實驗結果顯示,si-Twist1組48 h HCT116細胞遷移數少于si-NC組,差異有統計學意義(P<0.05);侵襲實驗結果顯示,si-Twist1組48 h HCT116細胞的侵襲細胞數少于si-NC組,差異有統計學意義(P<0.05)。Western blot檢測顯示,與si-NC組比較,si-Twist1組中VE-cadherin表達水平下降,差異有統計學意義(P<0.05)。見圖6。
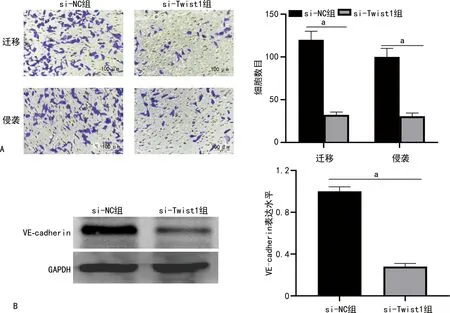
A:細胞遷移及侵襲實驗及定量分析;B:VE-cadherin Western blot檢測及定量分析;a:P<0.05。
3 討 論
CRC在世界范圍內發病率排名第3,病死率排名第4,其中70%為結腸癌[4]。盡管CRC的治療有了進步,但其病死率仍很高[5]。因此,需要更可靠的分子預后標志物來改善CRC的診斷和治療。
腫瘤的生長和轉移需要足夠的營養和氧氣,“抗腫瘤血管生成的治療”已成為近年來腫瘤研究一大熱點。在惡性腫瘤研究中發現的一種PAS染色陽性,CD34等內皮細胞標志物染色陽性的管網狀結構被命名為VM,并推測其參與了腫瘤的微循環過程[6]。VM是指某些高侵襲性腫瘤為滿足自身的血供,腫瘤細胞在沒有血管內皮細胞的參與下,能夠模擬內皮細胞并形成管樣結構,引起惡性腫瘤細胞可塑性改變、細胞外基質重塑并可以與宿主的微循環系統相通[7]。VM能夠促進新生血管形成,并與腫瘤侵襲、轉移及患者預后密切相關,在諸如乳腺癌、前列腺癌、卵巢癌、肝癌等上皮來源的腫瘤中相繼證實了VM 的存在[8-10]。
VE-cadherin是血管內皮細胞中表達cadherin超家族的成員,是內皮細胞黏附連接的主要黏附受體。研究表明VE-cadherin在VM的形成中起著重要作用。VE-cadherin已被報道在多種腫瘤細胞中過表達,并參與腫瘤的新血管形成、生長和進展。已有研究表明,VE-cadherin的異常表達促進了惡性黑色素瘤的進展和轉移,并參與了該腫瘤的VM。TANG等[11]預測HIF-1α可以直接或間接調控VE-cadherin、EphA2和Laminin 5γ2 (LN5γ2)基因的表達。它還能促進VM的形成,為CRC提供血供。但尚不清楚CRC中VM與VE-cadherin的相關性是否與其他因子的異常表達有關。
近年來,多項研究表明Twist家族堿性bHLH轉錄因子1(即Twist1)在膀胱癌、胃癌、鼻咽癌、前列腺癌、乳腺癌和滑膜肉瘤等多種癌癥中均高表達。本研究通過收集CRC患者數據,同時結合免疫組織化學結果分析,發現Twist1、VE-cadherin在CRC中高表達。在高度惡性的CRC中存在VM現象,Twist1、VE-cadherin的過表達和VM與CRC的血管侵犯、淋巴結轉移等惡性生物學明顯相關。對術后患者進行隨訪調查發現,Twist1高表達組術后5年生存率明顯低于Twist1低表達組。本研究創新性地利用臨床數據分析了Twist1、VE-cadherin和VM與CRC臨床病理特征的相關性,并且發現Twist1的表達與臨床預后相關。
Twist1在腫瘤發生發展中的作用涉及多種機制,包括調節腫瘤細胞生長、分化、抑制凋亡、增加化療耐藥性、促進腫瘤血管生成[12-16]。已有研究表明,Twist1下調了肝癌細胞E-cadherin的表達水平,上調了VE-cadherin和基質金屬蛋白酶-9(MMP-9)、MMP-2的表達水平,以促進肝癌細胞VM的形成[17]。然而,關于Twist1在CRC中VM形成的研究有限。為進一步驗證臨床結果Twist1對VM的影響。本研究沉默CRC細胞株HCT116 Twist1的表達,發現CRC細胞侵襲、遷移及EMT受到抑制。此結果說明Twist1表達水平可能影響侵襲、遷移及EMT。為了進一步研究Twist1與VM的關系,本研究通過Western blot檢測VM重要分子VE-cadherin的表達,發現抑制Twist1表達水平,VE-cadherin的表達水平也受到抑制。這些結果均表明,Twist1的表達水平與VM相關分子VE-cadherin表達相關。然而,筆者并未深入研究VM形成的機制,本課題組將在后續研究中繼續深入探索。
綜上所述,Twist1在CRC組織中高表達并與腫瘤的轉移和發展相關,對評估預后具有一定的價值。基礎實驗證實,Twist1通過影響VM來影響腫瘤的轉移和發展。而其具體的作用機制仍需進一步探索。

