lncRNA TMEM161B-AS1通過調控hsa-miR-135b對高糖誘導腎小管上皮細胞增殖和凋亡的影響
杜 然,王 湘,李希平,崔應東,曾 光
糖尿病腎病是糖尿病患者常見并發癥之一,主要表現為腎小管上皮細胞損傷,最終導致腎臟纖維化和腎功能下降[1]。近年糖尿病腎病已成為重要的公共衛生問題,嚴重影響患者的生存質量[2]。腎小管上皮細胞活力下降和凋亡增加是糖尿病腎小管上皮細胞損傷的關鍵因素[3]。糖尿病影響腎小管上皮細胞活力和凋亡的確切分子機制并不清楚。長鏈非編碼RNA(lncRNA)是一類長度普遍>200個核苷酸的單鏈非編碼RNA,調控各種底物基因的轉錄和翻譯,參與調控泌尿系統的發育和病理改變[4]。已有研究證實,高糖能夠誘導腎小管上皮細胞中lncRNA表達下調或上調,調控lncRNA的表達可有效抑制腎小管上皮細胞的損傷[5-7]。TMEM161B-AS1是一種lncRNA,其基因定位于人染色體5q14.3,長度為409個核苷酸,作為癌基因或抑癌基因參與多種腫瘤的發生發展過程。然而,目前并不清楚TMEM161B-AS1在糖尿病腎小管上皮細胞損傷中的作用。本文探究TMEM161B-AS1在高糖誘導腎小管上皮細胞增殖和凋亡中發揮的作用,并明確其確切分子機制,為探究新的糖尿病腎病防治靶點提供實驗基礎。
1 材料與方法
1.1細胞與試劑 人腎小管上皮細胞HK-2購于中國科學院細胞庫;DMEM培養基、胎牛血清、Lipofectamine 3000試劑盒購于中國賽默飛科技有限公司;細胞凋亡檢測試劑盒、qRT-PCR試劑盒購于北京索萊寶科技有限公司;雙熒光素酶檢測試劑盒、TMEM161B-AS1過表達載體、陰性對照載體購于美國Promega公司;hsa-miR-135b、has-miR-NC、野生型TMEM161B-AS1 WT和突變型TMEM161B-AS1 Mut質粒購于蘇州泓迅生物科技有限公司;α-SMA、β-Tubulin、Fibronectin、E-Cadherin、Claudin-1、ZO-1單克隆抗體購于美國Santa Cruz Biotechnology公司。
1.2細胞高糖培養與分組轉染 在水浴鍋中快速解凍凍存的HK-2細胞,使用含5%胎牛血清、30 mmol/L葡萄糖的DMEM培養基,于5% CO2、37 ℃的培養箱內常規培養。將細胞分別接種于12孔板,繼續培養12 h,按照Lipofectamine 3000試劑盒說明書,分別將TMEM161B-AS1過表達載體、陰性對照載體轉染至HK-2細胞,設為TMEM161B-AS1組和對照組,常規培養36 h后進行后續操作。
1.3qRT-PCR檢測TMEM161B-AS1、hsa-miR-135b表達 Trizol法抽提2組細胞總RNA,通過微量分光光度計分析總RNA濃度和純度,逆轉錄得到cDNA。qRT-PCR反應程序為96 ℃ 55 s、59 ℃ 27 s、73 ℃ 27 s,進行40個循環。以GAPDH為內參計算TMEM161B-AS1相對表達量,以U6為內參計算hsa-miR-135b相對表達量,引物序列見表1。
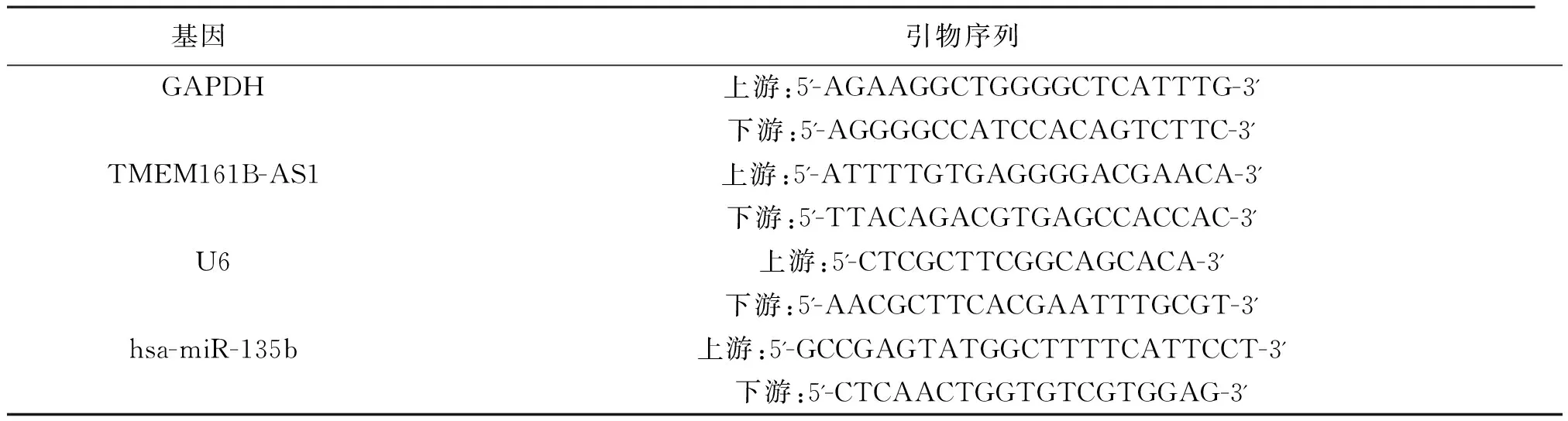
表1 TMEM161B-AS1、hsa-miR-135b及其內參的引物序列
1.4CCK-8法檢測HK-2細胞增殖 將2組細胞接種于96孔板,每孔6×103個。繼續培養1、2、3、4、5 d后,每孔加入25 μl的CCK-8試劑,于培養箱內培養5 h,使用多功能酶標儀在波長460 nm處檢測每孔光密度(OD)值,繪制各組細胞生長曲線。
1.5流式細胞術檢測HK-2細胞凋亡 收集2組和對照組細胞,用預冷的磷酸鹽緩沖液清洗4次,加入結合緩沖液調整細胞密度為5×105/ml,分別加入PI試劑和FITC-Annexin V工作液各6 μl,在暗室內孵育30 min。加入600 μl結合緩沖液,立即通過流式細胞儀檢測HK-2細胞凋亡率。
1.6生物信息學軟件預測和雙熒光素酶報告基因實驗測定 利用在線靶基因預測軟件LNCediting預測TMEM161B-AS1的靶基因。按照Lipofectamine 3000試劑盒說明書,分別將hsa-miR-135b、has-miR-NC、TMEM161B-AS1 WT及TMEM161B-AS1 Mut質粒轉染至HK-2細胞,轉染50 h后,使用雙熒光素酶檢測試劑盒檢測不同細胞相對熒光素酶活性。
1.7Western blot檢測HK-2細胞α-SMA、Fibronectin、E-Cadherin、Claudin-1和ZO-1蛋白表達 使用含有苯甲基磺酰氟的裂解液裂解細胞,離心并收集上清,測定蛋白濃度后,每組取60 μg蛋白添加到凝膠孔,進行蛋白電泳。完成蛋白電泳后,進行轉膜。采用8%脫脂奶粉去除非特異性結合位點,加入一抗稀釋液α-SMA(1∶2000)、β-Tubulin(1∶1000)、Fibronectin(1∶2000)、E-Cadherin(1∶2000)、Claudin-1、ZO-1(1∶2000),其中β-Tubulin為內參,于4 ℃下孵育8 h。添加特異性二抗稀釋液(1∶7000),室溫孵育3 h。配制ECL發光液,均勻滴加在條帶上,采用凝膠成像系統曝光蛋白條帶。
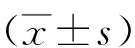
2 結果
2.1TMEM161B-AS1的二級結構 采用RNA二級結構預測軟件UFold預測TMEM161B-AS1的二級結構,見圖1。
2.2TMEM161B-AS1過表達載體對高糖誘導HK-2細胞TMEM161B-AS1表達的影響 qRT-PCR檢測結果顯示,對照組和TMEM161B-AS1組細胞TMEM161B-AS1表達水平分別為0.98±0.12和8.21±1.85。與對照組比較,TMEM161B-AS1組細胞TMEM161B-AS1表達水平明顯升高(P<0.01)。
2.3TMEM161B-AS1對高糖誘導HK-2細胞增殖的影響 CCK-8法檢測結果顯示,與對照組比較,TMEM161B-AS1組細胞培養2~5 d增殖能力顯著升高(P<0.05,P<0.01)。見圖2。
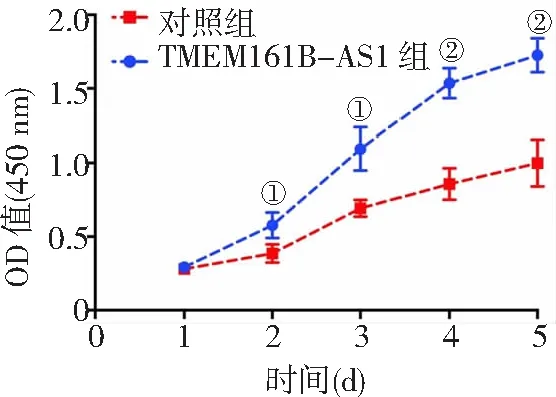
圖2 TMEM161B-AS1對高糖誘導HK-2細胞增殖的影響
2.4TMEM161B-AS1對高糖誘導HK-2細胞凋亡的影響 流式細胞術檢測結果顯示,對照組和TMEM161B-AS1組細胞凋亡率分別為(12.06±2.46)%和(7.06±0.47)%。與對照組比較,TMEM161B-AS1組細胞凋亡率明顯降低(P<0.01)。見圖3。
圖3 TMEM161B-AS1對高糖誘導HK-2細胞凋亡的影響
2.5生物信息學軟件預測TMEM161B-AS1的靶基因 通過在線軟件LNCediting預測顯示,TMEM161B-AS1與hsa-miR-135b存在互補結合位點。見圖4。

圖4 LNCediting軟件預測TMEM161B-AS1的靶基因
2.6TMEM161B-AS1與hsa-miR-135b的關系 雙熒光素酶報告基因實驗結果顯示,與轉染has-miR-NC比較,轉染hsa-miR-135b能顯著降低HK-2細胞TMEM161B-AS1 WT的熒光素酶活性(P<0.01),二者對于TMEM161B-AS1 Mut熒光素酶活性無明顯影響(P>0.05)。提示hsa-miR-135b能抑制HK-2細胞TMEM161B-AS1 WT熒光素酶活性,但不能降低TMEM161B-AS1 Mut熒光素酶活性。見圖5。
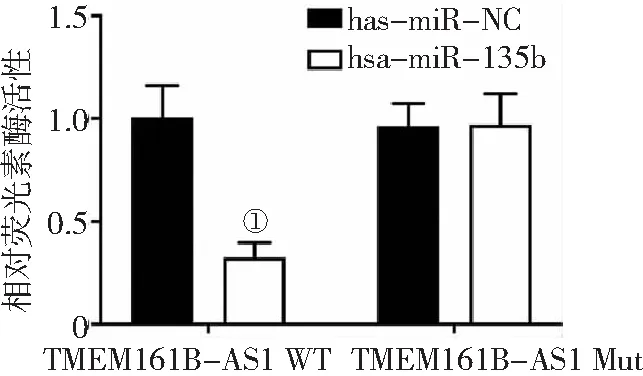
圖5 雙熒光素酶報告基因實驗驗證TMEM161B-AS1與hsa-miR-135b的關系
2.7TMEM161B-AS1對hsa-miR-135b表達的影響 qRT-PCR檢測結果顯示,對照組和TMEM161B-AS1組細胞hsa-miR-135b表達水平分別為5.37±0.99和1.06±0.51。與對照組比較,TMEM161B-AS1組細胞hsa-miR-135b表達水平明顯降低(P<0.01)。
2.8TMEM161B-AS1對高糖誘導HK-2細胞上皮-間質轉化表型蛋白的影響 Western blot檢測結果顯示,與對照組比較,TMEM161B-AS1組上皮細胞表型蛋白ZO-1、E-Cadherin、Claudin-1表達明顯增加,間質細胞表型蛋白α-SMA、Fibronectin表達明顯降低(P<0.05)。見圖6。
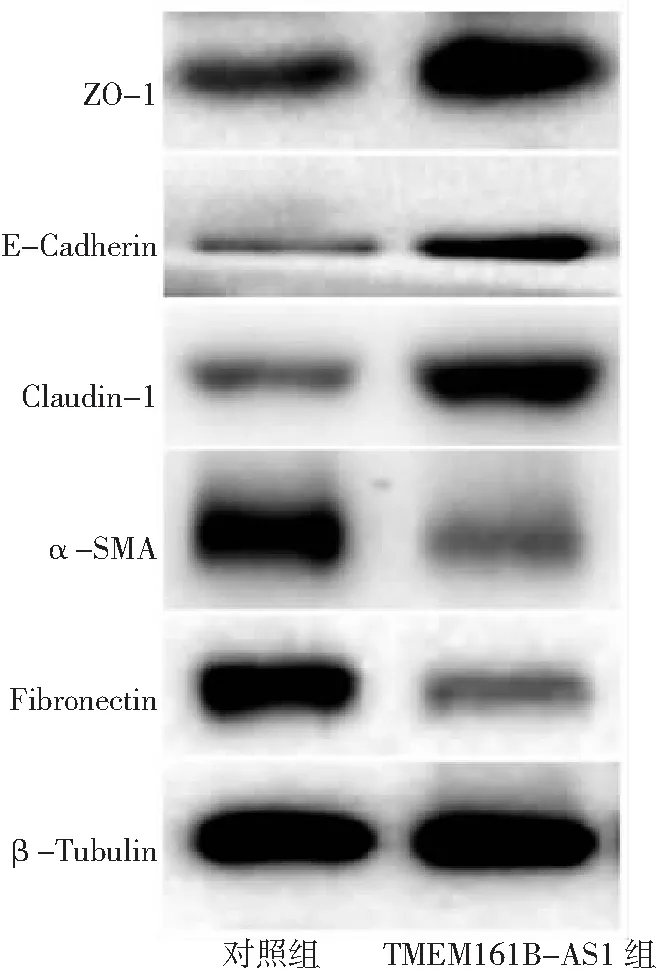
圖6 Western blot檢測TMEM161B-AS1對HK-2細胞上皮-間質表型蛋白的影響
3 討論
糖尿病腎病是一種糖尿病微血管并發癥,最終導致終末期腎病[8]。高糖誘導的腎小管上皮細胞損傷涉及多種分子信號通路的異常改變[9]。lncRNA是一種表觀遺傳修飾因子,通過改變染色質結構、調節基因轉錄水平和轉錄后修飾,影響細胞的生理和病理行為[10-11]。近年來,lncRNA已成為糖尿病腎病研究的熱點。有研究表明,lncRNA Dlx6os1在糖尿病腎病小鼠腎臟組織中高表達,敲低lncRNA Dlx6os1表達能夠抑制高糖誘導腎小球系膜細胞增殖、纖維化和炎性細胞因子釋放[12]。lncRNA PAX8-AS1-N在糖尿病腎病患者血液和尿液中低表達,能通過直接靶標miR-17-5p增強小鼠足細胞的增殖能力并降低細胞的凋亡比例[13]。lncRNA lnc-ISG20在糖尿病腎病小鼠腎組織中表達升高,沉默lncRNA lnc-ISG20表達能夠減輕高糖誘導的腎臟纖維化,可能成為糖尿病腎病的診斷指標[14]。
TMEM161B-AS1是一個功能性lncRNA。SHI等[15]研究結果顯示,TMEM161B-AS1在食管鱗狀細胞癌組織中表達低于正常組織樣本,其低表達與食管鱗狀細胞癌患者TNM分期、淋巴結轉移和預后不良有關,過表達TMEM161B-AS1能抑制食管鱗狀細胞癌細胞的葡萄糖消耗和乳酸產生。CHEN等[16]研究顯示,TMEM161B-AS1能夠上調多個鐵死亡相關基因的表達,從而促進膠質細胞瘤的惡性生物學行為及對替莫唑胺的耐藥性。TMEM161B-AS1在腎小管上皮細胞中的功能尚不明確。
本研究顯示,上調TMEM161B-AS1能夠促進HK-2細胞的增殖,抑制HK-2細胞的凋亡。提示TMEM161B-AS1可能在高糖誘導腎小管上皮細胞中發揮保護作用,從而抑制糖尿病腎病的進展。既往研究證實,miRNA是一種高度保守的不具有編碼功能的轉錄本,lncRNA能夠靶向結合特定miRNA,覆蓋其功能區域,從而調節細胞的各種生命活動[17-19]。本研究顯示,TMEM161B-AS1與hsa-miR-135b存在結合位點。雙熒光素酶報告基因實驗證實TMEM161B-AS1與hsa-miR-135b序列間直接結合。本研究還顯示,HK-2細胞TMEM161B-AS1表達升高后,hsa-miR-135b表達被抑制。以上結果表明HK-2細胞存在TMEM161B-AS1/hsa-miR-135b信號調控通路。已有研究表明,在高糖刺激的腎小管上皮細胞中hsa-miR-135b表達顯著上調,hsa-miR-135b參與高糖誘導的氧化應激過程,抑制腎小管上皮細胞的增殖并促進其凋亡[20]。腎小管上皮細胞損傷能夠誘發上皮-間質轉化,是最終發展至腎纖維化的重要環節[19]。本研究結果顯示,TMEM161B-AS1表達上調后,高糖誘導HK-2細胞的上皮細胞表型蛋白ZO-1、E-Cadherin、Claudin-1表達明顯增加,間質細胞表型蛋白α-SMA、Fibronectin表達明顯降低,表明TMEM161B-AS1能夠抑制HK-2細胞的上皮-間質轉化,
綜上所述,lncRNA TMEM161B-AS1通過抑制hsa-miR-135b表達,促進高糖誘導HK-2細胞增殖、抑制其凋亡及上皮-間質轉化,從而參與腎小管上皮細胞的功能活動,通過調控相關通路促進腎小管上皮細胞的增殖并抑制其凋亡。

