桑寄生治療帕金森病的分子機制與作用特點
龔莉焰,李雙陽,白雪
1.西南醫科大學 中西醫結合學院(瀘州646000);2.西南醫科大學附屬中醫醫院神經內科(瀘州 646000)
帕金森病(parkinson's disease,PD)是一種好發于50 歲以上的中老年人、以運動障礙為主要表現的神經系統退變性疾病。PD 的發病機制主要認為與線粒體功能障礙、氧化應激、毒性蛋白質聚集等反應引起黑質、紋狀體等部位的多巴胺能神經元變性死亡有關[1]。抗帕金森病首選藥物治療,作為金標準的左旋多巴是最有效的對癥治療藥物[2-3],但長期用藥后大部分病人會出現癥狀波動及異動癥為主的運動并發癥[4],未來我國PD 患病人數將占到全球PD 患病人數的一半[2]。因此,有效防治帕金森病,減少并發癥至關重要。
《本草求真》言:“桑寄生,號為補腎補血要劑”,其味苦、甘,平,歸肝、腎經,有補肝腎,強筋骨等功用[5],以桑寄生為主的方劑常用于改善帕金森病引起的睡眠障礙、肢體震顫、腰膝酸軟等癥狀。滋腎平顫湯(桑寄生、莪術、白芍等)聯合左旋多巴組較單純使用左旋多巴組不僅更有效地改善了帕金森病病人的動作遲緩、顫振等運動癥狀,提高病人日常生活能力與運動功能,而且在緩解睡眠障礙等非運動癥狀的同時并未增加不良反應[6-7]。楊戈等[8]也通過對MPTP誘導的PD模型小鼠的行為學觀察,發現加味天麻鉤藤飲組可改善PD模型小鼠的運動遲緩、步態異常及少動癥狀。此外,桑寄生中主要成分也被證實在抗PD 方面發揮了重要作用。槲皮苷[9]可顯著改善神經毒性物質所致的神經損傷,江苪等[10]發現槲皮苷可以通過抑制細胞凋亡線粒體途徑中相關蛋白Cytc和caspase-3的表達以保護H2O2誘導的PC12 細胞損傷,劉菡等[11]通過實驗證明槲皮苷可通過激活PI3K/Akt/FoxO3a 信號通路,顯著降低6-OHDA 處理后PC12 細胞中Caspase-3 和Bcl-2 的表達、升高Bax的表達,提高神經細胞活性、降低細胞凋亡水平,從而發揮抗PD作用。槲皮素可從多條途徑在PD等神經系統退行性疾病中發揮神經保護作用,如抗氧化應激、保護線粒體、抑制谷氨酸的興奮性神經毒性作用等[12]。齊墩果酸[13]也能發揮抗抑郁、抗神經毒性、改善學習記憶等多方面改善PD運動和(或)抑郁、認知障礙等非運動癥狀[14]。由此可見,桑寄生在PD的治療中發揮了重要作用,但由于中藥具有“多成分、多靶點、多通路”的特點,具體的作用機制尚不明確。本研究基于網絡藥理學方法,對桑寄生治療PD 的主要活性成分、重要靶點及相關生物學過程和信號通路進行有效預測和推斷,為后續研究PD治療提供新的思路。
1 材料與方法
1.1 桑寄生主要活性成分和靶點的收集、轉換
通過中藥系統藥理學數據庫和分析平臺(Tradi?tional Chinese Medicine Systems Pharmacology,TCMSP),以口服生物利用度(oral bioavail ability,OB)≥30%和類藥性(drug-likeness,DL)≥0.18 作為篩選條件,篩選桑寄生主要活性成分。同時根據相關文獻檢索查找桑寄生治療帕金森病可能活性成分[15-16],并利用Swiss ADME 進行篩查(篩查條件:GI absorption:HIGH,drug?likeness 中至少2 個YES)。匯總所有活性成分,通過SwissTargetPrediction(http://www.swisstarget-prediction.ch/)數據庫進行靶點預測(篩選標準:同時滿足3D相似性閾值設置為0.75、2D相似性閾值設置為0.45及Prob?ability>0),并利用UniProt 數據庫(https://www.uniprot.org/)進行基因轉換。
1.2 帕金森病靶點獲取
以“Parkinson Disease”或“Parkinson's disease”為關鍵詞在Disgenet 數據庫(https://www.disgenet.org/)中檢索帕金森病相關靶點,將所得疾病靶點匯總去重(注:disgenet 數據庫中Score_gda 的值越高,代表該靶點與PD 聯系越密切,本研究篩選標準為Score_gda ≥0.2;genecards數據庫中按照revwlance score由大至小排列,選取前120條)。
1.3 “活性成分-關鍵靶點”網絡構建與分析
應用韋恩圖Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/),分別將篩選所得藥物、疾病相關靶點輸入到List1和List2下面的欄目中,獲取藥物-疾病韋恩圖及交集靶點。
1.4 交集靶點蛋白相互作用(PPI)網絡的構建與分析
將交集靶點導入STRING11.0 數據庫(https://string-db.org/)構建PPI 網絡圖,設置條件如下:蛋白質種類設置為“homo sapiens(人類)”,作用閾值設置為“medium confidence(0.400)”,其他條件維持設置默認。根據PPI 網絡中靶點的Degree 值作為依據篩選核心靶點,并通過Cytoscape3.9.0 軟件進行相應分析并獲得蛋白互作關系網絡。
1.5 GO分析和KEGG通路分析
利用CytoScape 中Metascape 組件對交集靶點進行GO富集分析和KEGG代謝通路富集分析,同時采用線上繪圖工具微生信(http://www.bioinformatics.com.cn/)將富集結果可視化,并通過Cytoscape3.9.0 軟件繪制“疾病-藥物-成分-交集靶點-KEGG 通路”網絡圖。
1.6 分子對接
將主要化合物與PPI 網絡中Drgree 值前三的交集靶點分別進行分子對接。從PubChem數據庫中獲取主要活性成分3D 結構,通過OpenBabel 2.4.1 軟件轉化成mol2 結構。同時從PDB(http://www1.rcsb.org/)數據庫中獲取適合化合物的蛋白晶體結構的3D 分子結構。將上述結構通過Auto Dock Tools 1.5.6 軟件及Auto Dock Vina 軟件進行分子對接。一般認為,結合能小于-5 kcal/mol,化合物分子與受體結合能越低,二者結合能力及發生作用的可能性越大,對接結果更加可靠。
2 結果
2.1 桑寄生主要活性成分及其成分靶點
通過TCMSP數據庫篩選(篩選條件:OB ≥30%,DL≥0.18)得到2個化合物,即表1中1-2。通過文獻檢索及SwissADME 篩查得到桑寄生2 個化合物,即表1 中3-4。通過TCMSP、SwissTargetPrediction 等數據庫處理后,最終篩選得到268個靶點,見圖1。
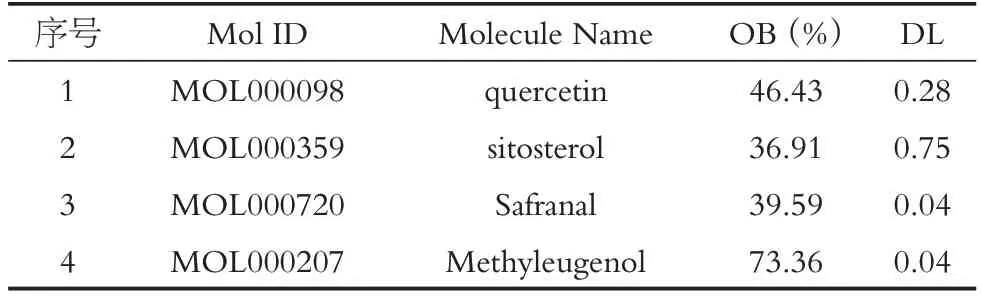
表1 桑寄生主要活性成分表Table 1 Main active components of parasitic loranthus
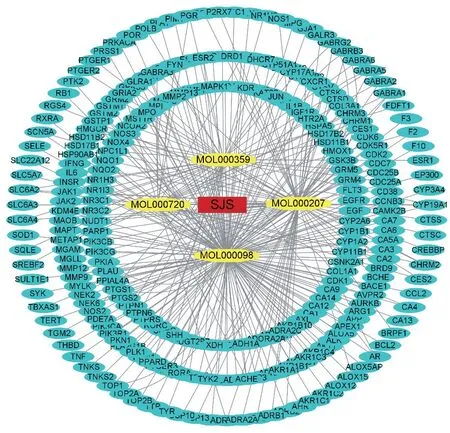
圖1 藥物-活性成分-靶點相互作用網絡圖Figure 1 Network diagram of drug-activity-target interaction
2.2 帕金森病相關靶點及桑寄生治療帕金森病關鍵靶點
經篩選去重,最終選取223 個疾病靶點。桑寄生與PD靶點上傳至Venny2.1.0后獲得27個交集靶點(見圖2),分別為:MAPT、APP、SLC6A3、TNF、IL6、TP53、SOD1、IL1B、ADH1C、PON1、NOS3、IFNG、MPO、TTR、MAOB、DRD2、DRD1、IGF1R、MAOA、HMOX1、GSTM1、ABCB1、NOS1、GSTP1、NQO1、INSR、GSK3B。

圖2 疾病、藥物交集靶點Venny圖Figure 2 Venny diagram of intersection targets of diseases and drugs
2.3 PPI網絡構建與分析
將27個關鍵靶點輸入String(https://string-db.org/)中查詢它們之間的相互作用關系,構建PPI蛋白互作網絡圖(見表2、圖3)。
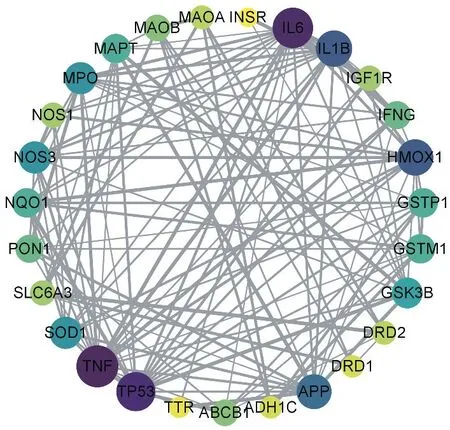
圖3 桑寄生抗帕金森蛋白靶點相互作用網絡圖Figure 3 Network diagram of anti-Parkinson's protein target interaction of mulberry parasite
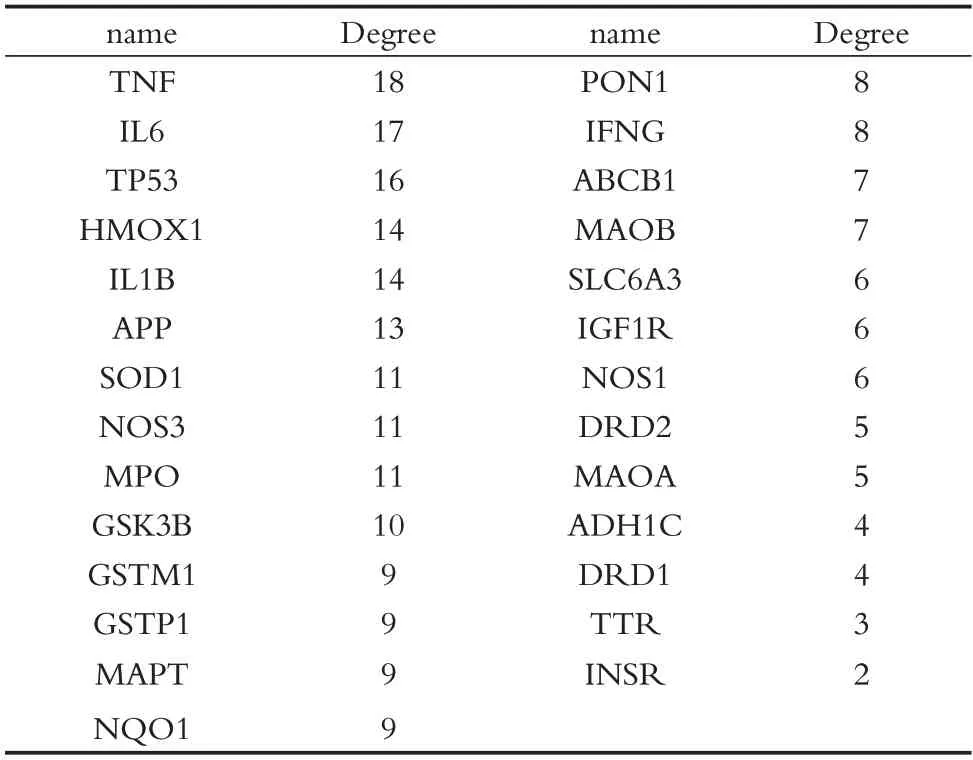
表2 藥物、疾病交集靶點Table 2 Intersection targets of drugs and diseases
2.4 富集分析結果
為了闡明桑寄生治療帕金森病的作用機制,我們對交集靶點進行GO及KEGG富集分析。GO富集分析中(P<0.05)生物過程(biological process,BP)、細胞組分(cell components,CC)、分子功能(molecular function,MF)的條目各637 條、40 條及31 條(見圖4),KEGG 富集分析得到82條(見表3、圖5)
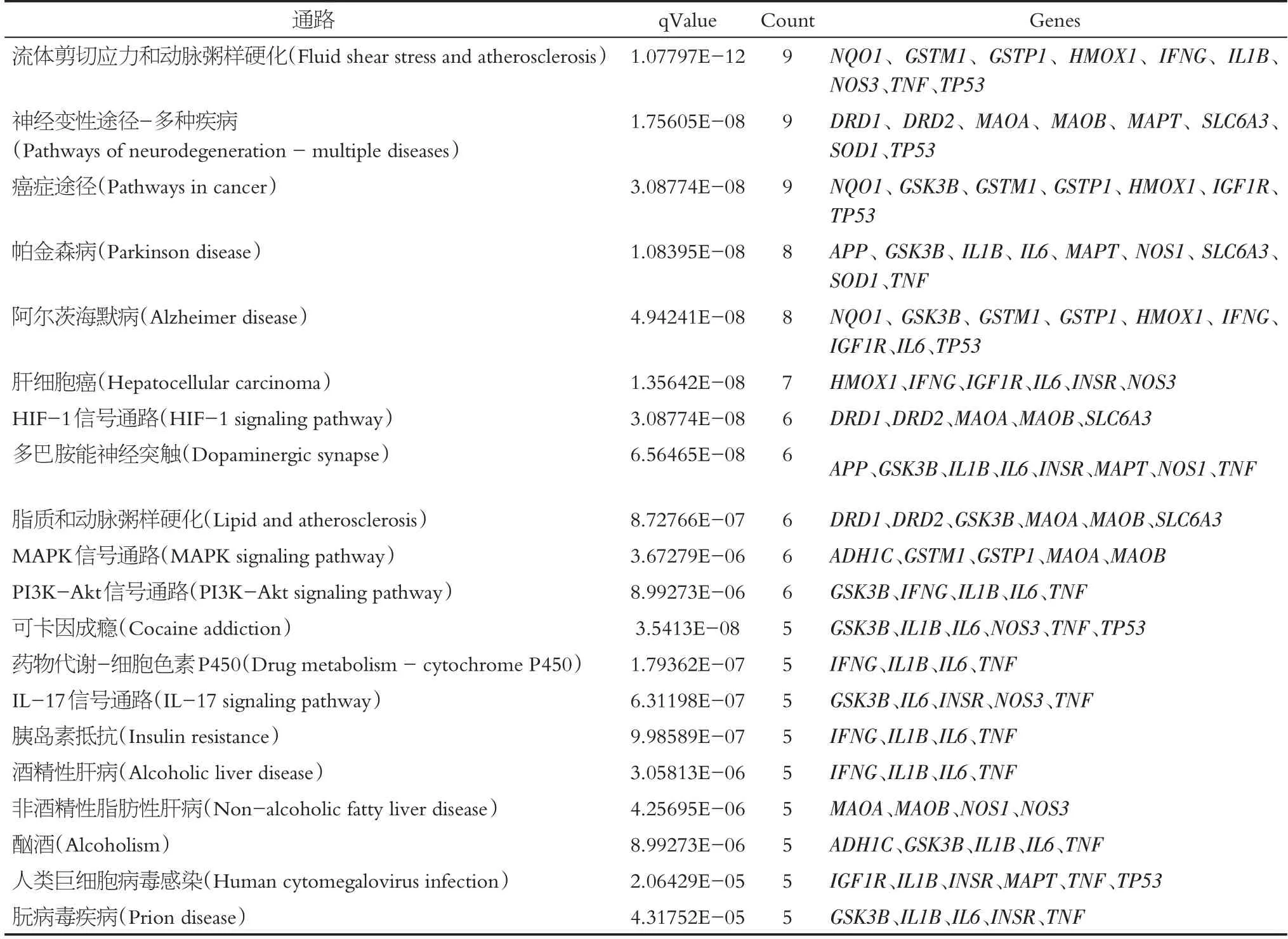
表3 排序前20的KEGG富集條目信息Table 3 Information of KEGG enrichment items in top 20

圖4 GO三合一富集柱狀圖Figure 4 Histogram of GO enrichment in three phases
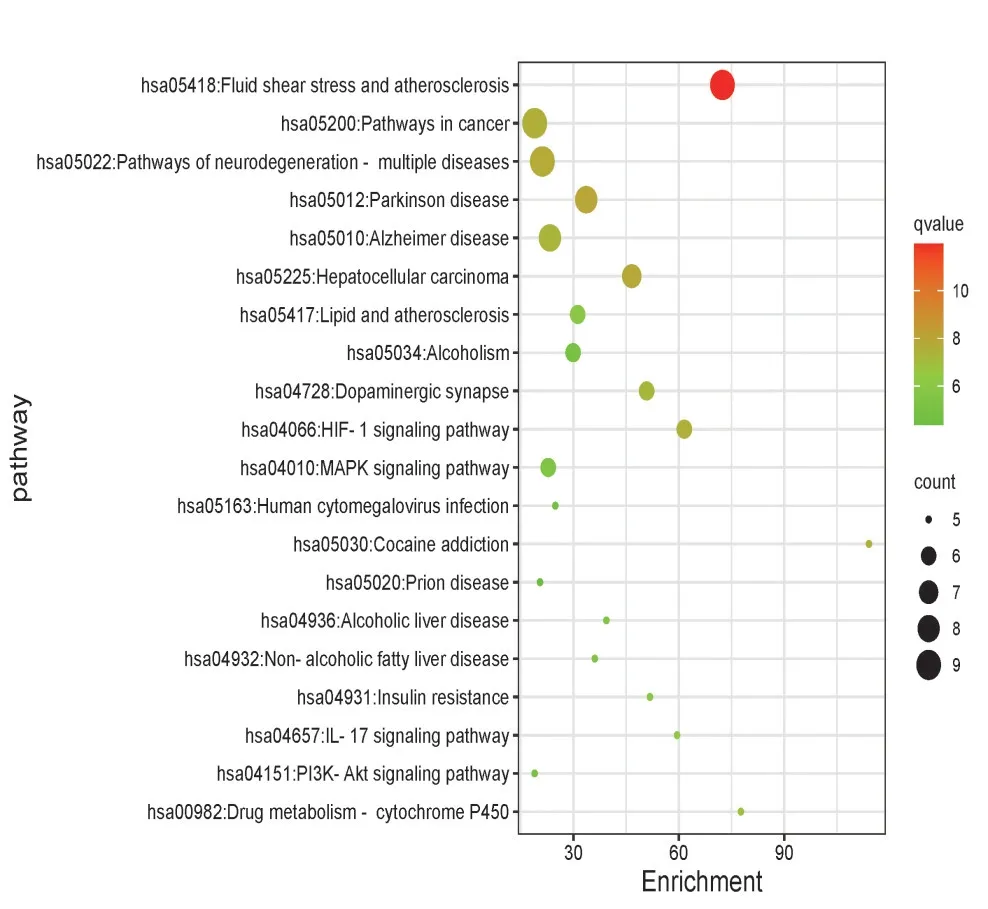
圖5 KEGG通路分析中排名前20的通路圖Figure 5 Top 20 pathways in KEGG pathway analysis
2.5 “疾病-藥物-活性成分-關鍵靶點-KEGG 通路”網絡構建
將桑寄生的2個活性成分、桑寄生-PD的20個交集靶點、KEGG 通路匯總建立表格后導入Cyto?scape3.9.0 軟件中構建桑寄生抗PD 的“疾病-藥物-活性成分-交集靶點-KEGG通路”網絡圖(見圖6)。
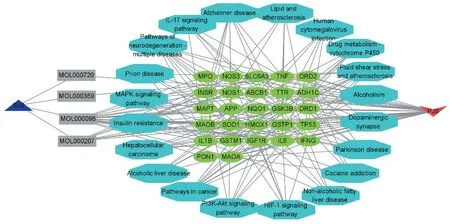
圖6 “帕金森病-桑寄生-活性成分-交集靶點-KEGG通路”網絡圖Figure 6 Network diagram of"Parkinson's disease-Mulberry parasite-active component-intersection target-KEGG pathway"
2.6 分子對接結果
經篩選,degree值前三的交集靶點是TNF(PDB ID:2AZ5)、IL6(PDB ID:1ALU)與TP53(PDB ID:4KVP)。分別將4種活性成分與上述靶點進行VINA分子對接,可以發現,除甲基丁香酚與IL6、4KVP 結合能大于-5 kcal/mol外,其余結合能均遠小于-5 kcal/mol,能夠形成較為穩定的構象結構。分子對接結果見表4。
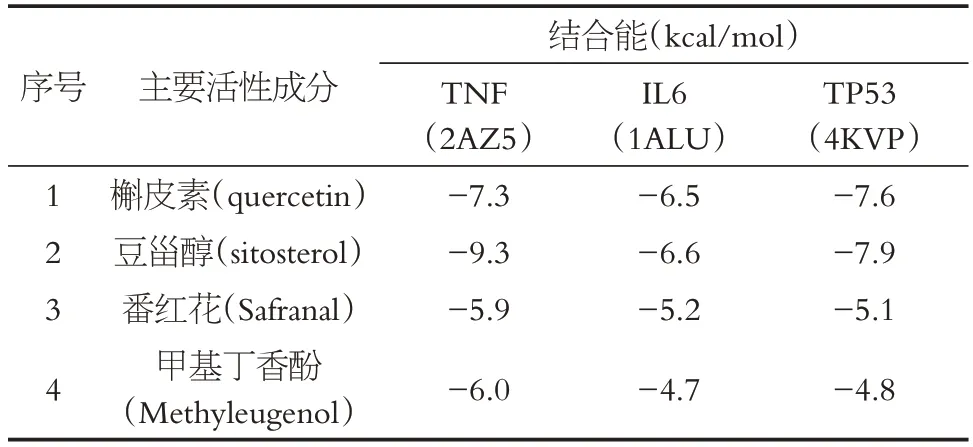
表4 分子對接結果Table 4 Molecular docking results
3 討論
帕金森病(Parkinson's disease)可歸屬于祖國醫學“顫證”“顫振”“振掉”“震顫”等范疇。病人常因“年老體衰、情志失調、飲食不節、勞逸過度”等病因導致氣血陰精虧虛,風火痰瘀互結,肝風內動,筋脈失養。病位在經脈,與肝、脾、腎關系密切。總屬本虛標實,以肝腎虧虛、風陽內動證最為常見,故治療尤以補益肝腎、息風通絡為主[4,17-18]。而桑寄生具有補肝腎、強筋骨功用,被廣泛應用于帕金森病的中醫治療中。
PD 以黑質多巴胺神經元變性壞死為主要病理變化,但具體機制尚不明確。除環境、遺傳、神經系統老化等因素外,更多認為PD 是在多因素交互作用下,通過氧化應激、線粒功能紊亂、神經炎性或免疫反應、鈣穩態失衡、興奮性毒性、細胞凋亡等機制導致黑質多巴胺能神經元大量變性、丟失,最終發病。而本文通過網絡藥理學研究,也證實了桑寄生主要通過影響炎癥反應、氧化應激、細胞凋亡等途徑發揮抗PD的作用。
經篩選,共獲取桑寄生4種抗PD的主要活性成分,包括槲皮素、豆甾醇、藏花醛及甲基丁香酚。機體活性氧(ROS)產生、清除速率失衡,導致線粒體功能障礙、氧化性DNA損傷、神經炎癥等一系列氧化應激反應[19],槲皮素具有調節細胞凋亡[20]、抗炎、抗氧化應激等多種生物作用[21],可通過活化抗氧化信號通路和抑制LRRK2 激酶活性,調節具有炎癥介質調控作用的MAPK信號轉導通路,降低LRRK2突變在PD轉基因模型果蠅的神經毒性,保護腦內多巴胺能神經元[22]。小膠質細胞作為大腦中重要的免疫細胞,其過度的激活或持續的炎性反應會產生神經毒性作用,導致神經元損傷、丟失,最終引起帕金森病、阿爾茨海默癥等神經退行性疾病。豆甾醇可通過抑制p38、ERK 和NF-κB通路的激活來減輕小膠質細胞炎癥反應,發揮神經保護作用,改善此類疾病[23-24]。除典型的運動癥狀外,嗅覺減退、抑郁、癡呆等感覺、精神認知障礙在帕金森病中也十分常見。豆甾醇可通過增強膽堿能神經傳遞系統介導的激活雌激素或NMDA受體改善由東莨菪堿導致的小鼠認知功能障礙[25]。藏花醛是一種單萜醛,主要存在于番紅花屬植物和半人馬屬植物中。研究表明,藏花醛可以通過促進帕金森病動物模型多巴胺能神經元分化和存活、抑制α-突觸核蛋白(α-synuclein,α-Syn)纖顫/聚集發揮抗帕金森病治療作用[15]。此外,藏花醛也可通過抗炎、抗凋亡、抗水腫等途徑發揮神經保護作用[16]。實驗表明,甲基丁香酚可以明顯提高大鼠腦組織中GSH、SOD、CAT的活性,降低MDA的含量,發揮抗氧化作用,保護神經元[26]。而除了抗氧化作用外,以丁香酚為主要成分的丁香揮發油在抗焦慮、抗抑郁、抗炎等方面也具有良好作用[27-30]。
靶蛋白的自由度與該靶點在疾病治療中的重要性呈正相關。腫瘤壞死因子(TNF)、白細胞介素-6(IL6)、腫瘤抑制因子(TP53)作為度值前三的靶蛋白,很可能是桑寄生抗帕金森病的關鍵靶點。為此,我們采取了分子對接技術進行了驗證。常說的TNF是指由巨噬細胞分泌的TNF-α,可參與經典和非經典Caspas 途徑、NF-KB和JNK信號通路等干預細胞凋亡過程。IL-6是由T 細胞、B 淋巴細胞、巨噬細胞等產生,可被IL-1、TNF 等細胞因子激活表達,參與機體免疫應答及炎性反應,是一種典型的炎性因子。IL-6 與其受體蛋白結合后激活的Janus 激酶(JAK),可以激活Ras/Raf 途徑、磷酸肌醇3 激酶(PI3K)-蛋白激酶的激活B(PKB)/Akt通路,通過作用于不同細胞產生促炎或抑炎反應。TP53 可作用于B 細胞淋巴瘤-2(Bcl-2)家族蛋白相或PI3K/Akt、MAPK 等信號通路,調控細胞增殖、細胞凋亡、炎癥反應等多種細胞效應及信號轉導[31-33]。正常情況下,TP53可上調線粒體谷氨酰胺酶2(GLS2),促進線粒體代謝、呼吸,維持氧化還原穩態。而高度表達的P53 會抑制下游蛋白增殖細胞核抗原(PCNA)的生成,致使DNA 氧化損傷、多巴胺能神經元變性凋亡[33-35]。眾多研究已表明,TNF-α、IL-6 及TP53 因子水平與PD密切相關,這可能與抗氧化應激功能下降(如TP53 上調)或α-突觸核蛋白激活小膠質細胞釋放大量TNFα、IL-6[36],導致機體黑質部位出現嚴重的氧化應激及炎癥反應,一方面促使線粒體膜電位改變,引起線粒體死亡。另一方面,也可激活促凋亡蛋白(Bax),抑制抗凋亡蛋白(BCL-2)[37],促使細胞凋亡,最終引起DA 能神經元損傷[38-41]。
富集分析結果顯示,桑寄生治療PD的KEGG 信號通路主要涉及HIF-1、MAPK、PI3K-Akt 以及IL-17 等信號通路,以及氧化應激、細胞增殖、細胞遷移、催化活性的負調控、小分子代謝過程的調控等生物過程。MAPK信號通路主要分為4個亞家族,包括細胞外信號調節激酶(ERK)、c-Jun N 末端激酶/應激活化蛋白激酶(JNK/SAPK)、p38絲裂原活化蛋白激酶(p38MAPK)及細胞外信號調節蛋白激酶5(ERK5)信號轉導通路。其中,細胞外信號調節激酶ERK 信號通路(Ras-Raf-MEK-ERK)被稱作經典的MAPK 信號通路,遵循MAPK 信號轉導通路的三級激酶級聯反應。Ras 蛋白作為該途徑的上游蛋白,被多種刺激因子激活后,可與Raf-1 結合并使其磷酸化、轉為活化狀態。而被Raf-1磷酸化激活的MEKs后,也可通過磷酸化反應激活ERKs。ERK主要存在于神經系統中,參與各種神經生理病理過程[42],具有調節細胞增殖與分化、細胞形態、細胞凋亡等功能,同時對學習、記憶等也有重要意義[43-46]。ERK 信號通路與PD 關系密切,有研究表明,PD 患者黑質中p-ERK 顆粒聚集數明顯高于正常老年組[42,47]。劉自華等通過對小鼠黑質部位進行轉錄組測序,發現PD 模型小鼠較正常組ERK、P38 基因表達下降,認為其細胞增殖、分化及形態維持等功能受到破壞,神經受損,最終導致PD 發生[48]。也有研究報道,ERK 信號通路參與PD 過程與炎性介質有關。炎性因子TNF-α可激活ERK 信號通路[49],電針在降低魚藤酮誘導的PD 模型大鼠中腦黑質內ERK 信號通路的表達水平的同時,也降低了TNF-α 的表達[42]。此外,PI3KAkt 信號通路在帕金森疾病中的作用也不容小覷。激活的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通過第二信使PIP3 活化胞內的蛋白激酶B(pro?tein kinase B,PKB/AKT),進而激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),促進細胞代謝,抑制細胞自噬[50]。研究表明,抑制mTOR 的激活可以增強自噬過程,清除α-突觸核蛋白,保護多巴胺能神經元,達到治療PD的作用[48]。
4 結論
桑寄生可以通過TNF、IL6、TP53、HMOX1、IL1B 等多靶點作用于MAPK、PI3K-Akt等信號通路,影響炎癥反應、氧化應激、細胞凋亡及增殖等生物過程,最終達到治療PD的作用,體現了桑寄生多成分、多靶點、多通路的作用特點。
(利益沖突:無)

