瀘州地區狗牙根總黃酮的提取工藝優化
馮躍平,李建,呂虹林,張春
西南醫科大學1.中西醫結合學院;2.藥學院(瀘州 646000)
狗牙根為禾本科植物狗牙根Cynodon dactylon(L.)Pers.的全草,首載于《滇南本草》。其味苦、微甘,性涼,歸肝經。具有祛風活絡、涼血止血的功效[1],主治風濕痹痛、半身不遂、鼻衄、便血、瘡瘍腫毒等病癥[2-4]。現代研究表明狗牙根具有抗菌、利尿、降血糖等藥理作用[5]。目前,對狗牙根的研究主要集中在生物學特征、園林應用、病蟲害等[6-8]方面。關于狗牙根化學成分研究發現,其含有黃酮類、木脂素等化學成分[9-11]。黃酮作為廣大中草藥中的一類主要有效成分,廣泛分布于自然界的多種植物中。近年來大量的的科學研究表明,黃酮類化合物是一種很強的抗氧劑,它能與體內的氧自由基反應,從而有效減少人體內的氧自由基[12-13]。這種抗氧化作用可以緩解細胞的氧化、衰老,甚至可以阻止癌癥的發生[14-21]。已有相關文獻證明了狗牙根中含有黃酮類化合物[22],而關于狗牙根中總黃酮提取工藝及其含量測定未見報道。因此,本研究通過對各種植物總黃酮的提取工藝的總結歸納[23],采用乙醇回流提取方法,通過單因素考察實驗結合正交實驗[24],設計篩選出狗牙根總黃酮的提取工藝參數,并對其含量進行測定。該研究,為進一步揭示狗牙根的藥效有效成分,探索藥理活性提供前期試驗依據;為狗牙根質量標準制定奠定基礎;在進一步提高狗牙根資源的利用率,擴大藥用范圍上具有重要臨床意義。
1 儀器和材料
1.1 實驗儀器
本實驗所用主要儀器與設備詳見表1。
表1 實驗儀器及設備表Table 1 List of experimental instruments and equipments
1.2 實驗材料與試劑
本實驗所用材料采自四川省瀘州市合江縣,經西南醫科大學生藥學教研室鑒定為狗牙根Cynodon dac?tylon(L.)Pers.的全草;蘆丁對照品,購自成都普思生物科技股份有限公司,批號:153-18-4,經面積歸一化法測定含量為99.8%。水為超純水,其余試劑為分析純。
2 方法
2.1 分光光度法的建立
2.1.1 樣品溶液的制備 將清洗干凈狗牙根全草置于60℃減壓干燥箱中烘干。粉碎、過40目篩,密封保存,備用。精密稱取狗牙根粉末約1 g,至100 mL的圓底燒瓶,80%乙醇作為浸提液,收集濾液至50 mL容量瓶,加80%乙醇定容。
2.1.2 檢測波長的選擇 取“2.1.1”項的樣品溶液,通過乙醇溶液稀釋至適宜濃度后作為供試液,使用紫外分光光度儀,以乙醇為空白液,在200~800 nm波長之間進行全波長掃描。結果表明狗牙根總黃酮在510 nm處有最大吸收,與對照品蘆丁溶液的最大吸收峰一致,故選擇蘆丁作為對照品。
2.1.3 對照品溶液的制備 精密稱取蘆丁對照品粉末10.00 mg,放置于50 mL 容量瓶中,加入適量80%體積分數的乙醇溶液溶解,定容至刻度線,振搖均勻,即配制成0.20 mg·mL-1的對照品溶液,冰箱4℃儲存備用。
2.1.4 標準曲線的繪制 精密量取“2.1.1”項下的蘆丁對照品溶液0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL,分別于10 mL 刻度試管中,向各個試管中準確滴加0.4 mL質量分數為5%的NaNO2溶液,充分振蕩搖勻,靜置6 min后,向試管中精密加入0.4 mL 質量分數為10%的Al(NO3)3溶液,充分振蕩搖勻,靜置6 min 后加入體積為4 mL 質量分數為4%的NaOH 溶液,最后加蒸餾水至10 mL刻度線,充分振蕩搖勻,靜置15 min,為對照品供試溶液[25]。本實驗選用80%體積分數的乙醇溶液依法操作,作為空白溶液,分別在紫外分光光度計下測定吸光度,記錄波長為510 nm 的吸光度值[26]。以蘆丁標準品溶液質量濃度作橫坐標(X),吸光度值作縱坐標(Y),做回歸處理,得標準曲線為Y=0.0114X+0.0001(R2=0.9992)。由圖1結果顯示,蘆丁對照品溶液質量濃度在8.0614~32.3596 μg·mL-1范圍內與吸光度呈現良好的線性關系。
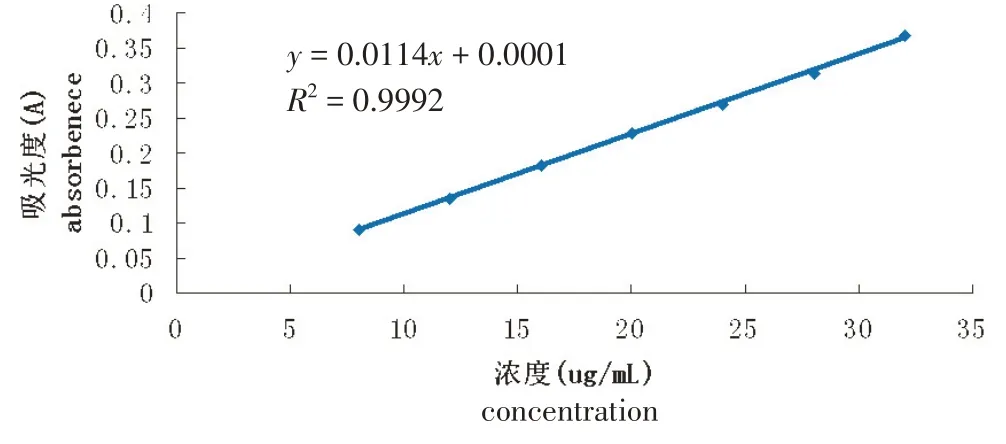
圖1 蘆丁標準曲線圖Figure 1 Standard curve of rutin
2.1.5 精密度實驗 準確量取蘆丁對照品溶液,分別按照“2.1.2”項下顯色操作后測定吸光度值,連續測定6次并計算相對標準偏差。由表2 結果可知,RSD%為1.97%(n=6),相對偏差較小,表明儀器精密度良好。

表2 精密度實驗結果Table 2 Results of precision test
2.1.6 重復性試驗 取2.1.1 項下樣品溶液6份,按照2.1.4 項下顯色法進行顯色,80%乙醇溶液同法操作為空白,在紫外可見分光光度計中測定樣品溶液的吸光度值。記錄510 nm 處的吸光度值,標準曲線法計算總黃酮含量,計算6次平行實驗的RSD%。實驗結果見表3。由表3可知,RSD%為2.23%(n=6),相對偏差較小,說明該方法重復性好。

表3 重復性實驗結果Table 3 Results of repeatability test
2.1.7 穩定性試驗 取2.1.1 項下樣品溶液6份,按照“2.1.4”項下進行顯色,80%乙醇溶液同法操作為空白,分別在0、15、30、45、60、90 min后,在紫外可見分光光度計中測定樣品溶液的吸光度,并記錄510 nm 處的吸光度值。計算樣品中的總黃酮含量,并計算RSD%。實驗結果見表4。由表4可知,RSD%為2.47%(n=6),相對偏差較小,表明該方法穩定可行。
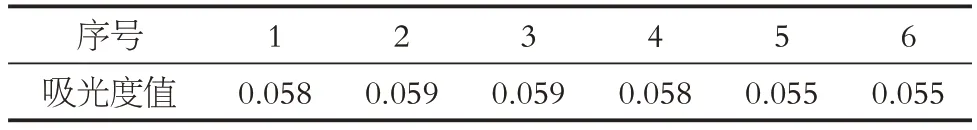
表4 穩定性實驗結果Table 4 Results of stability test
2.2 提取方法的選定
2.2.1 狗牙根處理 狗牙根全草鮮品清洗干凈,放在60℃減壓干燥箱中烘干。趁熱用多功能粉碎機粉碎,防止吸潮。粉碎后過40目篩,密封保存,備用。
2.2.2 樣品溶液的制備方法 準確稱取狗牙根粉末1.00 g,放入100 mL 的圓底燒瓶中,根據所控制的條件不同,用相應體積分數的乙醇作為浸提溶液,采用相應的提取方法,浸提一段時間后,趁熱過濾,收集濾液,濾液轉移至50 mL 容量瓶內,向容量瓶中加入95%體積分數的乙醇溶液定容至容量瓶刻度線,即得樣品溶液。
2.2.3 不同提取方法的考察 參照藍莓葉的總黃酮最佳提取工藝條件[26],準確稱取狗牙根粉末1.00 g,用95%的乙醇,料液比1∶20 g·mL-1為提取條件,用不同的提取方法(回流、冷浸、超聲),提取0.5 h。超聲和回流提取溫度為80℃,冷浸法為室溫,提取一次。提取后立即過濾,將濾液轉移至50 mL容量瓶中,用95%乙醇溶液定容至刻度。取1.2 mL 樣品溶液到10 mL 刻度試管中,按照“2.1.2”項下進行顯色操作,用95%乙醇同法操作作為空白,在紫外可見分光光度計中測定不同方法提取的狗牙根樣品溶液的吸光度。記錄510 nm波長處的吸光度值A。根據所測得的吸光度值,標準曲線法計算總黃酮含量。實驗結果見表5。結果表明,三種提取方法對狗牙根總黃酮的提取效率依次為回流法>超聲法>冷浸法。回流法吸光度最大,提取狗牙根黃酮效果最好,故本研究最終采用回流提取法。
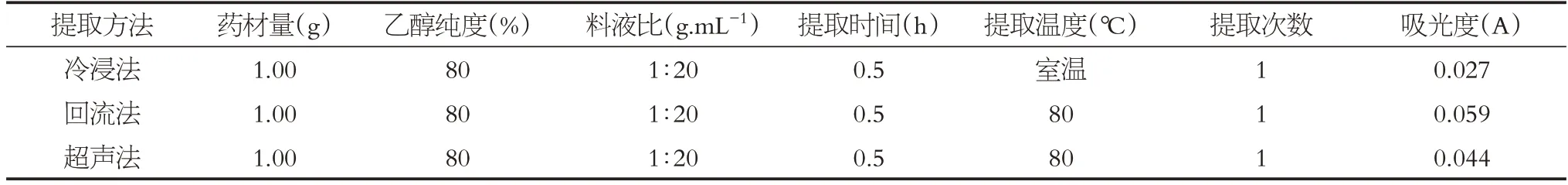
表5 不同提取方法對狗牙根總黃酮含量的影響結果Table 5 Effects of different extraction methods on the total flavonoids content of Cynodon dactylon
3 結果
3.1 狗牙根總黃酮提取的單因素實驗考察
準確稱取藥材粉末若干份(1.00 g/份),95%體積分數的乙醇溶液作為溶劑、1∶20 g·mL-1作為料液比、80℃作為提取溫度、0.5 h 作為提取時間,提取一次作為提取次數,以上均作為基本條件。每次實驗就提取時間、提取溫度、乙醇體積分數、料液比中的一個因素作為變量,控制其他的基本條件不變,做單因素考察實驗。每次提取后立即過濾,收集濾液,即為樣品溶液,按照“2.1.2”項下方法測定吸光度,標準曲線法計算狗牙根樣品中的總黃酮含量(每組重復3次計算平均值)。單因素試驗考查結果為:乙醇體積分數對狗牙根總黃酮提取的影響見圖2。總體來說,乙醇體積分數與狗牙根總黃酮含量呈正相關,即狗牙根總黃酮含量隨乙醇體積分數的增加而增加。在本研究所考察的乙醇體積分數在40%~80%中,當乙醇的體積分數為80%時,狗牙根總黃酮含量有最大值,最大值為3.90 mg·g-1,由于考慮到極性過低,對極性較大的黃酮類物質提取易產生沉淀,因此選擇乙醇提取濃度為80%,正交試驗乙醇因素選擇的三個水平分別為60%、70%、80%。

圖2 乙醇體積分數對黃酮提取的影響Figure 2 Effects of ethanol concentration on the yield of total flavonoids
料液比對狗牙根總黃酮提取的影響:狗牙根總黃酮的含量隨提取溶劑用量的增加呈現先稍微降低,后升高的規律(見圖3)。在本研究所選取的1∶20 g·ml-1、1∶30 g·mL-1、1∶40 g·mL-1、1∶50 g·mL-1、1∶60 g·mL-1五組料液比中,當料液比為1∶60 g·mL-1時,實驗提取的狗牙根總黃酮含量有最大值,最大值為8.63 mg·g-1。因此本研究中正交試驗料液比因素選擇的三個水平分別為1∶40 g·mg-1、1∶50 g·mg-1和1∶60 g·mL-1。
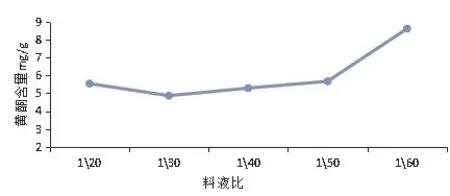
圖3 料液比對黃酮提取的影響Figure 3 Effects of solid-liquid ratio on the yield of total flavonoids
提取溫度對狗牙根總黃酮提取的影響:當提取溫度在60℃到90℃時,狗牙根總黃酮含量會隨著提取溫度的增加而呈上升趨勢(見圖4),說明在此過程中,隨著溫度的升高破壞了細胞壁,有利于狗牙根的浸出。當提取溫度90~100℃時,提取所得到的狗牙根總黃酮的含量反而呈下降趨勢,有可能與溫度過高導致部分黃酮的活性與結構改變,破壞了部分黃酮有關;當提取溫度為90℃時,狗牙根總黃酮含量有最大值,最大值為5.61 mg.g-1,因此本研究中正交試驗提取溫度因素選擇的三個水平分別為80℃、90℃和100℃。
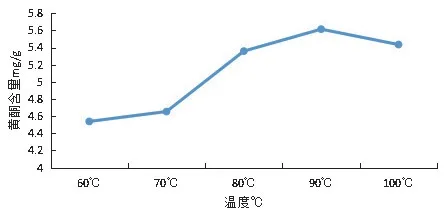
圖4 溫度對黃酮提取的影響Figure 4 Effects of extraction temperature on the yield of total flavonoids
提取時間對狗牙根總黃酮提取的影響:當提取時間在0.5 到1.5 h時,狗牙根總黃酮含量會隨著提取時間的增加而下降(見圖5),當時間在1.5~2.5 h時,狗牙根總黃酮含量呈上升趨勢;但是當提取時間為0.5 h 和2.5 h時,狗牙根總黃酮含量均有最大值5.56 mg.g-1。本研究正交試驗提取時間因素選擇的三個水平分別為0.5 h、1 h和1.5 h。
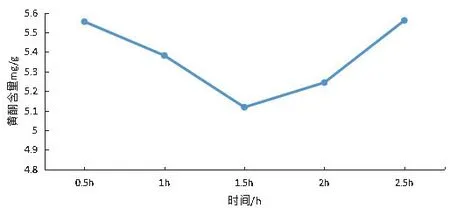
圖5 時間對黃酮提取的影響Figure5 Effects of extraction time on the yield of total flavonoids
3.2 狗牙根總黃酮提取工藝的正交實驗
根據單因素考察結果,選取4因素三水平,進行正交試驗(見表6),篩選狗牙根總黃酮的最佳提取工藝,考察提取時間、料液比、乙醇體積分數以及提取溫度4個因素對狗牙根總黃酮提取的影響。最終以提取所得的狗牙根總黃酮含量為評價指標,以正交實驗結果為依據,采用極差分析,來確定狗牙根總黃酮的最佳提取工藝條件。
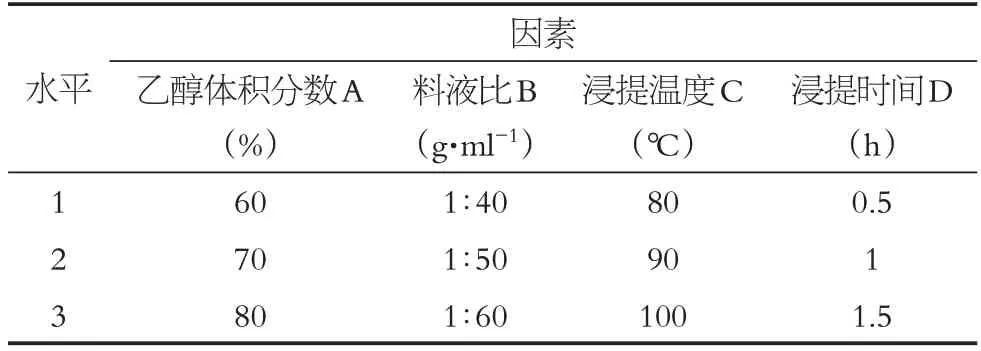
表6 正交實驗因素與水平表Table 6 Factors and levels of orthogonal experiment
根據四因素三水平正交實驗結果可知(見表7),乙醇體積分數A、料液比B、提取溫度C 和提取時間D 四個因素的極差分別為0.36、0.58、0.20 和0.46。由此可知,對回流法提取狗牙根總黃酮提取效果的影響因素的影響大小依次為B>D>A>C,即料液比為該提取的最主要影響因素,其次為浸提時間,第三個影響因素為乙醇體積分數,最后為浸提溫度。本研究得出的狗牙根總黃酮的最佳提取工藝為A3B3C3D3,即80%體積分數的乙醇,1∶60 的料液比,浸提溫度為100 ℃,浸提時間1.5 h。
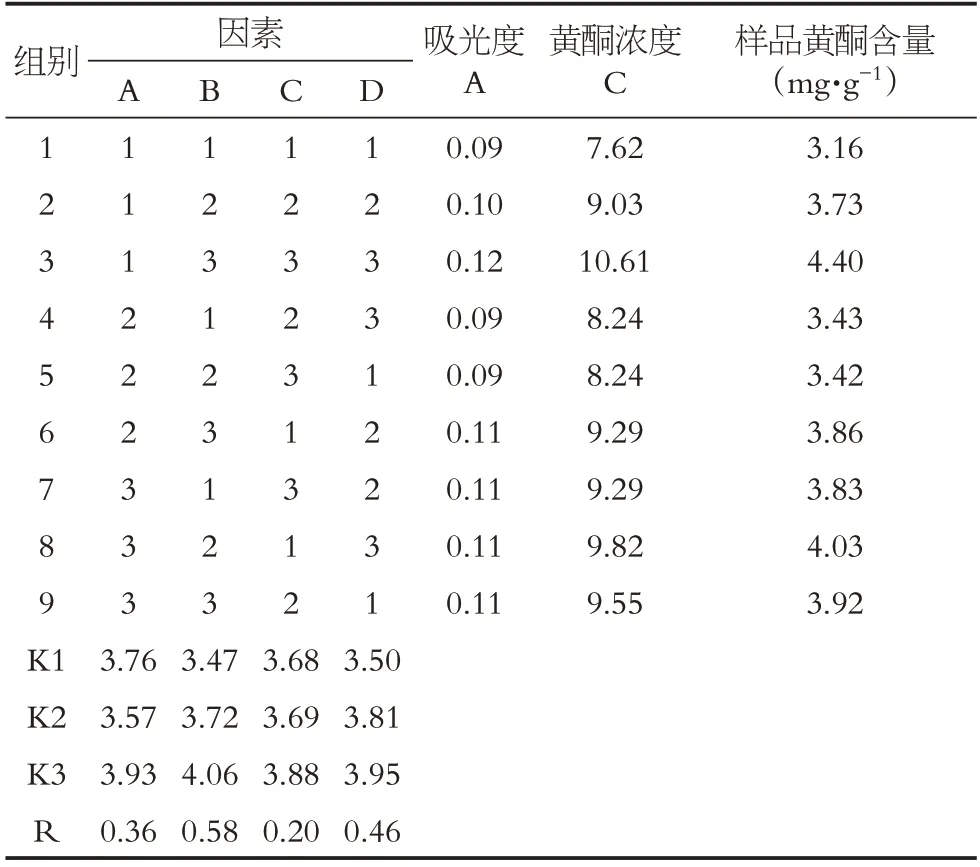
表7 正交設計試驗結果(n=9)Table 7 Results of orthogonal design test(n=9)
3.3 驗證性實驗
為檢驗優選工藝的可靠性及穩定性,精密稱取狗牙根藥材全草粉末1.00 g,按正交實驗篩選的最佳提取工藝條件進行驗證性實驗,重復6 次取平均值。取驗證性實驗所得的樣品溶液1.2 mL 于10 mL 刻度試管中,按照“2.1.2”項下方法,測定吸光度值并計算總黃酮含量。
按編號(1-6)驗證性實驗結果見表8,驗證性實驗所提取的狗牙根平均總黃酮含量為4.78 mg·g-1,高于正交組合A1B3C3D3的總黃酮含量(4.40 mg·g-1);計算得出RSD%為2.18%,表示該提取方法合理且穩定可行,適用于狗牙根總黃酮的提取。
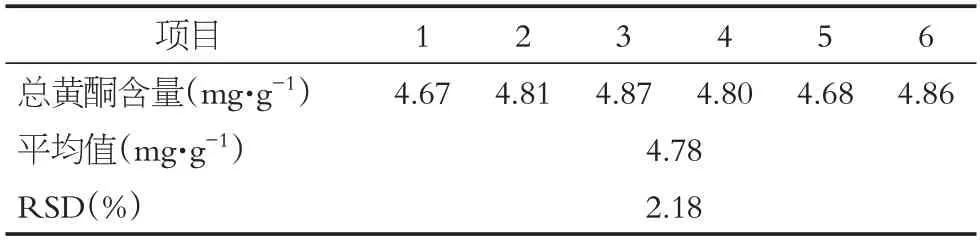
表8 驗證性實驗結果Table 8 Results of verification test
4 討論
在瀘州市合江縣的狗牙根總黃酮的提取中,料液比對其影響最大,浸提溫度影響最小。通過單因素實驗和正交試驗結果,可以得出狗牙根總黃酮的最佳提取方法為回流提取法,提取工藝為在80%體積分數的乙醇中,以1∶60 的料液比,在100℃下回流提取1.5 h,本實驗中在最佳提取工藝條件下提得的總黃酮含量最高為4.87 mg·g-1。本研究首次對狗牙根總黃酮含量和其提取工藝進行研究,為狗牙根質量標準研究提供了科學依據。
本研究采用回流提取法,用蘆丁做標準品,采用NaNO2-Al(NO3)3-NaOH 顯色法,顯色后通過紫外可見分光光度計測定吸光度,以標準曲線法計算樣品中的總黃酮含量。然后再依據黃酮含量作為指標,用單因素考察以及正交試驗來篩選最佳提取工藝條件,方法簡便可行,得到的工藝穩定可靠。但是在本次研究中只是對料液比,乙醇濃度,浸提時間和浸提溫度等四個因素做了初步考察,尚未全面涵蓋可能影響狗牙根總黃酮提取的其他因素。例如,采收時間、采收地點、粉碎度、提取溶劑以及提取次數等。今后還需對這些因素進行綜合分析和深入研究。狗牙根作為來源廣泛的民間草藥,明確其藥效物質基礎,方能保證其臨床用藥的安全性、有效性。因此,今后還需對狗牙根中黃酮類化學成分進行分離、純化,明確其藥效有效成分,為其作為新藥源的開發奠定基礎。
5 結論
本實驗所得出的狗牙根總黃酮的最佳提取工藝穩定可行,可用于狗牙根總黃酮的提取,為該藥材質量標準研究提供了科學依據。
(利益沖突:無)

