植物SWEET基因家族促進病害發生的研究進展
沈 川, 李 夏
(1.安康學院陜南生態經濟研究中心,陜西安康725000;2.安康市農業科學研究院,陜西安康725000)
關鍵字: SWEET;糖轉運蛋白;植物-微生物互作;基因工程;生物脅迫
植物在整個生命周期中,會暴露在影響其發育和功能的環境脅迫中。它們還必須應對一系列的微生物,這些微生物極有可能具有致病性。全球每年由于細菌、真菌、卵菌和病毒病原菌引起的作物病害造成的損失高達數十億美元[1]。在與病原菌的相互作用中,植物感知微生物信號或相關的分子(如碳水化合物、脂類、肽、蛋白質),并根據涉及的特定模式識別受體制定應對策略[2]。因此,植物在適應極端環境過程中已經進化出復雜而協調的分子和代謝網絡,包括基因、代謝物和適應反應,它們調節生長、光合作用、滲透壓和碳水化合物的平衡。在特定的壓力條件下,糖類在壓力感知、信號傳遞中起著關鍵作用,是壓力介導的基因表達調節中心,確保滲透調節的反應,清除活性氧(ROS),并通過碳分配維持細胞的能量狀態[3]。
SWEET(Sugar will eventually be exported transporter)是一類新型的糖類轉運蛋白,其功能為促進糖類沿濃度梯度跨細胞膜擴散,在古細菌、植物、某些真菌和動物中存在同源轉運蛋白[4]。SWEET廣泛存在于植物中,并在許多生理生化過程中發揮核心作用,包括長距離運輸糖的韌皮部裝載、花粉營養、花蜜分泌、種子填充、果實發育、植物與病原菌的相互作用以及對非生物脅迫的反應[5]。有趣的是,SWEET轉運體是細胞外病原菌的目標,病原菌改變其表達以獲得生長所需的糖[6]。內源性糖在介導植物免疫應答和對抗病原菌攻擊中的作用越來越受到關注,因此出現了“甜味免疫”或“糖增強防御”的概念[7-8]。針對這些層次的調控將對作物改良有重要意義。
1 植物中SWEET基因家族的分布和結構特征
SWEET基因家族在植物物種中分布廣泛,從2010年擬南芥第一個SWEET基因家族被鑒定出來[6],截至目前已經超過50多種植物中SWEET基因家族被鑒定出來。比如,在擬南芥中有 17 個成員,在水稻中有 21 個成員,在葡萄中有 17 個成員,在模式豆科植物蒺藜苜蓿中有 24 個成員[6,9-11]。事實上,在大多數已測序的植物基因組中已經鑒定出SWEET基因,表1為一些植物SWEET基因家族的分布信息(表1)。
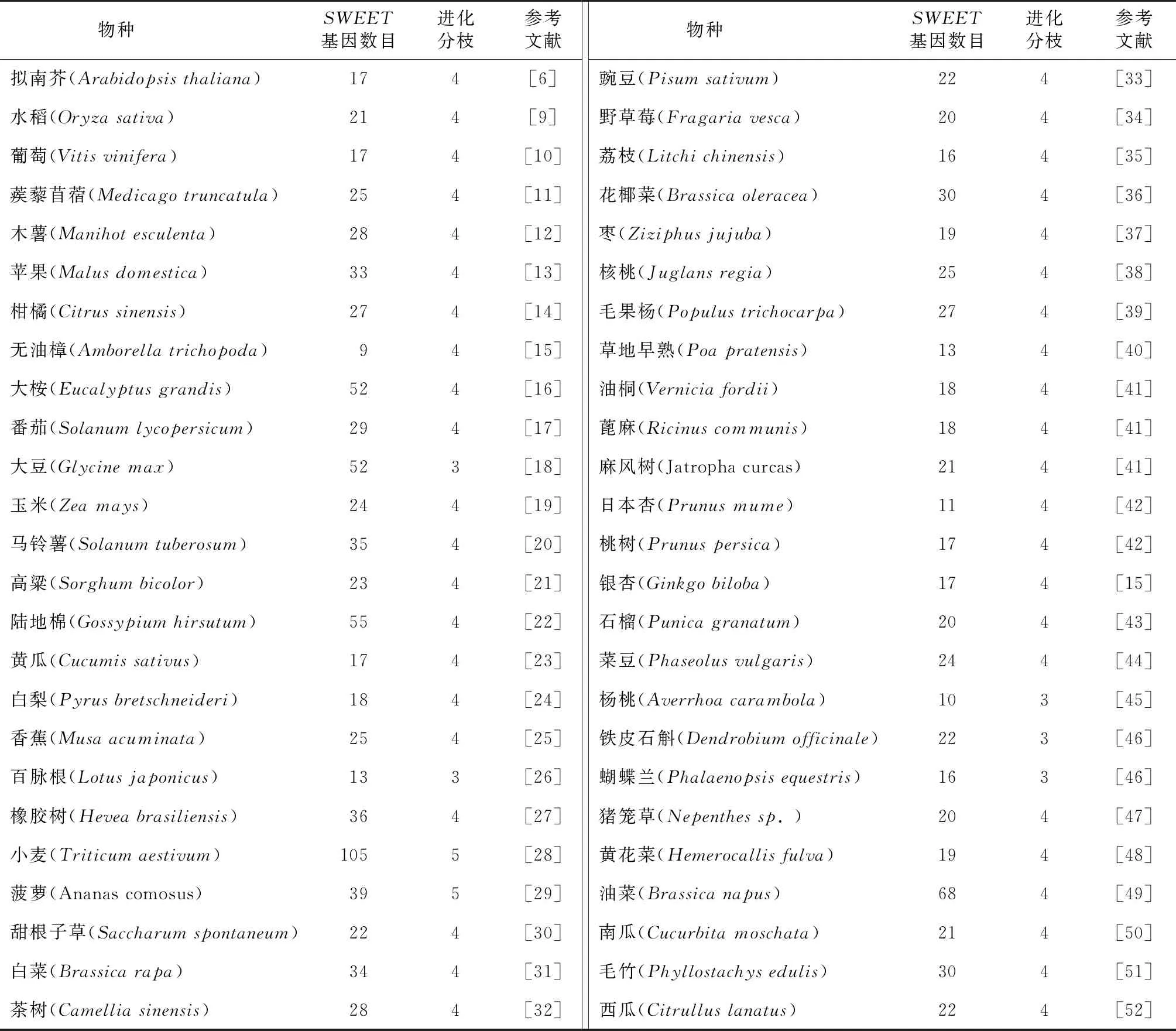
表1 SWEET基因家族在植物中的分布
通過對SWEET蛋白的跨膜結構進行分析發現,真核生物SWEET具有多達7個跨膜螺旋(TMHs)結構域,這些結構域被組織為2個3-TM結構域(包含2個保守的 MtN3/Saliva 基序)的串聯重復,由單個TM分隔[4]。而在原核生物中,該結構域被稱為SemiSWEET,且只有一個3-TM,但仍然能夠運輸糖[4]。這一結構特征賦予其能夠選擇性地轉運不同種類的糖底物,包括蔗糖、果糖和葡萄糖[9]。
對5種植物(擬南芥、水稻、玉米、葡萄、番茄)中SWEET基因家族的系統發育分析結果表明,植物SWEET可分為4個亞群(進化分枝Ⅰ-Ⅳ)(圖 1)。進化分枝Ⅰ、Ⅱ和Ⅳ中的SWEET主要用作單糖外排轉運蛋白,轉運葡萄糖、半乳糖或果糖,而進化分枝Ⅲ成員優先轉運二糖蔗糖[16]。此外,除進化分枝Ⅳ成員外,所有SWEET都定位于質膜。與其他進化分枝相比,進化分枝Ⅳ含有相對較少數量的SWEET基因,且進化分枝Ⅳ中的SWEET定位于液泡膜,并且已被證明主要由控制果糖通過液泡膜的轉運蛋白組成[4-6]。

圖1 5個植物物種SWEET基因家族系統發育樹分析
擬南芥17個SWEET家族成員的4個系統發育進化分枝已經被廣泛研究,其中 AtSWEET1~AtSWEET3在進化枝Ⅰ中,AtSWEET4~AtSWEET8在進化枝Ⅱ中,AtSWEET9~AtSWEET15在進化枝Ⅲ中,AtSWEET16~AtSWEET17在進化枝Ⅳ中[16]。大多數其他植物的SWEET都是按照擬南芥采用的命名法命名[6]。SWEET基因在植物中的功能廣泛。例如,AtSWEET1充當葡萄糖轉運蛋白[3],而AtSWEET9是蜜腺特異性糖轉運蛋白,對花蜜生產至關重要[53]。AtSWEET11和AtSWEET12催化蔗糖從源葉中韌皮部薄壁細胞流出,并在韌皮部負載中發揮關鍵作用[54]。AtSWEET16和AtSWEET17作為液泡SWEET蛋白,起到果糖特異性輸出蛋白的作用,將液泡腔連接到胞質溶膠[55]。在水稻中,位于質膜上并在葉片韌皮部表達的OsSWEET11與韌皮部負載有關,功能與其擬南芥同源物AtSWEET11和AtSWEET12一樣[56]。OsSWEET14敲除突變體導致種子不飽滿,生長遲緩,表明OsSWEET14在籽粒灌漿中起作用[57]。同時,OsSWEET1a、OsSWEET2a、OsSWEET3a、OsSWEET4、OsSWEET5和OsSWEET15在植株花和穗中均有高表達,表明這些轉運蛋白在水稻生殖發育中也發揮了一定的作用[58]。此外,SWEETs還參與離子轉運、葉片衰老、植物-病原菌互作和非生物脅迫等過程,比如細菌效應子與OsSWEET11和OsSWEET14的啟動子直接結合[59]。
2 SWEET參與細菌的致病過程
病原菌主要通過感染植物細胞來獲取營養物質,特別是糖類,以促進自身的生長和繁殖,而這往往要以犧牲植物正常生長為代價。比如,引起水稻細菌性白葉枯病的黃單胞菌屬利用植物SWEET運輸器獲取寄主的糖分儲備[6,60]。這些細菌利用它們的Ⅲ型分泌系統分泌一系列效應蛋白,包括轉錄激活樣效應子(TALEs)進入寄主細胞,直接針對特定SWEET基因的表達進行調控(圖2)[10]。
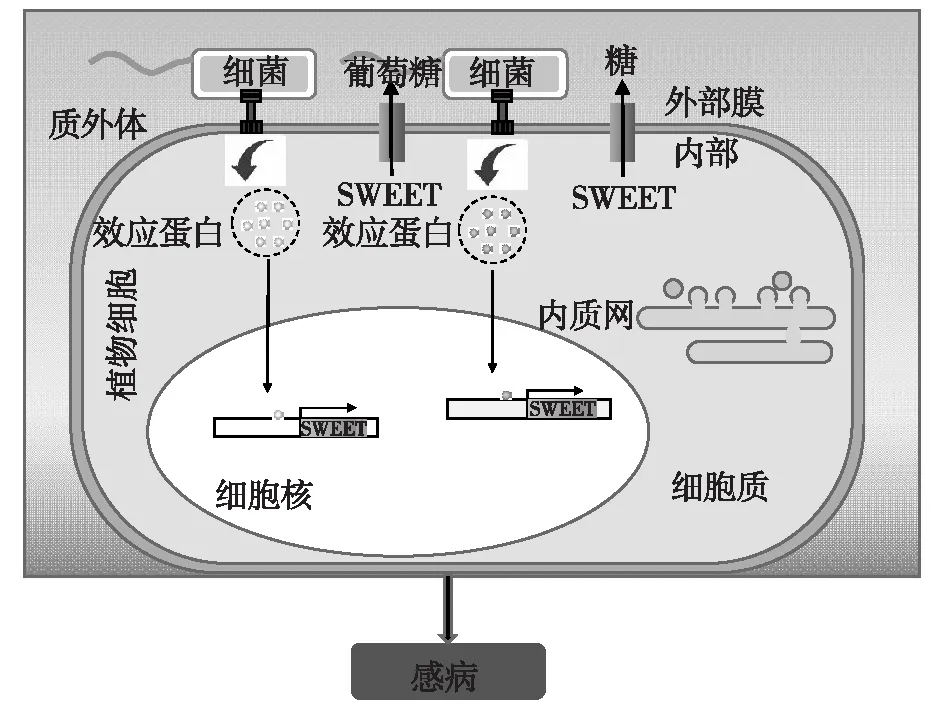
圖2 植物SWEET糖轉運蛋白在微生物營養中作用的簡化模型
目前,此類研究主要集中于水稻上,作為引起細菌性葉枯病的一個關鍵侵染策略,黃單胞菌(Xoo)向植物細胞注入TALEs的DNA結合蛋白,這些蛋白質以序列特異性方式與效應物結合元件(EBEs)結合,誘導寄主基因的表達(表2)。比如,來自第3進化分枝的5個SWEET基因是黃單胞菌轉錄激活效應子的靶標[61]。在這5個基因中,OsSWEET11和OsSWEET13分別被TAL效應子PthXo1和PthXo2誘導,而OsSWEET14基因被AvrXa7、PthXo3、TalC和Tal5當作侵染的關鍵目標,在水稻-Xoo相互作用過程中作為主要的易感因子,這3個基因編碼蔗糖從細胞膜到質外體空間的外流[62-63]。利用設計的異位誘導OsSWEET11b使無TAL的Xoo致病,發現OsSWEET11b是潛在的易感基因,并證明誘導寄主蔗糖活性是Xoo致病的關鍵[64]。此外,這些細菌病原菌還針對其他植物物種中的 SWEET 轉運蛋白,比如在木薯中,易感基因MeSWEET10a被來自細菌性枯萎病菌的TAL效應器(TAL20Xam668)特異性誘導[60]。在柑橘中,病原菌黃單胞菌導致柑橘細菌性潰瘍病,此病原菌也是以TAL效應子依賴性的方式誘導CsSWEET1的表達[65]。在棉花中,SWEET同源的隱性基因b6參與了棉花品系Acala-44對棉花角斑病菌的抗性反應[66]。

表2 被細菌白葉枯病菌靶向的來自進化分枝Ⅲ的SWEET轉運蛋白
被黃單胞菌劫持的SWEET轉運蛋白的活性對病原菌的生長和增殖至關重要,攜帶截斷版TAL效應子的細菌突變株,甚至在TAL效應子結合的啟動子區域發生突變,均會導致細菌含量降低,植物產生抗性[6,67]。TAL效應子一般與效應子TATAA元件結合,因此可以利用基因組編輯對這些區域進行修飾,改變植物-病原菌互作反應,使寄主植物產生從感病性到抗性的轉變[68]。隱性抗性基因xa13和xa25分別是SWEET11和SWEET14的突變形式,在抵抗Xoo侵染中發揮積極作用[69]。同一個SWEET成員可以被不同的病原菌菌株特異性效應子作為目標,因為它們可以與同一個啟動子的不同區域結合。因此,SWEET基因啟動子區域的隱性突變可以增加植物的抗性而不失去糖的運輸功能使用[57]。OLIVA等[70]、XU等[71]使用CRISPR/Cas9基因編輯手段對水稻品種IR64和Ciherang-Sub1的SWEET11、SWEET13和SWEET14基因啟動子的EBEs進行了多重編輯。同樣,利用CRISPR/Cas9敲除水稻OsSWEET11基因后,純合突變體對Xoo的抗性顯著增強[72]。對編輯過的品系產量性狀分析發現,啟動子編輯過的植株與其野生型親本之間沒有明顯的差異,但SWEET編輯過的水稻品系對Xoo的抗性有所增強[70-72]。
3 SWEET參與真菌和卵菌的致病過程
一些研究結果表明,在感染真菌和卵菌后,寄主體內糖的運輸和分配受到影響,寄主細胞成為滿足病原菌生長和感染營養需求的一個養料儲存庫(表3)。除SWEET進化分枝Ⅲ外,來自其他支系的AtSWEETs的表達可以被Pseudomonassyringaepv. tomato strain DC3000、Golovinomycescichoracearum或Botrytiscinerea誘導。在植物與真菌的相互作用過程中,寄主細胞的糖外流和轉化酶活性的增強也會導致蔗糖和己糖積聚到葉綠體中,被真菌的糖運輸器吸收。立枯絲核菌感染顯著增強了OsSWEET11的表達,突變體對水稻紋枯病的敏感性降低,而過表達OsSWEET11對病菌的敏感性升高,表明可能通過激活OsSWEET11的表達從水稻葉片中獲取糖分[59]。成功的營養性病原菌可以將寄主的營養轉移到感染部位,比如,十字花科根腫病菌感染擬南芥導致糖在韌皮部的特異性積累,糖轉運蛋白SWEET11和SWEET12促使糖向病原菌感染的部位分布[73]。GhSWEET42通過葡萄糖轉運在大麗輪枝菌感染中起著關鍵作用,通過操縱GhSWEET42的表達以控制感染部位的葡萄糖含量是抑制大麗輪枝菌感染的有效方法[74]。
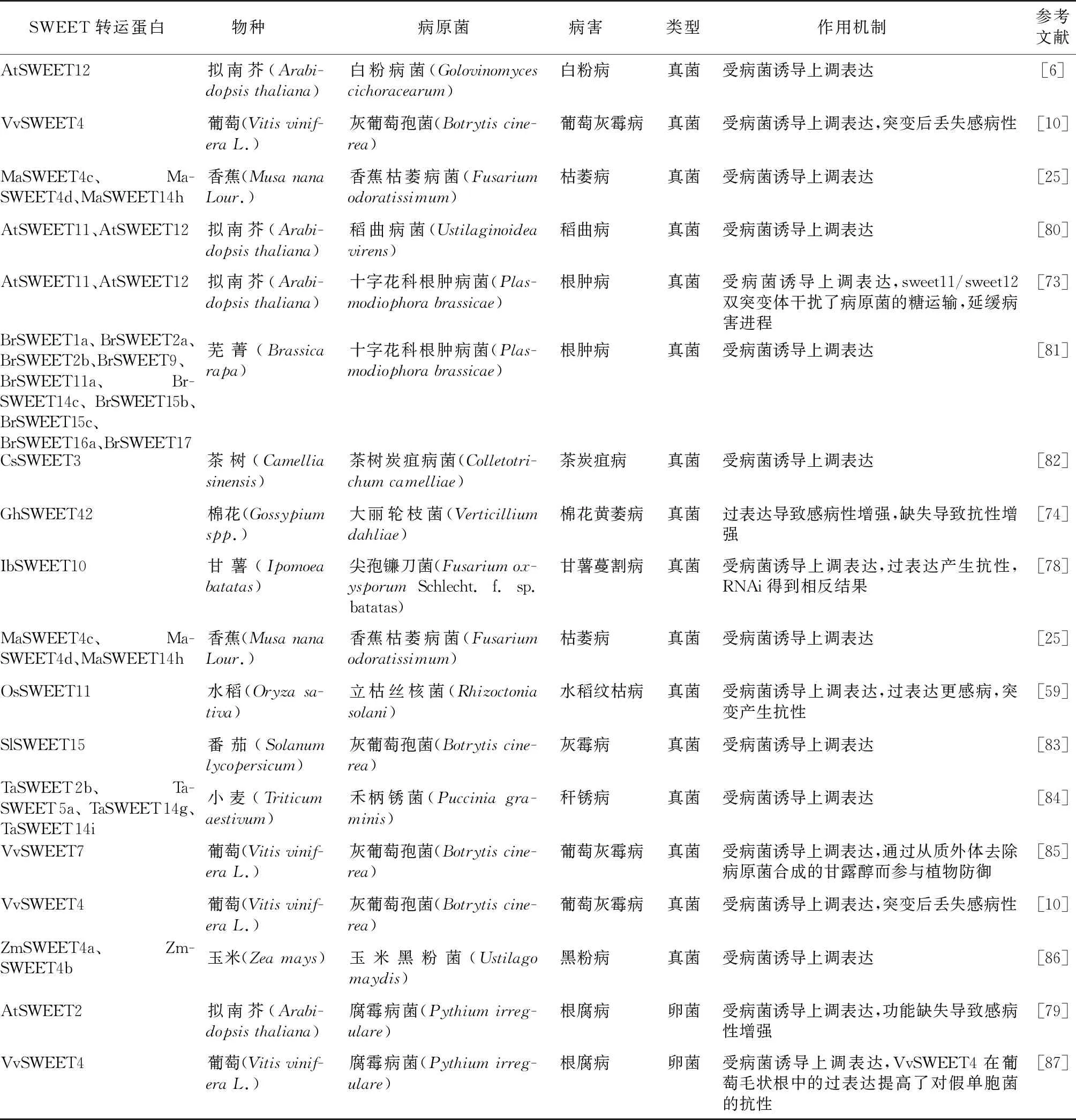
表3 植物中被真菌/病毒靶向的SWEET轉運蛋白
沉默IbSWEET10基因,導致甘薯對尖孢鐮刀菌的感病性增加,而過表達增強了抗性,這與水稻和棉花中的發現相反。進一步研究發現,甘薯中IbSWEET10的表達下調可能通過減少果膠和纖維素的沉積而損害維管組織的細胞壁完整性,導致對尖孢鐮刀菌的抵抗力下降,RNAi植株在感染后表現出被破壞的髓部結構[78]。在擬南芥的根部,盡管土傳卵菌腐霉病菌的感染導致AtSWEET2基因表達量增加了10倍以上,但功能缺失的SWEET2突變體更容易受到感染,當遭遇卵菌侵染時顯示生長受損,這表明AtSWEET2轉運體將糖從細胞膜轉運到液泡,以限制它們滲漏到細胞外空間,可能為病原菌提供食物[79]。因此,可以認為在病原菌攻擊時,各種糖信號級聯被破壞以減少植物的防御反應,從而為病原菌的生長提供更有利的環境。
SWEET是病原菌操縱的理想目標,它們的表達在感染期間可能會被轉錄重編。玉米黑粉菌對玉米的糖分生理和產量產生強烈的負面影響,將糖分從發育中的果穗轉移到與真菌有關的富含糖分的器官,研究結果表明黑粉菌誘導了SWEET的局部上調表達,然后SWEET轉運蛋白被招募,在生物營養層面將糖分滲入細胞質[85]。來自葡萄的葡萄糖轉運體VvSWEET4參與了與灰霉病菌的相互作用,其在受到ROS和大面積細胞死亡的刺激后會過度表達,同源的AtSWEET4突變體對灰霉病菌的敏感性較低,表明其能夠促進葡萄糖流出到細胞壁空間以增強病菌生長[87]。
4 展望
糖的運輸和分布在調節植物生長和發育以及應對生物和非生物脅迫方面起著重要作用[88-89]。因此,研究糖類運輸體在植物生長的各個階段如何運輸和重新分配糖類是特別必要的。在過去的10年中,SWEET蛋白的研究取得了許多重要進展,但仍有許多問題沒有得到解決。比如大多數植物含有SWEET基因家族的多個成員,這些基因如何協同工作,如何被調控,是否在轉錄或翻譯水平上被調控,以及如何實現功能的多樣化,仍然不清楚[90]。
病原菌對植物 SWEET 轉運蛋白的誘導與病原體獲得寄主來源糖用于營養的能力增加有關。雖然人們普遍認為糖的代謝和調配是決定植物和病原菌在感染過程中持續戰斗的重要角色,但植物易感性或抗性反應的代謝特征及其調控模式仍然知之甚少[71]。隨著基因工程技術的發展,TALEN和CRISPR/Cas9技術可以被廣泛用于編輯植物的易感基因來實現廣譜抗性工程[91]。鑒于糖是植物生長、發育和作物產量各個方面的核心營養,隨著這一領域研究的進展,可以預期會有更多令人興奮的發現。

