碳青霉烯類異質性耐藥銅綠假單胞菌的耐藥機制研究
喬涵 胡辛欣 聶彤穎 楊信怡 游雪甫 李聰然,*
(1 中國醫學科學院北京協和醫學院醫藥生物技術研究所 抗感染藥物研究北京市重點實驗室,北京 100050; 2 中國食品藥品檢定研究院,北京 102629)
目前,銅綠假單胞菌(Pseudomonas aeruginosa,PA)是引起醫院感染的主要條件致病菌[1]。隨著抗菌藥物的廣泛使用,臨床中常常出現多重耐藥和泛耐藥的PA,導致嚴重且難以治療的醫院獲得性感染。免疫力低下患者對PA具有較高的易感性,PA引發的感染在該類人群中可導致較高的病死率[2]。
抗菌譜廣,抗菌能力強是碳青霉烯類藥物最主要的特征,通常情況下,治療銅綠假單胞菌感染臨床常用β-內酰胺類抗生素。致使PA對碳青霉烯類藥物敏感性越來越低,從而產生耐藥,臨床的醫治越來越艱難。2017年,WHO強調要盡快找出對抗耐碳青霉烯類銅綠假單胞菌(carbapenem resistantPseudomonas aeruginosa,CRPA)的藥物,從而治療細菌感染[3]。但異質性耐藥PA的出現,給耐藥檢測和臨床治療帶來了極大的挑戰。
異質性耐藥是細菌耐藥的一種特殊類型,指表面上同源的細菌表現出對特定抗生素部分敏感的現象[4],即在體外的常規藥敏試驗中,菌株表現為敏感,如若改用特殊方法檢測,則可以發現細菌的大部分亞群屬于敏感,但有一小部分亞群屬于耐藥,極少數亞群甚至表現為高水平耐藥,這部分耐藥亞群可以導致臨床抗生素治療失敗[5]。由于異質性耐藥的特殊性、難以治療性和不可預測性,越來越多的學者開始關注這一特殊現象,并研究如何快速檢測與有效治療異質性耐藥菌感染。
抗生素異質性耐藥第一次被提出,是在1947年的革蘭陰性流感嗜血桿菌中[6],而革蘭陽性葡萄球菌被發現有異質性耐藥現象大約是在20年以后[7],但是第一次用“異質性耐藥”一詞是在1970年。篩選異質性耐藥菌株的方法中最被認可的是群體分析法(population analysis profiling,PAP),被認為是鑒定異質性耐藥的金標準[5]。菌落計數PAP方法與標準細菌MIC測定方法相同,目的抗生素濃度梯度設定為2倍,并通過涂布平板菌落計數對異質性耐藥進行判定。如果抗生素對細菌展現最大抑制效果的最低藥物濃度(highest inhibitory concentration,HIC)高于8倍的對細菌沒有抑制效果的最高藥物濃度( highest noninhibitory concentration,HNIC)[4,8-9],那該菌株就可被定義為異質性耐藥菌株。其他方法還包括紙片法或E-test紙條法。E-test紙條法是將菌液調至2.0麥氏單位后,均勻涂布于MH平板,貼相應的E-test試紙條,37℃孵育48 h后觀察抑菌圈內是否有個別耐藥菌落生長的方法。
本研究的主要目的是鑒定篩選碳青霉烯類(亞胺培南)異質性耐藥臨床分離銅綠假單胞菌,并探究其異質性耐藥的可能機制,為碳青霉烯類異質性耐藥銅綠假單胞菌感染的防控提供參考。
1 材料與方法
1.1 實驗菌株
標準菌株:銅綠假單胞菌ATCC 27853;實驗菌株:銅綠假單胞菌臨床分離株30株,來自于中國醫學科學院病原微生物菌(毒)種保藏中心藥用微生物相關菌(毒)種保藏分中心(CAMS-CCPM-A)。
1.2 E-test 試紙條法
臨床菌株的培養按照《全國臨床檢驗操作規程》操作[10],E-test試紙條按照說明書操作,37℃培養48 h后,觀察抑菌圈形狀,和抑菌圈內是否有零星菌落。若抑菌圈內有零星菌落或抑菌圈邊緣不清,則判斷為可能異質性耐藥菌株。若沒有,則按照抑菌圈與E-test紙條的交界讀數。若在紙條兩邊有不同的交點,讀取較高值,如果差值大于1稀釋度,則為無法正確讀數。E-test結果為耐藥的菌株和無法正確讀數的菌株也列入異質性耐藥疑似菌株中。通過E-test試紙條法檢測為異質性耐藥的菌苔特征示意圖見圖1(抑菌圈內有零星菌落)。
圖1 E-test試紙條法檢測為異質性耐藥的菌苔特征Fig.1 Bacterial characteristics of the heteroresistant strains by E-test
1.3 群體分析法(PAP)
挑取新鮮平皿中的各菌株單菌落接種至CAMH培養基中37℃靜置培養過夜。配制含不同濃度藥物平皿,藥物濃度為0、0.06、0.125、0.25、0.5、1、2、4、8、16、32、64和128 μg/mL。將過夜菌液10倍系列稀釋,分別涂布于含不同濃度亞胺培南的各個平皿上,37℃培養48 h后計數各平皿上菌落數,異質性耐藥菌株判定標準為:對細菌最大抑制效果的最低藥物濃度(HIC)與對細菌沒有抑制效果的最高藥物濃度(HNIC)的比值大于8[9]。
1.4 最小抑菌濃度(MIC)測定
參照CLSI標準[10],測定菌株對鹽酸環丙沙星、多黏菌素B、頭孢他啶、美羅培南、慶大霉素、左氧氟沙星的MIC值,濃度測定范圍為0.06~128 μg/mL。
1.5 全基因組三代測序與二代重測序
1.5.1 全基因組測序菌株
將銅綠假單胞菌16-24進行PAP試驗,將在含 4 μg/mL亞胺培南平皿上生長的單菌落保存并命名為銅綠假單胞菌24-4;用銅綠假單胞菌24-4進行PAP實驗,在4 μg/mL和8 μg/mL亞胺培南含藥平皿上生長的單菌落保存并命名為銅綠假單胞菌24-4-4和銅綠假單胞菌24-4-8;將銅綠假單胞菌24-4在無藥平板上連續傳代5 d后再用PAP法篩選菌株,在含8 μg/mL亞胺培南平皿上生長的單菌落保存并標號為銅綠假單胞菌24-45-8。
通過PAP試驗發現,這5株同源菌株在亞胺培南誘導下,異質性變大,但當無藥物誘導連續傳代后,異質性有變小趨勢,如表3。將銅綠假單胞菌16-24做三代基因組測序后作為對照組,銅綠假單胞菌24-4、銅綠假單胞菌24-4-4、銅綠假單胞菌24-4-8、銅綠假單胞菌24-45-8做二代基因組重測序作為實驗組,比對實驗組是否有與異質性耐藥相關的基因突變。
1.5.2 測序方法
三代測序:按照Wizard?基因組DNA純化試劑盒(Promega)說明書進行基因組DNA提取,純化后建庫測序。制備的文庫在Illumina HiSeq X Ten儀器上進行雙端測序。利用PacBio RS Ⅱ對Illumina平臺生成的數據進行生物信息學分析。利用Glimmer對基因組中的編碼序列(CDS)進行預測,質粒基因采用GeneMarkS軟件預測,用tRNAscan-SE進行tRNA預測,用Barrnap進行rRNA預測。利用BLAST、Diamond、HMMER等序列比對工具,從NR、Swiss-Prot、Pfam、GO、COG、KEGG數據庫中對預測到的CDS進行蛋白功能注釋。
二代重測序:提取并檢測DNA樣本后構建DNA文庫,通過橋式 PCR后,Illumina Xten測序,利用trimmomatic軟件對原始下機數據進行質控,以保證后續分析結果的準確性。通過 BWA 軟件將有效測序與參考基因組比對,并利用SAM tools軟件標記重復序列。使用BreakDancer對SV進行檢測,過濾PE reads支持數小于4的SV,并使用ANNOVAR對其中的DEL、INS、INV進行注釋。與此同時,利用Cnvnator軟件對CNV 進行檢測。
1.6 PCR檢測耐藥相關基因突變
通過全式金細菌基因組提取試劑盒提取原始菌株和耐藥菌株全基因組DNA,PCR檢測誘導耐藥株中是否確有基因突變,所需引物見表1。
2 結果
2.1 E-test紙條法初篩異質性耐藥疑似株
采用E-test紙條對30株臨床分離銅綠假單胞菌進行異質性耐藥初篩,得到表2數據,40%(12株)的菌株為異質性耐藥疑似菌株。
2.2 PAP法確定異質性耐藥菌株
將異質性耐藥疑似菌株和標準菌株銅綠假單胞菌ATCC 27853同時用PAP法驗證菌株是否為異質性耐藥,結果如表3,從12株異質性耐藥疑似菌株中通過PAP方法確定了8株異質性耐藥菌。
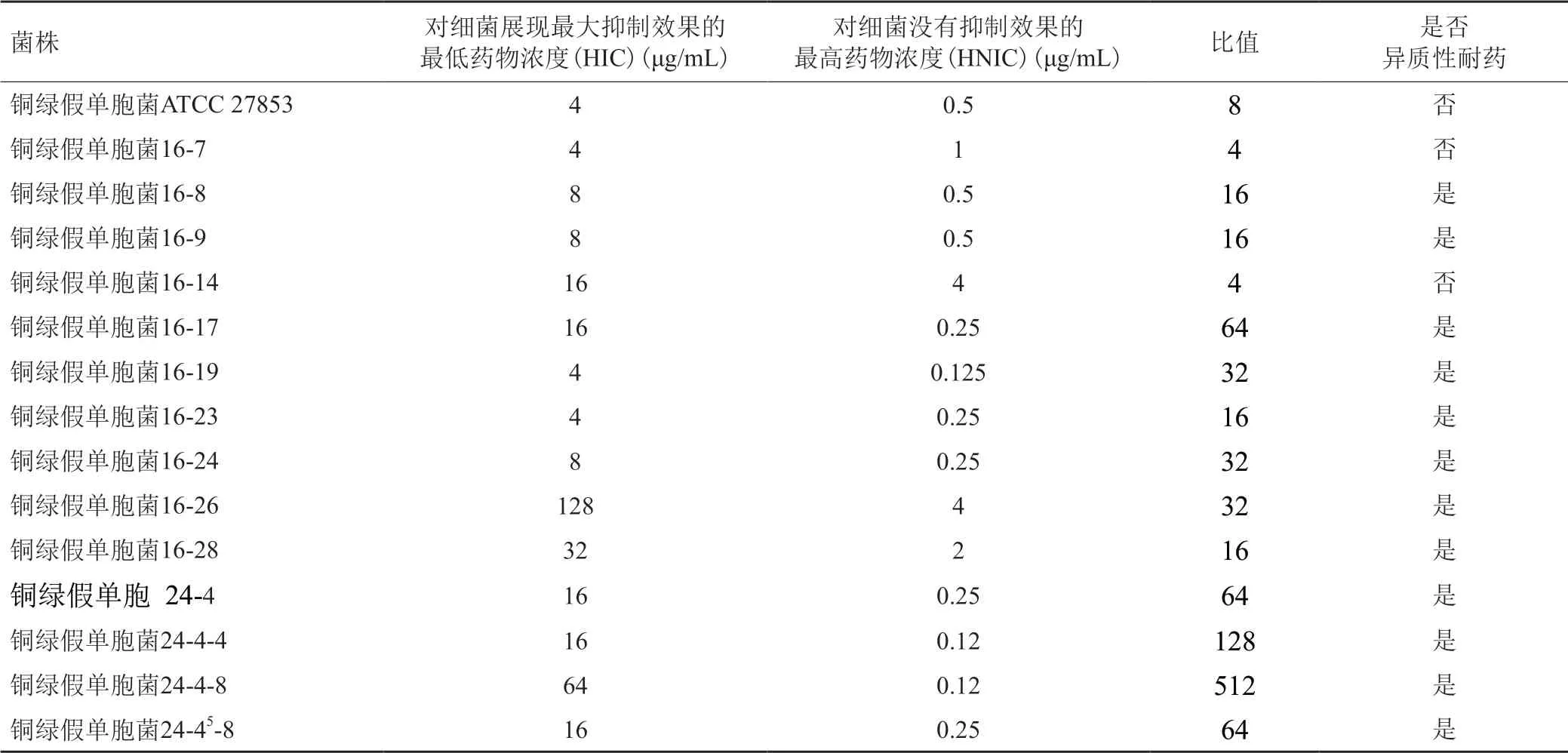
表3 PAP法驗證異質性耐藥菌株Tab.3 Validation of the heteroresistant strains by PAP method
2.3 異質性耐藥株對其他藥物的敏感性
用肉湯微量稀釋法測各菌株對其他藥物的MIC值,得出各菌株對其他藥物敏感性的累計百分率,結果如圖2所示。根據CLSI中銅綠假單胞菌對各藥物的耐藥標準,計算出各異質性耐藥菌株對其他藥物的耐藥率,結果顯示,異質性耐藥株對多黏菌素B、頭孢他啶、美羅培南耐藥率較高,對其他藥物相對更敏感。
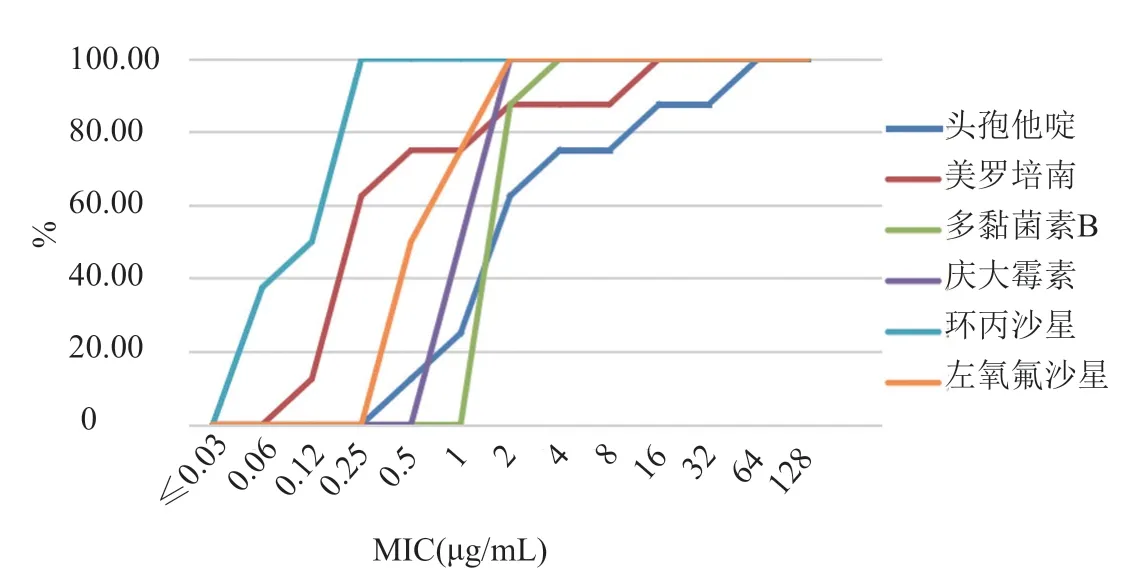
圖2 異質性耐藥菌株對其他藥物的敏感性Fig.2 Susceptibility of heteroresistant strains to other drugs
2.4 全基因組測序及PCR驗證結果
將銅綠假單胞菌16-24做三代基因組測序后,采用Circos v0.64(http://circos.ca/)軟件繪制基因組圈圖(圖3)。其余菌株做二代基因組重測序,比對銅綠假單胞菌16-24數據,利用BWA比對軟件將質控后的測序片段比對回參考基因組;利用Picard-tools去除PCR duplication 產生的測序片段。分析4479個不同基因片段,未發現在實驗組中發生多拷貝的片段或基因。
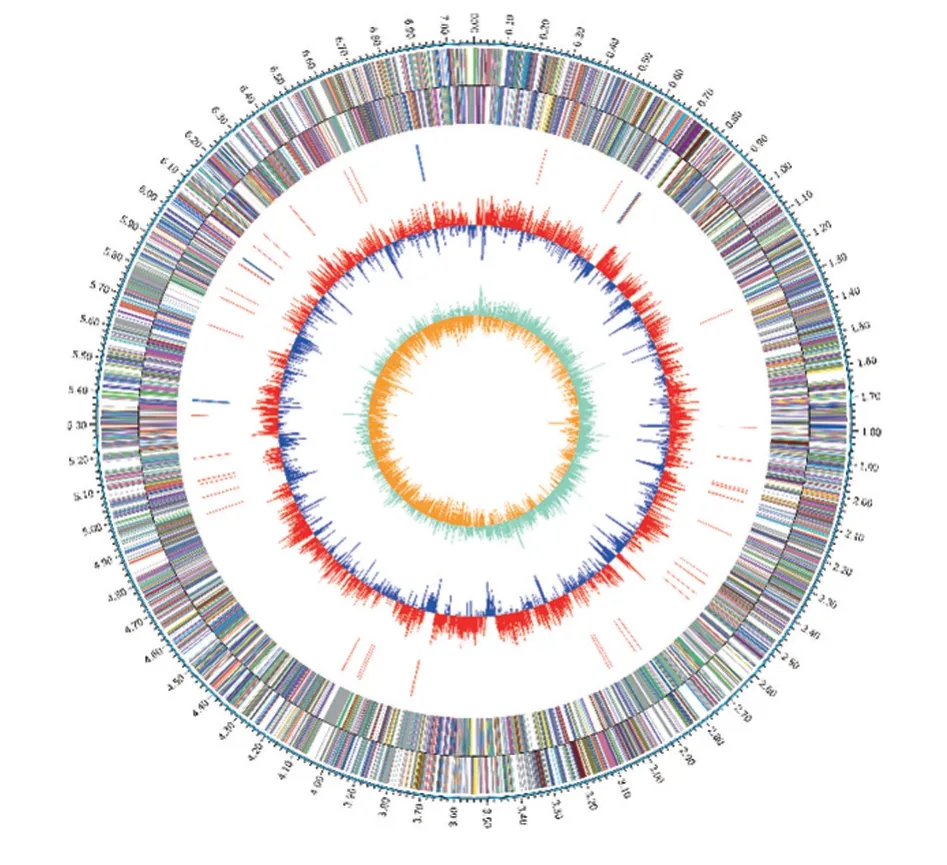
圖3 銅綠假單胞菌16-24基因組圈圖Fig.3 Genome circle map of P.aeruginosa 16-24
根據測序結果并排除組裝錯誤,我們篩選出可能與異質性相關的基因突變并通過PCR擴增進行驗證。擴增長度為1~1.5 kb的片段,PCR產物送生工生物工程上海股份有限公司測序并與原始菌株的PCR產物序列進行比對。結果如表4所示,得到的PCR產物與母體菌株銅綠假單胞菌16-24相比,除gene3279、gene5991、gene5622 3個基因更換引物后仍未擴增出外,其余基因均未突變。

表4 確證SNP位點結果數據統計表Tab.4 Confirmed SNP locus result data statistics table
gene5991是與酰基脫水酶有關的基因,但關于這個細菌蛋白質家族沒有已知的功能。gene5622是一個假定蛋白,目前還沒有關于其功能的描述。因此,我們把研究重點放在gene3279上,一個與雙功能乙醛酸/羥基丙酮酸還原酶有關的基因。由于gene3279長度為985 bp,片段長度較短,若基因內部片段發生翻轉,會導致測序時可以正常拼接,但擴增時,更換多個引物也不能有效擴增出產物的情況,因此我們判斷gene3279有可能為基因內部片段發生翻轉,或基因內形成發卡結構等原因不能有效擴增,但不論如何,都可能使該基因編碼的蛋白發生改變甚至失活。
最外面一圈為基因組大小的標識,每一個刻度為0.1 Mb;第二圈和第三圈為正鏈、負鏈上的 CDS,不同的顏色表示CDS不同的COG的功能分類;第四圈為 rRNA 和 tRNA;第五圈為GC含量。
3 討論
β-內酰胺類抗生素,到目前為止是臨床治療重癥PA感染的一線用藥,若臨床治療中遇到藥敏試驗顯示碳青霉烯類敏感的異質性耐藥菌,很可能錯過最佳治療時間,甚至發展成多重耐藥菌,對臨床治療造成巨大風險。因此,探索異質性耐藥PA在臨床分離菌株的分布情況和異質性耐藥的產生機制十分必要。
E-test紙條法篩查異質性耐藥菌株簡便快捷,但紙條價格偏高,且根據實驗,篩查異質性的假陽性率為9.09%。PAP法雖然是實驗室鑒定異質性耐藥菌株的金標準,但所消耗的時間與人力財力極大,現實臨床治療中難以實現。故根據本研究結果,E-test紙條法是目前相對較為合理的臨床篩查異質性耐藥的方法。
微量肉湯稀釋法測各菌株對其他藥物的MIC結果顯示,對于亞胺培南異質性耐藥的PA,似乎顯示出對多黏菌素B、頭孢他啶、美羅培南耐藥率較高,而對其他藥物的耐藥率并不高。誠然,可能因為異質性耐藥菌樣本數量不足導致的結果誤差。但就目前結果看來,亞胺培南異質性耐藥菌株對環丙沙星等的敏感性似乎很高,與文獻中推薦的在臨床治療中,若某菌株初步鑒定為異質性耐藥菌,則可優先考慮環丙沙星等藥物進行聯合治療[11],為挽救重癥患者生命爭取寶貴的治療時間相一致。
遺傳分析表明,大多數異質性耐藥是不穩定的,通常由自發串聯擴增已知的耐藥基因,引起細菌亞群的耐藥性增加[12]。且實驗中發現銅綠假單胞菌16-24在PAP實驗過程中,雖結果為異質性,但每次異質性范圍有一定差距,故我們將銅綠假單胞菌16-24作為重點研究對象進行進一步的機制研究。根據對異質性耐藥菌株的全基因組測序和重測序數據分析,未發現突變體中發生多拷貝的大片段,也未發現在突變體中發生多拷貝的基因。
異質性耐藥在基因層面的機制還有可能是某重要基因突變造成。根據三代基因測序結果并排除組裝錯誤,除gene3279、gene5991、gene5622 3個基因更換引物后PCR未擴增出片段外,其余基因均未突變。gene3279是一個與雙功能乙醛酸/羥基丙酮酸還原酶有關的基因,編碼EF-P(延伸因子 P)是一種必需蛋白質,在細菌中可刺激蛋白質合成中第一個肽鍵的形成[13-14]。EF-P由Glick和Ganoza于1975年發現[15],它可能通過改變核糖體對氨酰-tRNA 的親和力間接發揮作用,從而增加它們作為肽基轉移酶受體的反應性[14]。EF-P不是最小體外翻譯系統的必要組成部分,但EF-P 的缺失會限制翻譯速率、抗生素敏感性和細菌的生長速率都會被影響。gene5991可能是與酰基脫水酶有關的基因,但關于這個細菌蛋白質家族沒有已知的功能。一些成員將蛋白質注釋為Mn2+/Zn2+轉運系統的滲透酶成分,但這無法得到證實。Gene5622是一個假定蛋白,目前還沒有關于其功能的描述。對于靶基因不能通過常規手段擴增問題,近期有研究表明,基因中某些片段的倒位翻轉有可能導致正常設計引物后,靶基因無法擴增。若基因片段翻轉,該基因編碼的蛋白則無法正常表達,致基因失活,從而可能導致細菌的異質性耐藥。因此,銅綠假單胞菌對碳青霉烯類藥物的異質性耐藥有可能與EF-P有關。
綜上所述,探索PA對碳青霉烯類藥物異質性耐藥的機制,以發現更有效的對抗耐藥的靶點是極為必要的。后續我們會繼續從基因、轉錄以及翻譯等層面,探索PA異質性耐藥的機制。本文中闡述的方法、結果及機制希望可以對臨床治療和基礎探究提供參考。

