黃連根腐病病原菌的分離鑒定及其拮抗菌篩選
廖海浪 鐘芙蓉 柯汶佳 李娜 馬云桐,*
(1 成都中醫藥大學藥學院,成都 611137;2 四川省農業科學院經濟作物育種栽培研究所,成都 611300;3 西南特色中藥資源國家重點實驗室,成都 611137)
黃連(COPTIDIS RHIZOMA,Huanglian)為毛茛科植物黃連Coptis chinensisFranch.、三角葉黃連C.deltoideaC.Y.Cheng et Hsiao或云連C.teetaWall.的干燥根莖,具有清熱燥濕,瀉火解毒等功效[1]。由于市場需求量大,野生資源被過度采挖,野生黃連原植物已處于瀕危的狀態。商品藥材主要來源于毛茛科植物黃連的栽培品。目前,生產中出現兩大急需解決的問題,一是根腐病的防治;二是“連作障礙”的問題。黃連連作也多導致根腐病暴發,黃連大面積腐爛死亡。根腐病多發生在黃連種植2~4年后,且不易被發現,一旦發生將造成極大的經濟損失。生產上常采用拔除病株,高錳酸鉀溶液灌根等方法處理,但效果不佳,缺乏有效的防治藥物。目前黃連根腐病的研究主要集中于病原菌分離鑒定等方面,但根腐病作為一種典型的土傳病害,通常可以分離獲得多種病原菌[2],目前文獻報道的黃連根腐病的主要病原菌包括F.solani[3]、F.carminascens[4]、尖孢鐮刀菌(F.oxysporum)[5]、三線鐮刀菌(F.tricinctum)[5]、F.aνenaceum[6]和Diaporthe eres[7]。課題組前期研究表明黃連根腐病可能是由多種病原菌導致的,其中主要包括Fusarium、Volutella、Exophiala、Cylindrocarpon等多種真菌[8]。明確黃連根腐病病原菌,是認識和解決黃連根腐病的第一步。本研究采用經典的柯赫氏法則進行黃連根腐病病原菌分離和致病性測定,通過分子和形態對其進行鑒定,并對其致病過程進行研究,為黃連根腐病發生的微生態機制驗證奠定基礎,也為黃連根腐病的防治奠定一定基礎。
植物微生物組作為植物的擴展基因組,在植物生長發育過程中發揮重要作用。越來越多的證據表明,宿主積極塑造自己的微生物群來抑制疾病發生[9],微生物群在植物健康生長過程中產生積極影響。通過健康黃連根際根內微生物網絡分析發現,健康黃連根際根內有大量的微生物與病原微生物呈負相關,表明健康黃連根際根內存在大量的有益微生物,對病原微生物具有一定的拮抗作用,對于維持黃連植株的健康具有至關重要的作用[8]。本研究通過多種篩選培養基,對黃連根際根內微生物進行分離,采用平板拮抗實驗篩選具有拮抗作用的微生物,為開發黃連根腐病的生物防治制劑奠定基礎,也為黃連根腐病微生物防治提供微生物資源。
1 實驗材料、試劑及儀器
1.1 實驗材料
2018年11 月于洪雅縣瓦屋山藥業有限公司黃連種植基地(四川省眉山市洪雅縣高廟鎮黑山村2組,29°29′10.91″ N,103°9′39.9″ E)采集健康黃連和感染根腐病黃連的帶土根系作為實驗材料。
1.2 培養基
病原菌分離培養基選擇常用的馬鈴薯葡萄糖瓊脂培養基(potato glucose agar medium,PDA),拮抗菌的分離選擇常用的真菌培養基包括PDA,察氏培養基(Czapek-Dox medium,CZ),馬丁氏瓊脂培養基(Martin's agar medium,M)和細菌培養基常用培養基包括土壤浸出液瓊脂培養基(soil extract agar medium,TR)[10],酵母提取物甘露醇培養基(yeast extract mannitol medium,YEM),M408培養基(M408),自來水酵母提取物培養基(tap water yeast extract medium,TWYE),酵母培養基(yeast medium,JM)。部分細菌培養基配方來源于16S rDNA數據預測培養基(https://komodo.modelseed.org/growrec.htm),主要培養基包括營養瓊脂培養基(nutrient agar medium,NA,ID:DSMZ_Medium1),肉膏蛋白胨培養基(Luria-Bertani medium,LB,DSMZ_Medium381),內生固氮菌培養基(diazotrophic medium,RBA,ID:DSMZ_medium441),非自養培養基H3P(heterotrophic medium H3P,H3P,ID:DSMZ_Medium428),胰酪胨大豆肉湯培養基(trypticase soy broth agar,535,ID:DSMZ_Medium535),R2A培養基(R2A medium,830,ID:DSMZ_Medium830),鏈霉菌培養基GYM(GYM Streptomyces medium,GYM,ID:DSMZ_Medium65),胰蛋白胨大豆瓊脂培養基CASO(CASO agar,CASO,ID:DSMZ_Medium220)。
2 實驗方法
2.1 病原菌分離
采用組織分離法[53],取感病黃連植株根莖及須根,自來水下沖洗干凈,75%乙醇消毒30 s,2%次氯酸鈉消毒10 min,無菌水漂洗3~5次,用濾紙吸干,用無菌剪刀剪取病健交界處,在無菌條件下接種于含青霉素100 mg/L的PDA培養基中,溫度設置為25℃,在培養箱中暗培養5~7 d。每天早晚各觀察1次,待有新的肉眼可見的菌落,立即采用劃線稀釋法進行純培養,將純培養菌落接種于PDA斜面培養基,編號并記錄,25℃長至菌落布滿整個培養基,于4℃保存菌種。
2.2 病原菌鑒定
2.2.1 病原菌系統發育分析
在PDA培養基上分別活化4℃冰箱中的保存的疑似病原菌,在25℃培養箱中暗培養5~7 d,取適量孢子或菌絲至2 mL的EP試管中,再用真菌基因組DNA快速抽提試劑盒進行DNA提取,按照試劑盒說明書操作。
選用通用引物ITS1(5'-TCCGTAGGTGAACCTGC GG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')對ITS 序列進行擴增,通用引物EF-1(5'-CATCGAGAAGTT CGAGAAGGTT-3')和EF-2(5'-CATGTTCTTGATGAA -3')對EF-1α基因[11]進行擴增。
25 μL PCR反應體系為:2×TaqPCR Master Mix溶液、10 μmol/L上下游引物各1 μL、模板2 μL,補充ddH2O至25 μL。擴增程序為:94℃預變性5 min; 94℃變性30 s,ITS 52℃退火30 s,EF-1α 56℃退火30 s,72℃延伸1 min,34個循環;72℃總延伸7 min,4℃保存。
擴增產物用1.5%的瓊脂糖凝膠進行電泳監測,將PCR擴增后的產物送樣至擎科生物技術有限公司進行測序。所得到的核苷酸序列在GenBank進行同源性比較。用系統發育分析軟件PAUP* 4.0 Beta 10運行相關文件,執行最大簡約法的分析運算[12]。
2.2.2 病原菌形態學鑒定
將純化后的菌株接種于PDA培養基上進行活化,25℃倒置培養,觀察菌落特征。使用插片培養法對病原菌的形態進行鑒定,即將無菌的蓋玻片以45°斜插入培養基中,緊靠接種物,使菌體沿蓋玻片生長,置25℃培養箱培養3~5 d。培養完畢后,取出蓋玻片放在載玻片上,直接用低倍鏡觀察病原真菌的自然生長個體形態。觀察記錄解剖鏡下菌落特征、產孢結構及孢子形態。
2.2.3 病原菌致病性測定
隨機選取2年生黃連,每組10株,自來水下沖干凈,錫箔紙包裹地上部分,無菌操作臺上對根部進行滅菌,依次用75%乙醇消毒30 s,2%次氯酸鈉消毒10 min,無菌水漂洗3~5次,用濾紙吸干表面水分。分別在濃度為106CFU/mL的各種真菌孢子混懸液中浸根30 min,另外在0.5%吐溫20磷酸緩沖液中浸根相同時間作為空白對照,單株放置于50 mL無菌離心管中,管口用無菌的濕棉花保持根部濕潤,離心管用錫箔紙包裹遮光,置于人工氣候室培養7~10 d,觀察并記錄各組幼苗生長變化情況。待黃連發病后,從接種發病的黃連須根上再次分離病原菌,完成柯赫氏法則驗證,則能確認為黃連根腐病原菌。
2.3 病原菌侵染過程觀察
取健康黃連根系,洗凈,自來水下沖洗1 h,按照無菌操作法,轉移至無菌瓶中,75%乙醇浸泡30 s,2%次氯酸鈉溶液消毒10 min,無菌水清洗5次,每次1 min。分別置墊有濾紙保濕的容器中,每個容器置3個樣品。用移液槍取上述孢子懸浮液分別滴加在不同的樣品上,以滴加0.5%吐溫20磷酸緩沖液和1%綠豆湯培養基的樣品為空白對照。每個處理重復3次,將容器置于25℃培養箱中黑暗培養。分別于接種后0.5、1、2、3、4、5、6 和7 d隨機選取3根黃連根系用于固定。用手術解剖刀將黃連根系樣本切成0.5~ 1 cm長的小段,將樣品置入pH6.8、2.5%戊二醛固定液中,進行前固定并存放于4℃冰箱中冷藏2 h左右。將固定液吸出,使用pH6.8、0.1mol/L PBS緩沖液沖洗樣品3次,每次10 min。使用乙醇(其濃度為50%、70%和90%)進行梯度濃度脫水,10 min/次,再用濃度為100%的乙醇脫水,15 min/次,重復2次。加入50 % 叔丁醇的乙醇溶液置換1次,再用純叔丁醇置換2次,每次15 min。將樣品取出黏附于導電碳膠帶上,置超臨界CO2干燥儀中進行干燥。用Gressington 108型自動濺射鍍膜機在樣品表面鍍上一層厚10.0~15.0 nm的金屬膜,置于SEM電鏡下觀察。
2.4 黃連根際根內微生物分離
2.4.1 接種菌懸液制備
將黃連根系自土塊中取出,輕輕抖動除去松散的附在根上的土粒。稱取約l0 g根系,置盛l00 mL無菌磷酸緩沖液(PBS)的三角瓶中,振蕩15 min,以洗下的土制成根際土懸液,離心得根際土。用無菌鑷子取出根系,用無菌濾紙吸干,用75%乙醇浸泡30 s,2%次氯酸鈉溶液消毒10 min,無菌水漂洗3~5次,取出后用無菌濾紙吸干,再用無菌剪刀將根剪成小段,即得黃連無菌根系。分別稱取根際土和無菌根系約1.0 g于無菌研缽中磨碎,然后加10 mL無菌磷酸緩沖液(PBS,Na2HPO41.44 g,KH2PO40.24 g,KCl 0.2 g,NaCl 8.00 g,溶解后定容至1 L,調pH至7.4,121℃滅菌15 min)攪拌混勻即得根內菌懸液。以10倍稀釋法分別稀釋成一系列的稀釋液(10-2~10-8)。
2.4.2 黃連根際微生物分離
稀釋涂布法:取上述不同稀釋濃度的根際土菌懸液100 μL分別接種于上述培養基表面,用無菌涂布器涂布均勻。每個培養基,每個稀釋濃度各重復10次。培養條件,菌株純化保存同上。
2.4.3 黃連根內微生物分離
外植體接種法:將滅菌的黃連根系小段,接種于平板培養基上,細菌采用37℃培養,真菌采用25℃培養。待有新的菌落長成之后,挑取菌落到相應培養基平板上經過劃線稀釋法獲得單一菌落,挑取單一菌落至斜面培養基上培養并短時間保存。
稀釋涂布法:取上述不同稀釋濃度的根內菌懸液100 μL分別接種于上述培養基表面,用無菌涂布器涂布均勻。每個培養基,每個稀釋濃度各重復10次。培養條件,菌株純化保存同上。
2.5 黃連根腐病生防菌篩選
2.5.1 生防細菌篩選
參照Hussein等[13]的平板對峙法,將黃連根腐病病原菌在PDA培養基平板上活化4 d,待長出菌絲后,打孔器打孔菌餅(直徑7 mm)置于另一新鮮PDA培養基平板中央,將分離得到的細菌以劃線的方式接種于病原菌菌塊東南西北4個方向各1株待篩細菌,距離2.5 cm,菌株劃線長度約2 cm,28℃培養3 d后,觀察病原菌與拮抗細菌之間是否有拮抗現象(明顯的拮抗帶或明顯的生態位占領),每組設3個平行。在對照組PDA平板中間接種病原菌瓊脂塊,28℃培養4 d,病原菌鋪滿整個平板[14]。采用兩側劃線同一拮抗細菌進行復篩,培養7 d后測量拮抗半徑并計算抑菌率[15]。
2.5.2 生防真菌篩選
采用平板對峙法并略作修改,將黃連根腐病病原菌和待篩選真菌在PDA培養基平板上活化4 d,待長出菌絲后,打孔器打孔菌餅置于另一新鮮PDA培養基平板中央,25℃下繼續培養2 d。將分離出的待選拮抗菌株點種于病原菌菌餅周圍,每皿接種4個點,4個點接種不同待篩真菌,25℃恒溫條件下培養,根據有無抑菌圈及抑菌帶的大小判斷其拮抗效果。同時對具有拮抗作用的菌株進行二次對峙實驗,篩選出拮抗能力較強的菌株以備后續實驗[16]。采用3點杯碟平板對峙生長速率法,培養7 d后測量拮抗半徑并計算抑菌率[15]。

2.6 拮抗菌分子鑒定
4℃保存的拮抗細菌先于NA培養基上分別活化,細菌在37℃培養箱中暗培養5~7 d,細菌在25℃培養箱中暗培養5~7 d,取適量菌體至2 mL的EP試管中,再用細菌基因組DNA快速抽提試劑盒進行DNA提取,按照試劑盒說明書操作。
選用通用引物:27F(5'-AGAGTTTGATCCTGGCT CAG-3')和1429R(5'-GGTTACCTTGTTACGACTT-3')對16S序列進行擴增。
選用通用引物:ITS1(5'-TCCGTAGGTGAACCTG CGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')對ITS序列進行擴增。
25 μL PCR反應體系為:2 ×TaqPCR Master Mix溶液、10 μmol/L上下游引物各1 μL、模板2 μL,補充ddH2O至25 μL。擴增程序為:94℃預變性5 min;94℃變性45 s,56℃退火45 s,72℃延伸90 s,34個循環;72℃延伸7 min,4℃保存。
擴增產物用1.5%的瓊脂糖凝膠進行電泳監測,將PCR擴增后的產物送樣至擎科生物技術有限公司進行測序。
所得到的核苷酸序列在GenBank進行同源性比較。選取標準菌株和原序列一起,采用在線的MAFFT(https://mafft.cbrc.jp/alignment/server/index.html)進行多序列比對[17]。采用Mesquite[18]將獲得的fasta格式序列轉換為phy格式。進入ATGC網站(http://www.atgc-montpellier.fr/),選擇在線工具PhyML進行最大似然發育樹構建[19]。
2.7 離體根上4株芽胞桿菌與2種病原菌的拮抗情況
以無菌水作為陰性對照(CK),用鑒定出的4株芽胞桿菌屬細菌:B.νelezensisGJ-JM-1、B.subtilisGJTR-064、B.mycoidesGJ-LB-021、B.pseudomycoidesGJ-YEM-005。測定離體根的拮抗能力。選取約10 cm長的須根,將病原體的孢子懸浮液(2.1×107CFU/mL,100 μL)接種在最右側(頂端)10 mm的須根內,將相應的芽胞桿菌菌株(A600=1、100 μL)接種在最左側(基部)10 mm的須根內。濕潤培養7 d后,觀察離體根病原菌侵染的距離和侵染率。
3 實驗結果
3.1 病原菌分離鑒定
3.1.1 病原菌系統發育分析
通過病原菌分離,共獲得12株疑似病原菌,經過NCBI數據庫BLAST比對,挑選合適菌株,基于供試菌株的ITS、EF-1α基因序列構建聯合系統發育樹。如圖1所示,供試菌株CC-2-1,CC-2-2,CC-2-3,CC-2-4,CC-JING-1,CC-JING-2,CC-5-1和CC-5-2與菌株F.solaniMAFF 840046和F.solaniTH03-1聚集于一支,且支持率達100%,供試菌株CC-4-1,CC-4-2,CC-4-3和CD-4-1與F.aνenaceumRIFA-7和F.aνenaceumCC32聚集于一支,且支持率達100%。
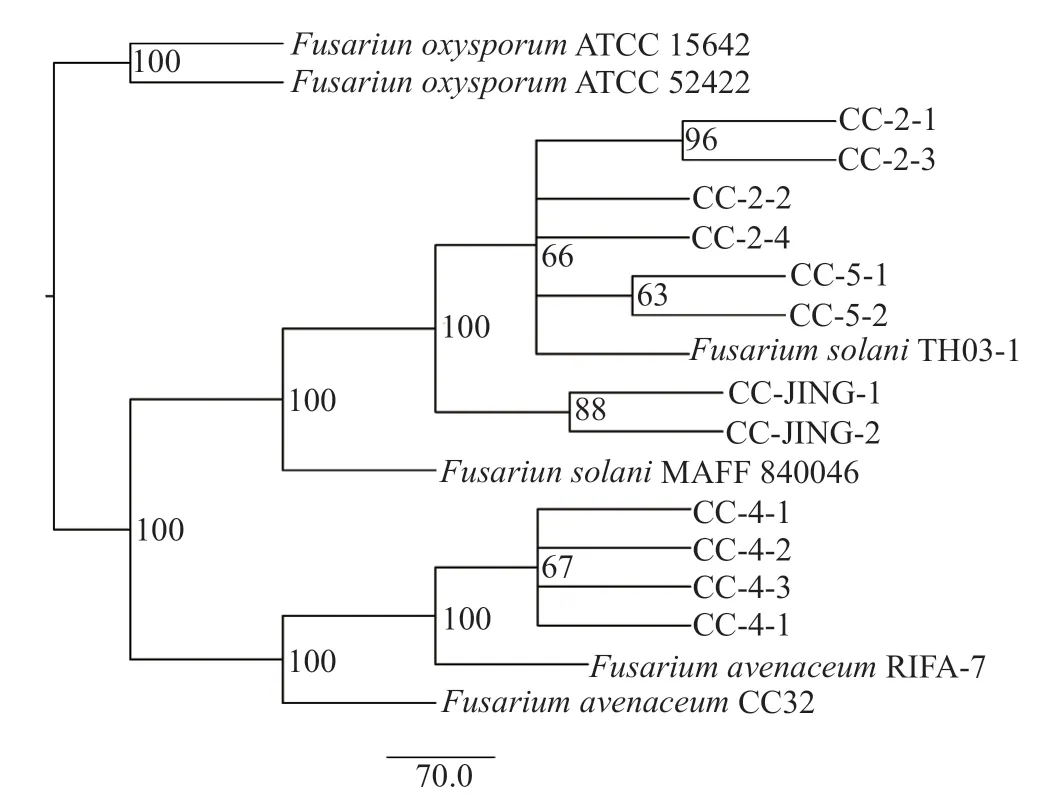
圖1 基于ITS和EF-1α串聯序列的進化樹Fig.1 Phylogenetic tree based on ITS and EF-1α concatenated sequences
3.1.2 病原菌形態學鑒定
CC-2-1,CC-2-2,CC-2-3,CC-2-4,CCJING-1,CC-JING-2,CC-5-1和CC-5-2在PDA形成白色稀疏菌絲體,在瓊脂中不產生色素。分生孢子較寬,直而粗壯,有3~5個隔膜。頂端細胞鈍而圓,足細胞幾乎沒有切口,鑒定為F.solani。(圖2 A、C、E)CC-4-1,CC-4-2,CC-4-3和CD-4-1在PDA形成了豐富的白色菌絲體,并在瓊脂中產生玫瑰色素。大型分生孢子長而細,直至稍彎曲,有1~3個隔膜,細胞頂端逐漸變細和彎曲,鑒定為F.aνenaceum(圖2B、
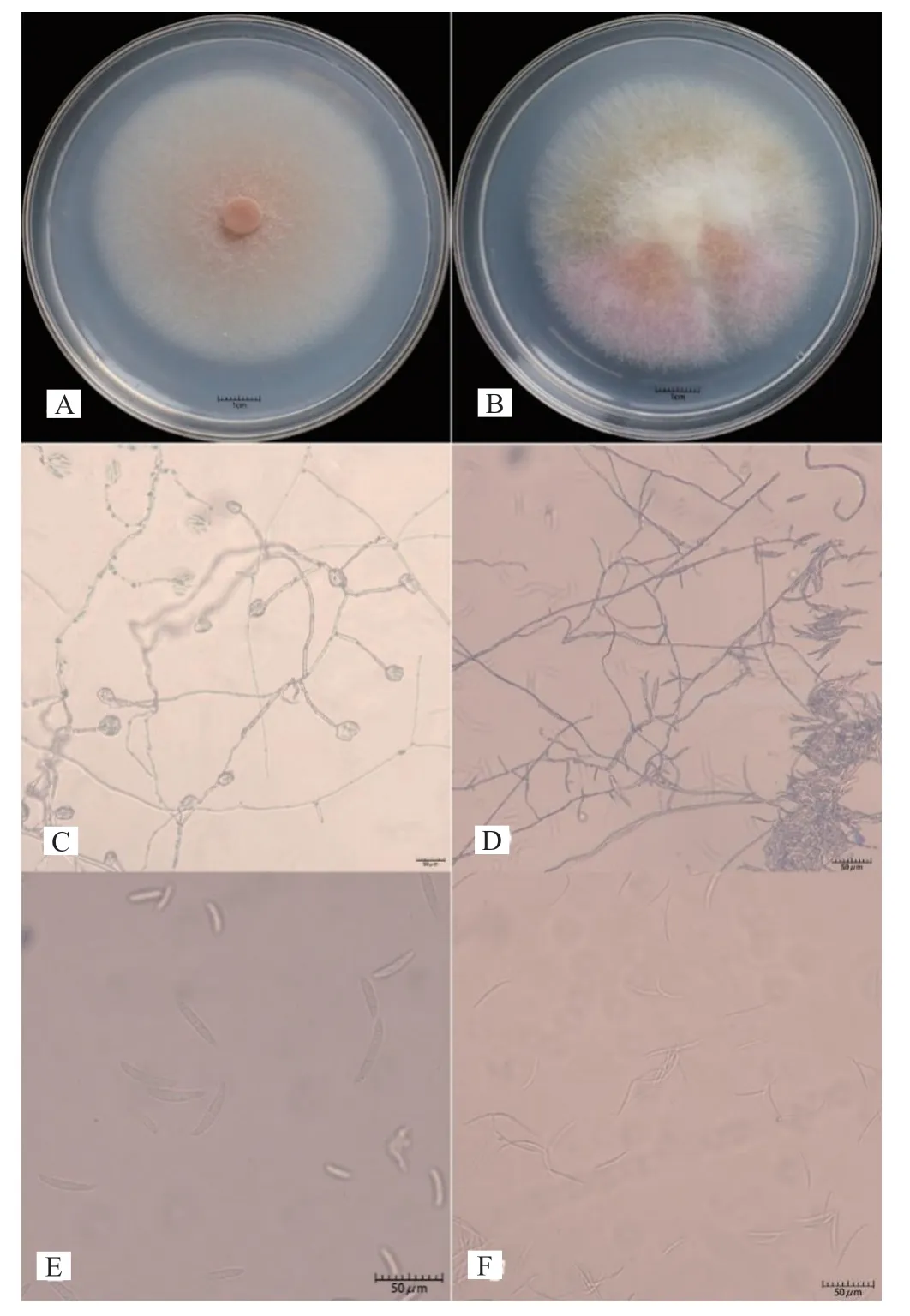
圖2 代表病原菌的形態鑒定Fig.2 Morphological identification of representative pathogens
D、F)。
3.1.3 致病性測定及病原菌致病過程
各株病原菌回接后,黃連植株均表現為須根變黑,腐爛,須根病健交界處出現大量白色菌絲,葉片出現明顯的枯萎現象。選取腐爛根系病健交界處進行再次分離,仍然能100%分離得到所用菌株(圖3)。

圖3 代表菌株致病性與大田黃連根腐病癥狀Fig.3 Pathogenicity of representative strains and symptoms of root rot of Coptis chinensis in field
兩種黃連根腐病病原菌侵染黃連根系過程基本一致,病原菌孢子在0.5 d內便可黏附于黃連根系表面(圖4A和E),于0.5~1 d內開始萌發,2 d后菌絲黏附于黃連根系并迅速生長(圖4B和F),尋找黃連根系受損部位入侵黃連根系內部(圖4C和G),6~7 d遍布整個黃連根系并產生大量的孢子(圖4D和H)。
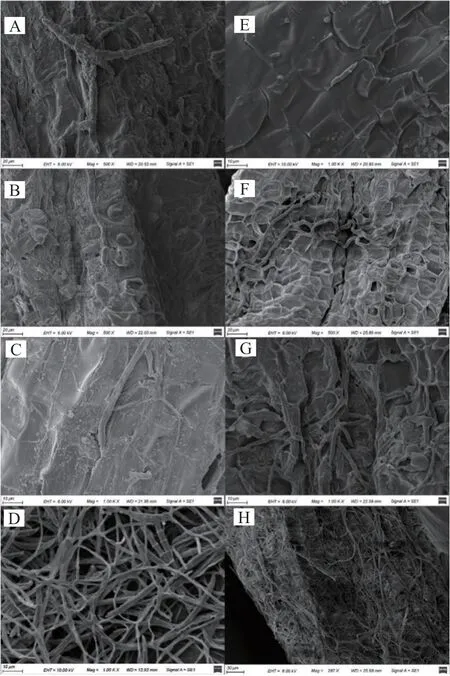
圖4 F.solani和F.aνenaceum侵染黃連根系過程Fig.4 Root infection process of by F.solani and F.aνenaceum in C.chinensis
3.2 黃連根際根內微生物分離
采用多種培養基對黃連根系微生物進行分離,不同培養基收集到的菌株數目見表1。健康黃連根際共獲得358株細菌和69株真菌,根內共獲得170株細菌和175株真菌。

表1 健康黃連根際、根內微生物分離統計Tab.1 Isolation and statistics of microorganisms in rhizosphere and endosphere of healthy C.chinensis
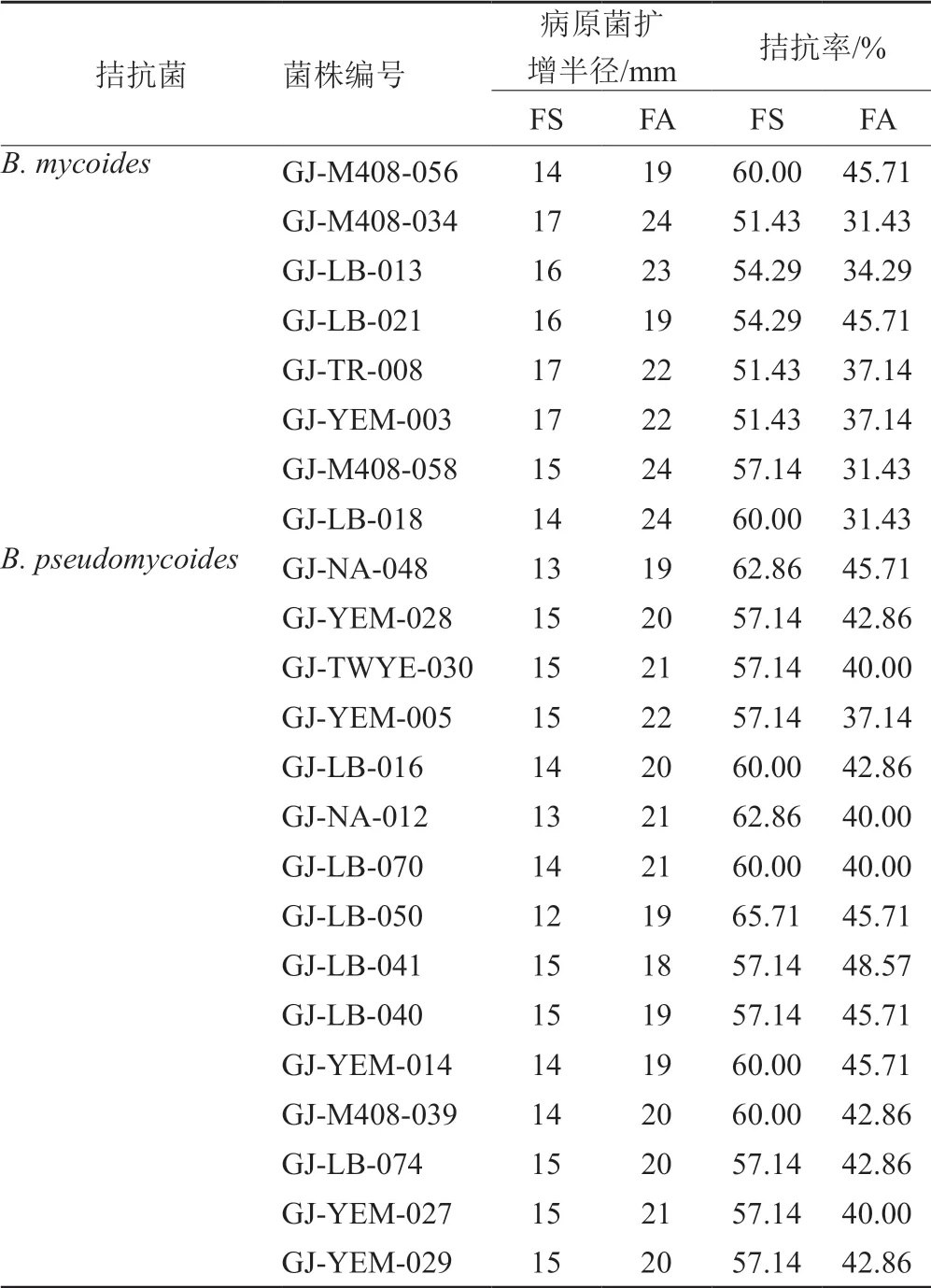
3.3 拮抗菌活性評價及分子鑒定(表2~3和圖5~6)
圖5 拮抗細菌與病原菌的平板拮抗活性Fig.5 The antagonistic activities of four representative antagonistic bacteria and pathogens
對篩選到的具有拮抗活性的細菌和真菌分別進行DNA提取、16S區域和ITS區域進行擴增測序,所得到的核苷酸序列在GenBank進行同源性比較。選取標準菌株和原序列一起,采用在線的MAFFT進行多序列比對。采用Mesquite軟件將獲得的fasta格式序列轉換為phy格式。進入ATGC網站選擇在線工具PhyML進行最大似然發育樹構建。拮抗細菌系統發育樹見圖7~8,拮抗真菌系統發育樹見圖9。拮抗菌拮抗活性及菌株匯總見表2,拮抗細菌匯總見表~3。本實驗共獲得77株拮抗菌,其中拮抗細菌58株,分布于7屬15種,拮抗真菌19株,分布于4屬5種。
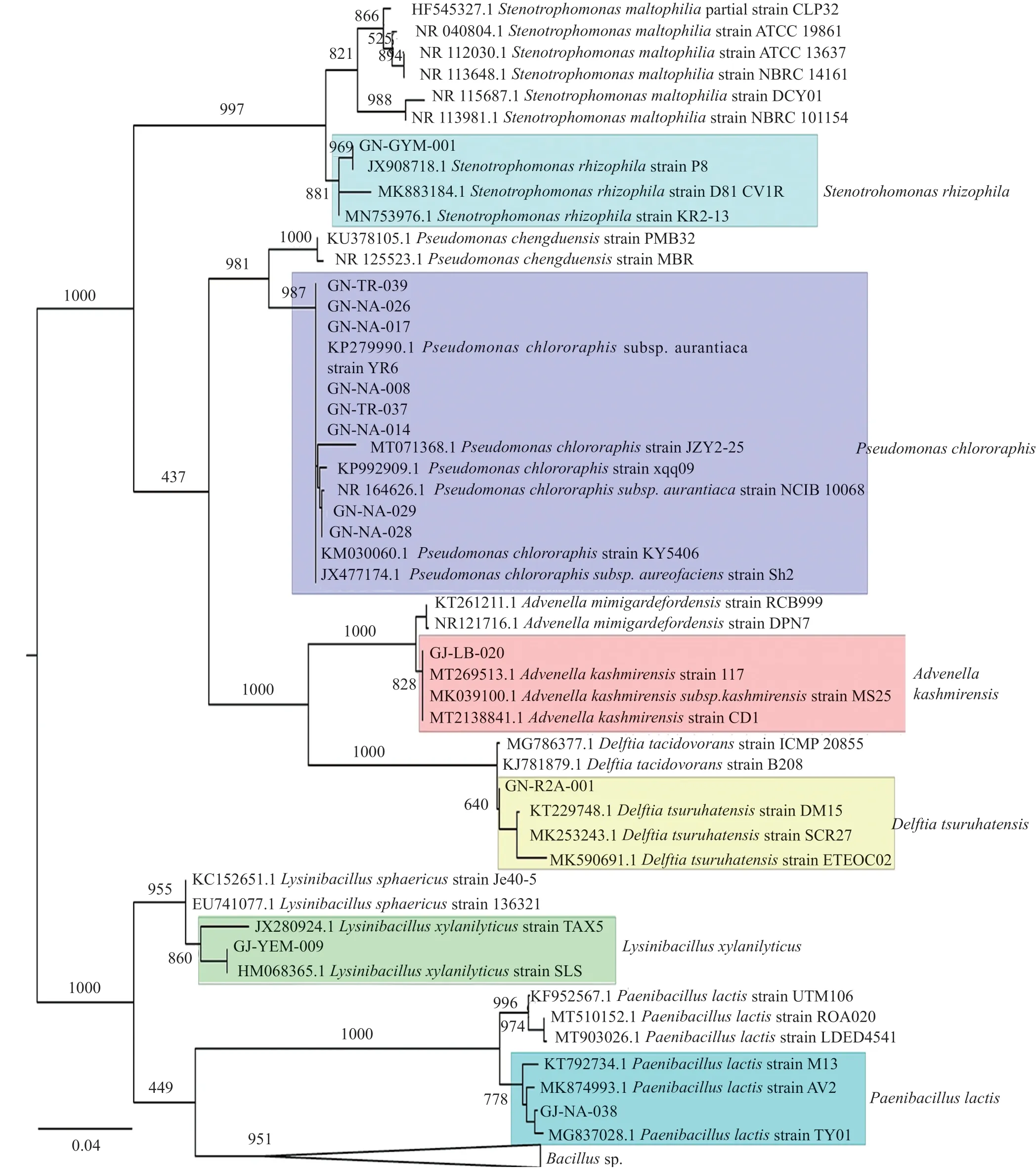
圖7 拮抗細菌系統發育樹Fig.7 Phylogenetic tree of antagonistic bacter
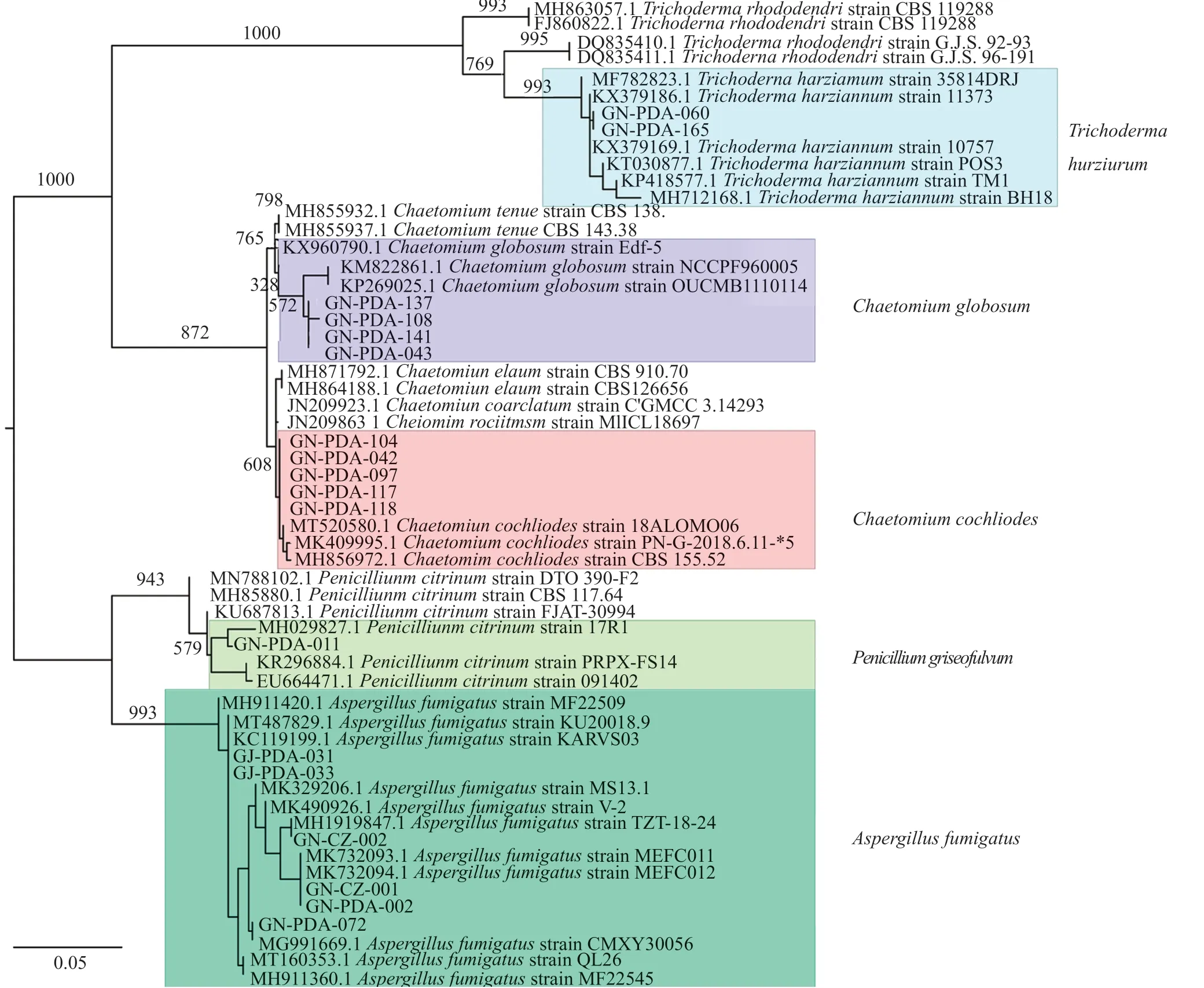
圖9 拮抗真菌系統發育樹Fig.9 Phylogenetic tree of antagonistic fungi
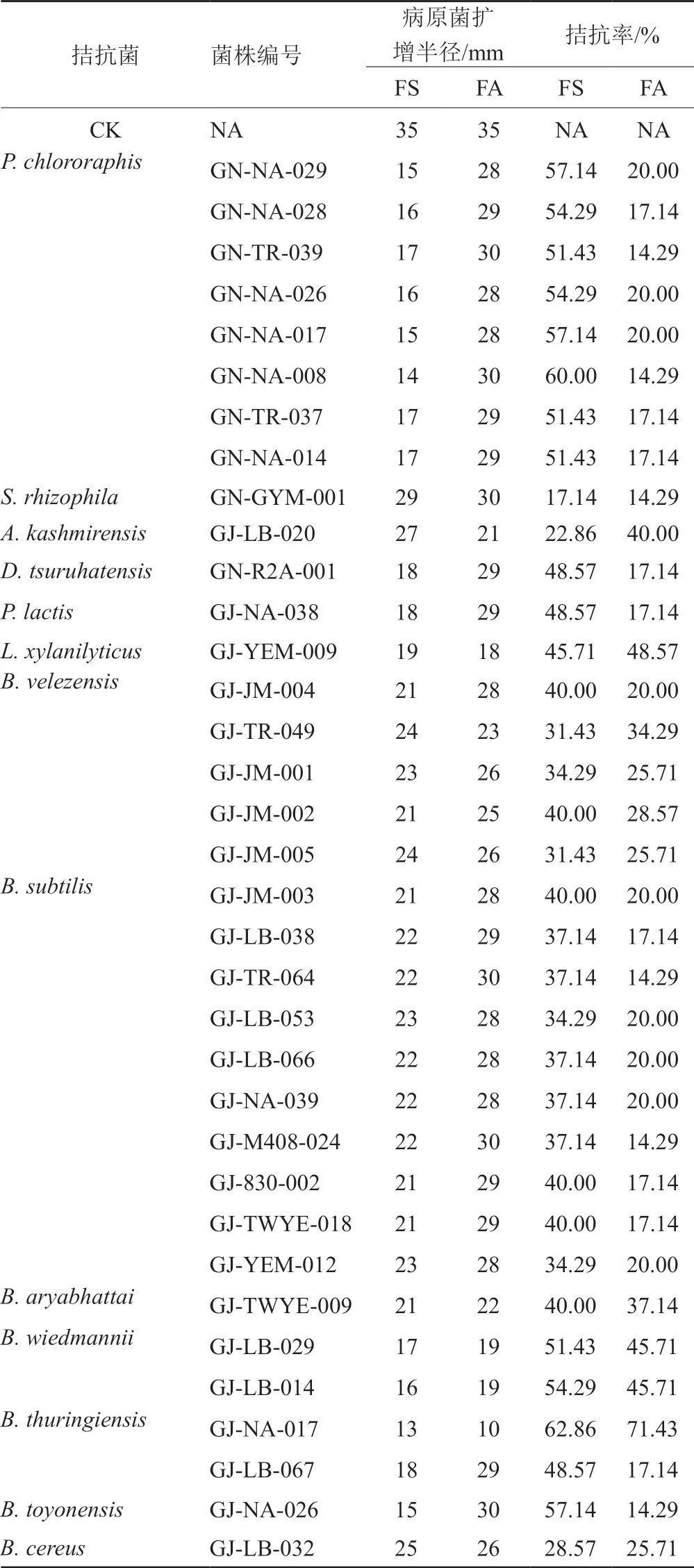
表2 拮抗細菌匯總表Tab.2 Summary of antagonistic bacteria
3.4 離體根上4株芽胞桿菌與2種病原菌的拮抗情況
如圖10所示,在離體黃連根系上,4株芽胞桿菌屬細菌與2種病原菌均具有一定的拮抗活性。4株芽胞桿菌屬細菌能在一定程度上抑制2種病原菌在黃連離體根上的菌絲蔓延。
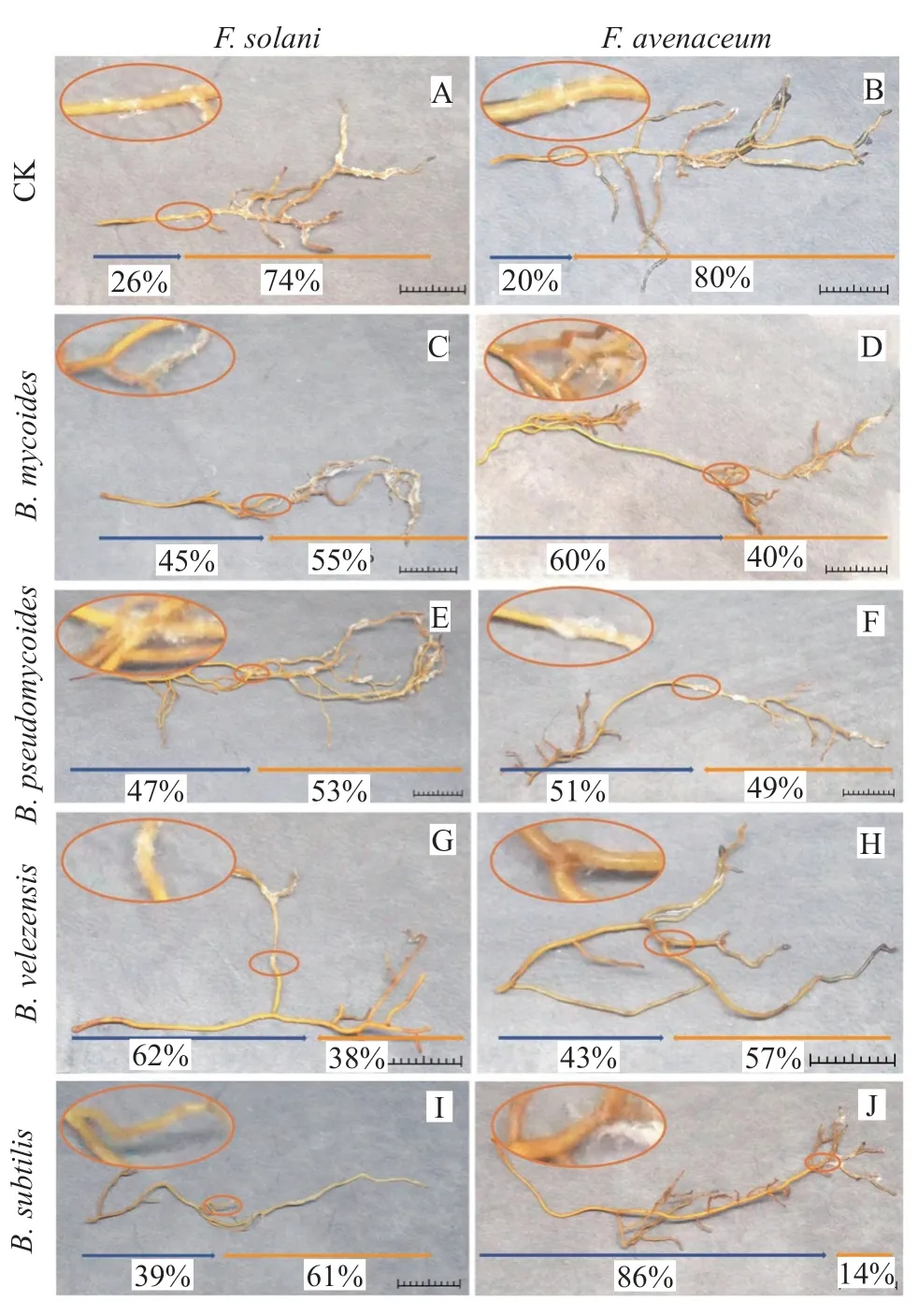
圖10 離體根上4株芽胞桿菌與2種病原菌的拮抗情況Fig.10 Antagonism of 4 Bacillus strains against 2 pathogens on in detached roots
4 討論
根據擴增子分析結果發現感病黃連根內腐生型(saprotroph)真菌顯著高于健康黃連根內,感病黃連根內動物病原菌(animal pathogen)、土壤腐生菌(soil saprotroph)、植物腐生菌(plant saprotroph)、木質腐生菌(wood saprotroph)顯著高于健康植株根內[8]。感病黃連植株根際植物病原菌(plant pathogen)顯著高于健康黃連植株根際,這些真菌可能是黃連根腐病主要病原菌。相關性分析和指示物種Indicator分析表明黃連根腐病可能是由多種病原菌導致的,其中主要包括Fusarium、Volutella、Exophiala和Cylindrocarpon[8]。但本研究僅分離得到12株病原菌,均屬于鐮刀菌屬真菌,這可能與取樣和分離條件有關,需要進一步的研究。
續表2
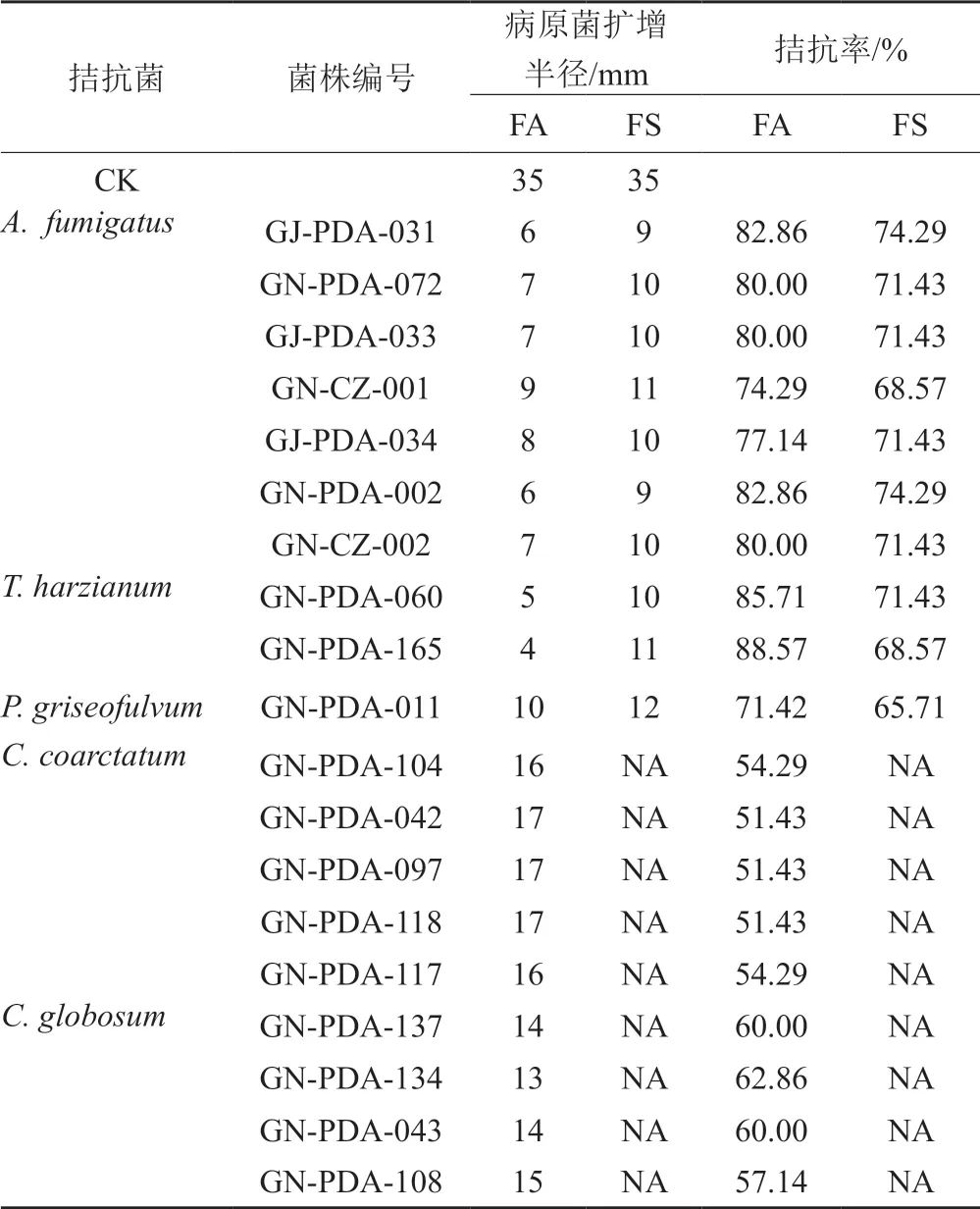
表3 拮抗真菌匯總表Tab.3 Summary of antagonistic fungi
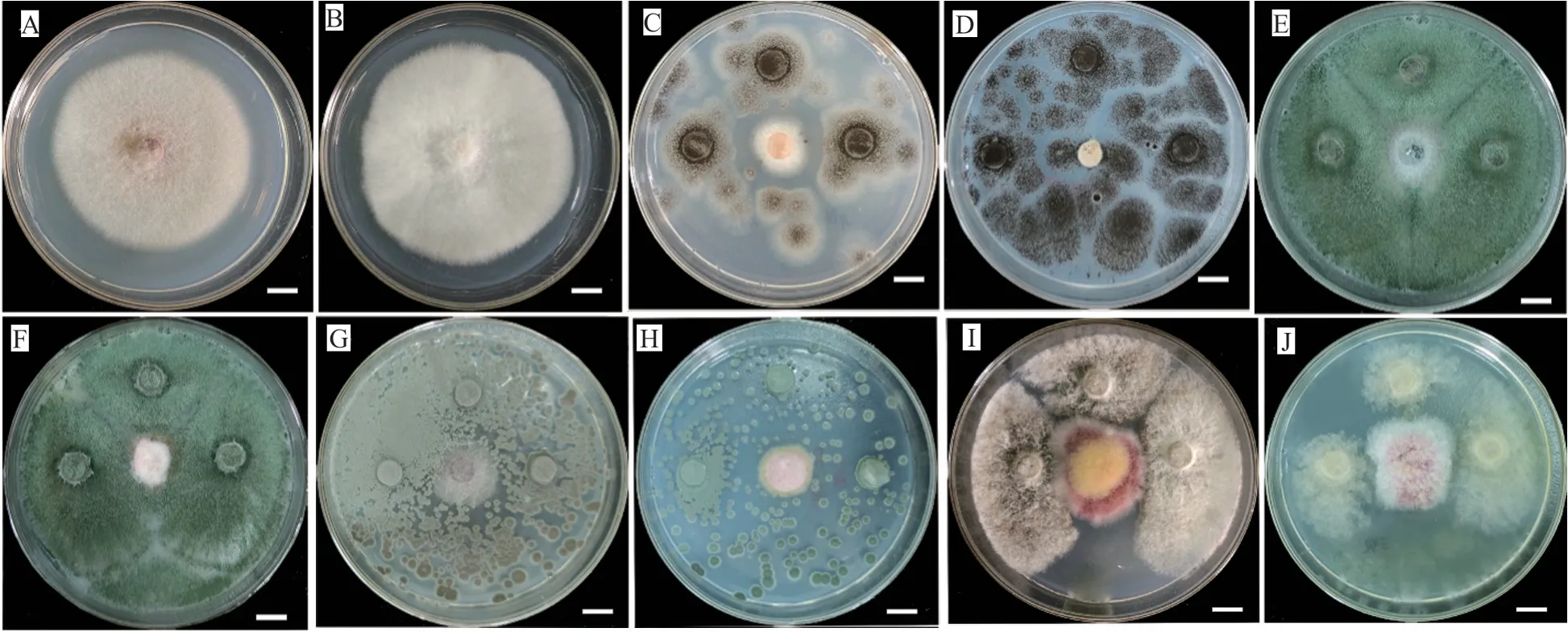
圖6 拮抗真菌與病原菌的平板拮抗活性Fig.6 The antagonistic activities of four representative antagonistic fungi and pathogens
擴增子測序分析發現黃連根際根內具有豐富多樣的微生物,微生物網絡分析表明,黃連根系存在的大量微生物與黃連根腐病病原菌鐮刀菌屬細菌具有拮抗作用。本實驗采用多種培養基對黃連根際根內微生物進行分離培養,最終獲得427株根際菌,345株根內菌,其中包括358株根際細菌,170株根內細菌,69株根際真菌,175株根內真菌。經過平板拮抗實驗共獲得77株拮抗菌,其中拮抗細菌58株,拮抗真菌19株。細菌主要分布于芽胞桿菌屬(Bacillus)、假單胞菌(Pseudomonas)和寡養單胞菌屬(Stenotrophomonas)等。真菌主要分布于蟲草菌屬(Cordyceps)、曲霉菌屬(Aspergillus)、毛殼菌屬(Chaetomium)、間座殼屬(Diaporthe)、木霉菌屬(Trichoderma)、青霉屬(Penicillium)和炭疽菌屬(Colletotrichum)。
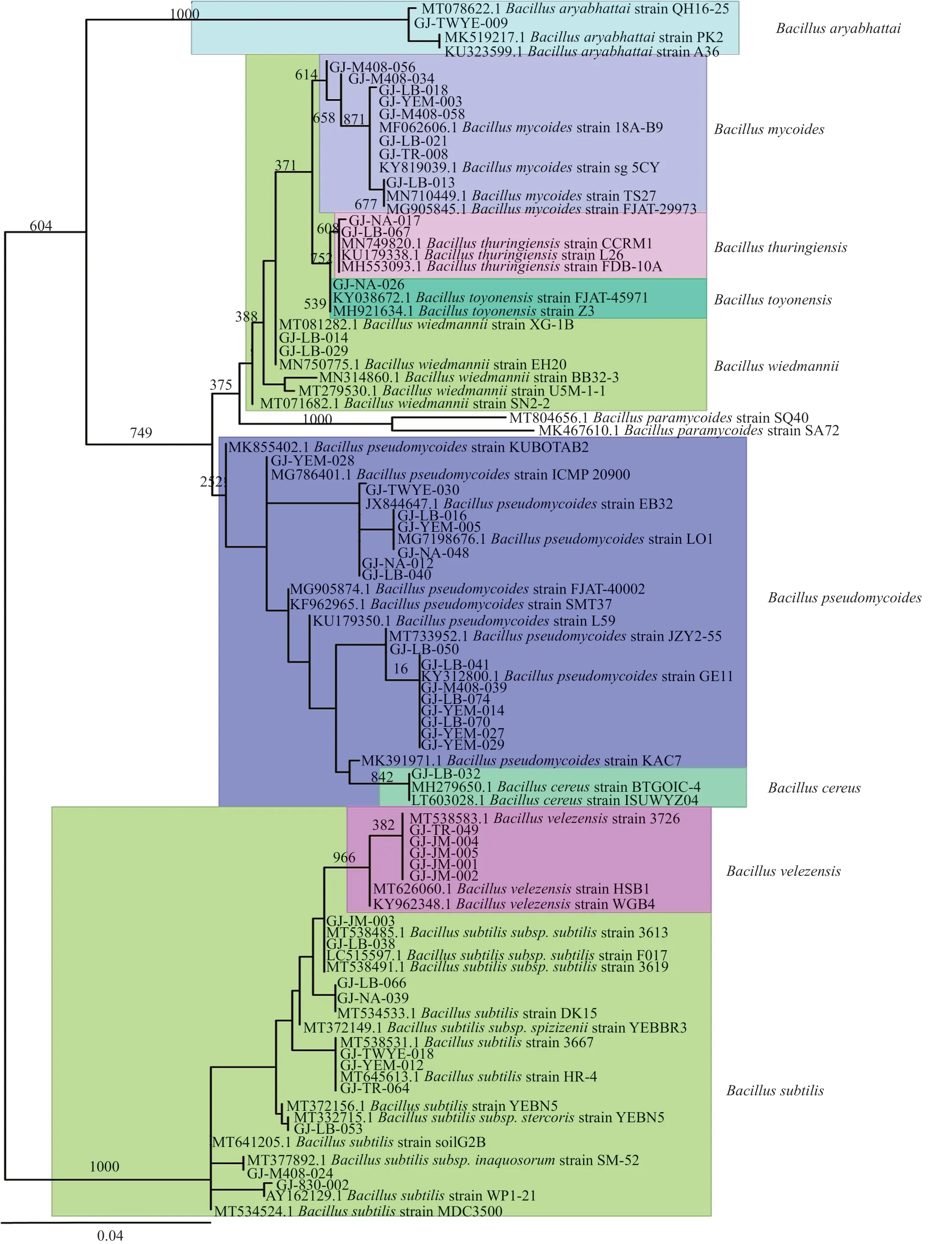
圖8 拮抗細菌系統發育樹(芽胞桿菌屬)Fig.8 Phylogenetic tree of antagonistic bacteria(Bacillus Sp.)
據文獻報道,芽胞桿菌屬細菌,包括多種從本草中分離得到的B.s u b t i l i s[20-21]、B.p s e u d o m y c o i d e s[22]、B.m y c o i d e s[23]、B.ν e l e z e n s i s[24-25]、B.w i e d m a n n i i[26]、B.thuringiensis[27-28]、B.toyonensis[29-30]、B.cereus[31]、B.aryabhattai[29,32-33]等細菌對多種植物病蟲害具有防治作用,對宿主還有一定的促生作用。氯仿假單胞菌(P.chlorographis)能產生廣譜的抗真菌因子(AFFs),包括疏水化合物吩嗪-1-甲酰胺(PCN)、氰化氫、幾丁質酶和蛋白酶,被用作番茄根腐病病原菌Fusarium oxysporumf.sp.radicis-lycopersici的生物防治劑[34]。增加假單胞菌的多樣性,通過加劇資源競爭和對病原菌的干擾,能夠顯著提高假單胞菌對病原菌的抑制作用,降低宿主發病率[35]。S.rhizophila對植物病原性真菌例如黃萎病菌(Erticillium dahliae),茄子根瘤菌(Rhizoctonia solani),菌核盤菌(Sclerotinia sclerotiorum)和人致病性真菌白念珠菌(Candida albicans)具有拮抗活性[36]。
毛殼菌(Chaetomium)被報道為一種廣譜生物殺菌劑,用于防治枯萎病等植物病害[37]。C.globosum能夠產生chaetoviridins A和B,chaetoviridins A處理可抑制稻瘟病和小麥葉銹病的發生超過80%[38]。從馬鈴薯干腐病罹病薯塊上分離得到的Acrostalagmus luteo-albus對馬鈴薯塊沒有致病性,對硫色鐮刀菌(F.sulphureum)、草莓鮮殼孢(Zythia fragariae)、西瓜殼二孢(Ascochyta citrullina)、立枯絲核菌(Rhizoctonia solani)、茄鏈格孢(Alternaria solani)、嗜果刀孢(Clasterosporium carpophilum)及蕓薹生鏈格孢(A.brassicicola)有明顯的抑菌或溶菌作用[39]。A.νersicolor[40]、T.harzianum[41-42]具有一定的抗真菌活性,木霉菌屬(Trichoderma)[43]可以通過產生抗生素、調節茉莉酸/水楊酸(SA)相關的防御途徑和形成生物膜來保護植物。這些真菌可以作為黃連或者其他植物鐮刀菌病害防治的候選菌株。
但是A.fumigatus[44]被報道能不同程度地引起植物發生病變。而在本實驗的平板對峙實驗中表明A.fumigatus對F.solani和F.aνenaceum具有一定的抑制作用,本文推測可能是能源物質和生態位競爭促使A.fumigatus對黃連根腐病致病菌產生一定的拮抗作用。以上拮抗菌篩選結果僅為初步定性和文獻推測結果,其拮抗機制和實際應用有待進一步研究。
在黃連根腐病拮抗初篩平板拮抗實驗中,多種因素可能會導致假陽性,課題組選擇其中4株在離體根和平板上均具有較強拮抗活性的芽胞桿菌[BCA,B.νelezensisGJ-JM-1,B.subtilisGJTR-064,B.mycoidesGJ-LB-021,B.pseudomycoidesGJ-YEM-005]。于大田環境下,采用人工接種F.solaniCC-JING-1誘導黃連根腐病發生,提前7 d接種或接種Fs后在接種4株芽胞桿菌的混合菌液,評價BCA對黃連根腐病的預防和作用。結果發現BCA對黃連根腐病具有一定的防治作用。后期課題組將對4株芽胞桿菌對黃連根腐病的防治作用進行進一步的評價及應用研究。

