霍山石斛活性成分對肝臟疾病作用及其機制研究進展
鄧光輝,俞年軍, 3, 4*,王妍妍*,葉夢娟,蔡 肖,張曉倩,彭代銀, 3, 4
霍山石斛活性成分對肝臟疾病作用及其機制研究進展
鄧光輝1, 2,俞年軍1, 2, 3, 4*,王妍妍1, 2*,葉夢娟1, 2,蔡 肖1, 2,張曉倩1, 2,彭代銀1, 2, 3, 4
1. 安徽中醫藥大學,安徽 合肥 230012 2. 安徽省中醫藥科學院 中藥資源保護與開發研究所,安徽 合肥 230012 3. 省部共建安徽道地中藥材品質提升協同創新中心,安徽 合肥 230012 4. 中藥研究與開發安徽省重點實驗室,安徽 合肥 230012
霍山石斛是我國的珍貴中藥材,大量藥理實驗闡明霍山石斛在治療肝臟疾病方面有顯著療效,從調節抗氧化水平、抑制炎癥、抑制轉化生長因子-β1和I、III膠原蛋白合成、減少肝臟脂質沉積等方面對肝臟疾病產生治療作用。對霍山石斛化學成分和霍山石斛活性成分治療肝臟疾病,如酒精性肝損傷、非酒精性肝損傷、化學性肝損傷、藥物性肝損傷、肝纖維化的藥理作用及其機制進行綜述,為霍山石斛的資源利用和肝臟疾病的新藥開發提供一定的理論基礎。
霍山石斛;活性成分;保肝;肝臟疾病;抗氧化;抑制炎癥
肝臟疾病是指發生在肝臟的病變,包括酒精性肝病(alcoholic liver disease,ALD)、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)、肝纖維化、肝硬化、肝癌等,正逐漸成為嚴重危害人類健康的疾病[1]。肝臟疾病的發病率和死亡率逐年上升,然而目前臨床上用于治療肝臟疾病的藥物表現出較差的療效和耐受性。患者通常需要長期服藥或長時間住院,這可能造成巨大的經濟負擔。除此之外,長期服藥可能會導致嚴重的不良反應,如肝毒性和腎毒性[2]。因此,開發更安全、更有效的肝臟疾病治療藥物已經迫在眉睫。
霍山石斛C. Z. Tang et S. J. Cheng,俗稱“米斛”,是蘭科石斛屬多年生的藥用草本植物,其莖是主要的藥用部位[3-5],具有生津養胃、明目護肝、緩解咽喉炎癥等功效[6-8]。現代藥理學研究發現,霍山石斛中含有多糖、生物堿、黃酮和各種微量元素[9-11],霍山石斛具有保護肝臟、抗氧化、調血脂、降血糖、抗炎及增強腸道生理屏障等多種功能活性[12-17],在預防和治療肝臟疾病具有廣闊的潛在應用價值,受到了人們的廣泛關注。
霍山石斛是很好的抗炎劑、抗氧化劑,有顯著的肝保護作用,是開發成保肝藥品的一個很好的選擇。目前,尚未見有關霍山石斛對肝臟疾病作用的系統性總結,本文結合國內外報道,首先對霍山石斛化學成分進行報道,其次從ALD、NAFLD、化學性肝損傷、藥物性肝損傷、肝纖維化等方面闡述了霍山石斛對肝臟疾病的抑制作用,為霍山石斛的開發利用和臨床應用提供理論指導。
1 霍山石斛活性成分研究進展
1.1 多糖
多糖是由10個或以上單糖通過糖苷鍵縮合而成的長鏈聚合碳水化合物,是霍山石斛中及其重要的活性物質,其化學結構與藥理活性密切相關,是霍山石斛質量評價的重要指標。《中國藥典》2020年版記載以無水葡萄糖計不得少于17.0%。霍山石斛中分離出的8種多糖[18-25],對肝臟疾病均有保護作用,已報道的多糖結構信息見表1。
表1 霍山石斛多糖的結構信息
Table 1 Structure information of D. huoshanense polysaccharides
名稱相對分子質量單糖組成文獻 DHP-4A2.35×105Glc-Man-Ara-Rha 13.8∶6.1∶3.0∶2.119 DHP-1A6.70×103Man-Glc-Gal 2.5∶1.6∶1.020 DHPD13.20×103Gal-Glc-Ara 0.021∶0.1023∶0.02321 DHPD28.09×106Gal-Glc-Ara 0.896∶0.723∶0.222 DHP-W27.30×104Glc-Xyl-Gal 1.0∶1.0∶0.523 HPS-1B232.20×104Glc-Man-Gal 31∶10∶824 Fraction B1.00×104Man-Glc 10∶125 GXG1.78×106Xyl-Gal-Glc 2.13∶1.00∶2.8526
Glc-葡萄糖 Man-甘露糖 Ara-阿拉伯糖 Rha-鼠李糖 Gal-半乳糖 Xyl-木糖
Glc-glucose Man-mannose Ara-arabinose Rha-rhamnose Gal-galactosamine Xyl-xylose
1.2 黃酮類
黃酮類化合物的特點是2個苯環通過3個碳原子相互連接而成的一類化合物。目前從霍山石斛中已分離鑒定了44個黃酮類化合物,對肝臟疾病具有保護作用的共有16種(1~16)見表2,化學結構見圖1[26-34]。
1.3 聯芐類
到目前為止,在霍山石斛中分離和鑒定出的聯芐類化合物共有23個,對肝臟疾病有減緩作用的共有7個(17~23)見表3,化學結構見圖2[7,27-28,32-33,35-40]。
1.4 其他類
菲類和生物堿類化合物是霍山石斛活性成分之一,但僅有少量文獻對其進行報道。在霍山石斛中鑒定出菲類化合物共有7個[28,33],鑒定出6個生物堿成分[33],但未見其活性成分對肝臟疾病的有關報道。除此之外,研究者發現霍山石斛中存在中少量微量元素,包括Zn、Cu、Fe、Mn等14種[9]。
2 霍山石斛在肝臟疾病防治中的應用
肝臟作為代謝多種外源性物質的主要場所,其暴露在各種有毒化學物質、藥物、輻射和酒精等環境下可能會導致肝損傷。霍山石斛抗肝損傷作用主要與其強大的抗氧化、抗炎和抗凋亡作用有關。
2.1 ALD
ALD是嚴重危害人類健康的疾病,發病率逐年增加,發病的主要原因是由于長期或大量飲酒,人體攝入的乙醇在肝臟代謝的過程中造成肝損傷,ALD類型眾多,臨床上根據病情的嚴重程度可將其分為輕癥酒精性肝病、酒精性脂肪肝病、酒精性肝炎、酒精性肝纖維化、酒精性肝硬化5種類型,ALD的發病機制卻是十分復雜,到目前為止,仍然沒有研究出有針對性的藥物。
表2 霍山石斛中的黃酮類化合物
Table 2 Flavonoids in D. huoshanense
序號化合物名稱文獻 1淫羊藿苷(apigenin-6-C-β-D-glucoside-8-C-β-D-xyloside)27 2牡荊素-2-O-鼠李糖苷(vitexin-2″-O-rhamnoside)27 3異鼠李素-3-O-β-D-半乳糖苷(isorhamnetin-3-O-β-D-galactoside)27 4異鼠李素-3-O-β-D-吡喃葡萄糖苷(isorhamnetin-3-O-β-D-glucopyranoside)27 5槲皮素-3-O-β-D-吡喃葡萄糖苷(quercetin-3-O-β-D-glucopyranoside)27 6異牡荊苷(isovitexin-2″-O-rhamnoside)27 7新西蘭牡荊苷II(vicenin-2)27 8柚皮素(naringenin)28 9夏佛塔苷(schaftoside)30 10異夏佛塔苷(isoschaftoside)30 11槲皮素-3-O-阿拉伯糖苷(quercetin-3-O-arabinoside)31 12槲皮素-3-O-葡萄糖苷(quercetin-3-O-glucoside)31 13橙皮素(hesperetin)32 14蘆丁(rutin)28 15柚皮素(naringin)27 16黃芩苷(baicalin)34
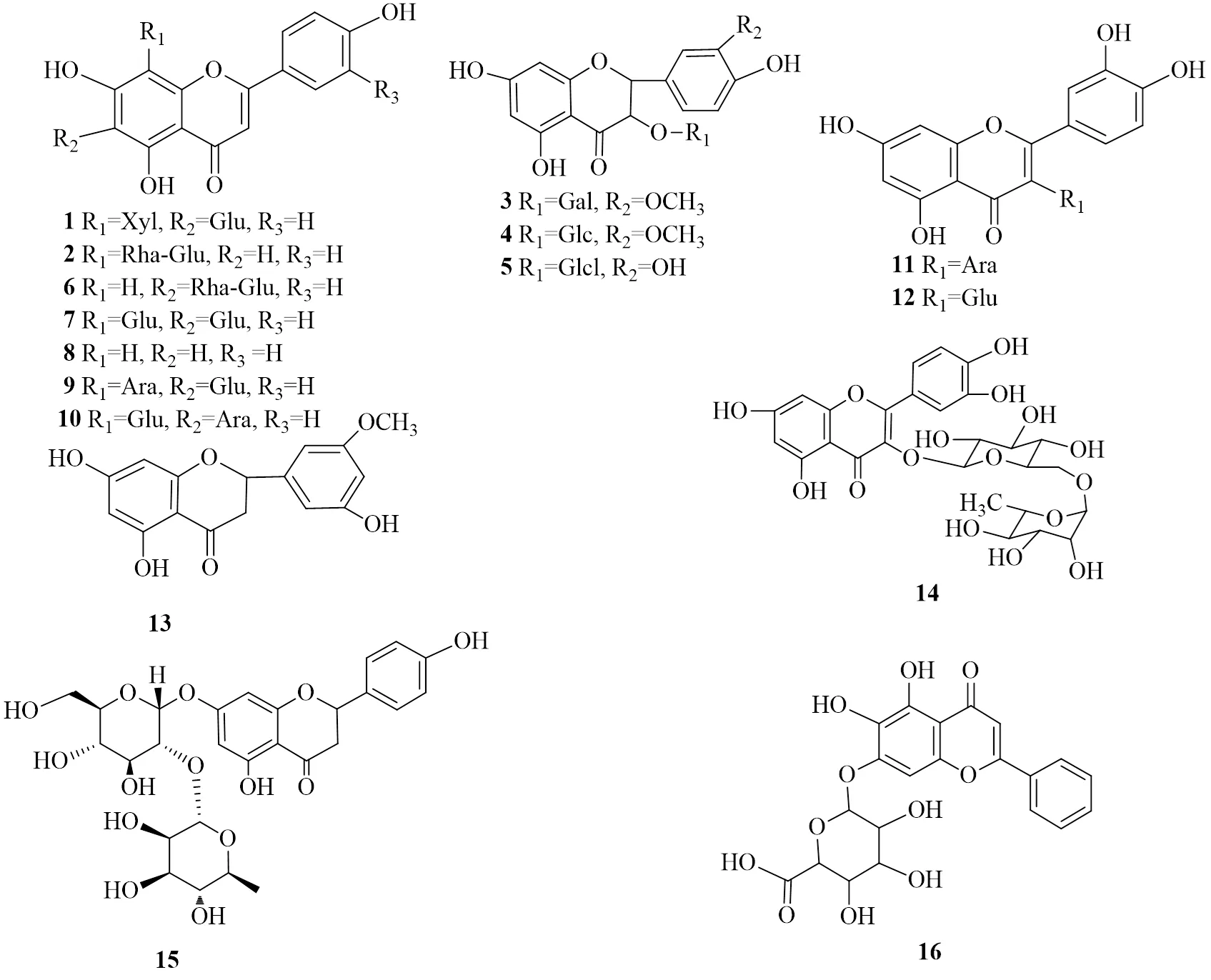
圖1 霍山石斛中黃酮的化學結構
表3 霍山石斛中的聯芐類化合物
Table 3 Bibenzyl compounds in D. huoshanense
序號化合物名稱文獻 17氧化白藜蘆醇(oxyresveratrol)36 184′,5-二羥基-3′,3-二甲氧基聯芐(gigantol)29 193-羥基-5,4′-二甲氧基聯芐(3-hydroxy-5,4′-dimethoxybibenzyl)7 20鐵皮石斛素B(dendrosinen B)40 21moscatilin39 22毛蘭素(erianin)34 23鼓槌菲chrysotobibenzyl34
孟海濤和聶春艷等[41-42]等發現,在30%乙醇(10 mL/kg)誘導的ALD模型中,霍山石斛水提粗多糖組能夠顯著降低氧化應激指標,如谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)等,增強肝組織谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、乙醛脫氫酶(acetaldehyde dehydrogenase,ALDH)、乙醇脫氫酶(alcohol dehydrogenase,ADH)活性,從而減輕乙醇誘導ALD引起的氧化應激損傷。王曉玉[43]闡明DHP-W2能夠降低血清中的谷草轉氨酶(aspartate aminotransferase,AST)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、總膽固醇(total cholesterol,TC)、總膽紅素(total bilirubin,TBIL)水平,減緩肝細胞損傷。除此之外,通過肝臟蛋白質組學分析研究結果表明,胱硫醚β合成酶和乳酸脫氫酶D是受DHP-W2干預的2個關鍵蛋白,有助于糾正肝臟蛋氨酸代謝途徑的異常,降低由代謝途徑紊亂產生的肝臟甲基乙二醛含量,研究證明改善肝臟蛋氨酸代謝途徑可能是DHP-W2抗ALD的細胞機制之一[44]。Wang等[45]研究發現DHP-W2可以改善因乙醇造成的代謝紊亂,特別是涉及膽堿磷酸和-脯氨酸的代謝,從而減緩ALD。李勝立等[46]研究發現霍山石斛多糖ig能增加ALD小鼠肝組織超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)、GSH-Px、谷胱甘肽還原酶(glutathione reductase,GR)、谷胱甘肽巰基轉移酶(glutathione S-transferase,GST)等抗氧化酶的活性和非酶抗氧化物GSH的含量,能夠抑制小鼠肝組織細胞色素P450 2E1(cytochrome P450 2E1,)、肝組織白細胞介素-1β(interleukin-1β,)、腫瘤壞死因子-α(tumor necrosis factor-α,)等mRNA的表達,減少脂質過氧化,抑制氧化應激的產生。王鳳華等[47]研究發現霍山石斛水提取物可降低酒精對肝細胞的損傷作用,其作用機制可能是通過介導核因子-κB(nuclear factor kappa-B,NF-κB)和絲裂原激活蛋白激酶p38(mitogen-activated protein kinase p38,p38MAPK)發揮抗炎作用改善炎癥代謝實現的。楊秀容[48]研究發現,霍山石斛花提取物具有抗ALD作用,其發揮保肝作用的物質可能是從霍山石斛花分離出的異鼠李素-3β半乳糖苷、異鼠李素- 3β吡喃葡萄糖苷、槲皮素-3β吡喃葡萄糖苷,作用機制是通過激活核因子E2-相關因子-2(nuclear factor E2-related factor-2,Nrf2)從而抑制NF-κB通路的激活發揮抗炎活性,進而抑制乙醇誘導的肝細胞凋亡。綜上所述,霍山石斛通過抑制氧化應激、改善肝臟蛋氨酸代謝途徑、改善因乙醇造成的代謝紊亂、減輕脂質過氧化損傷和減少炎癥介質,抑制炎癥反應減輕ALD。霍山石斛及其活性成分抗ALD的作用見表4。
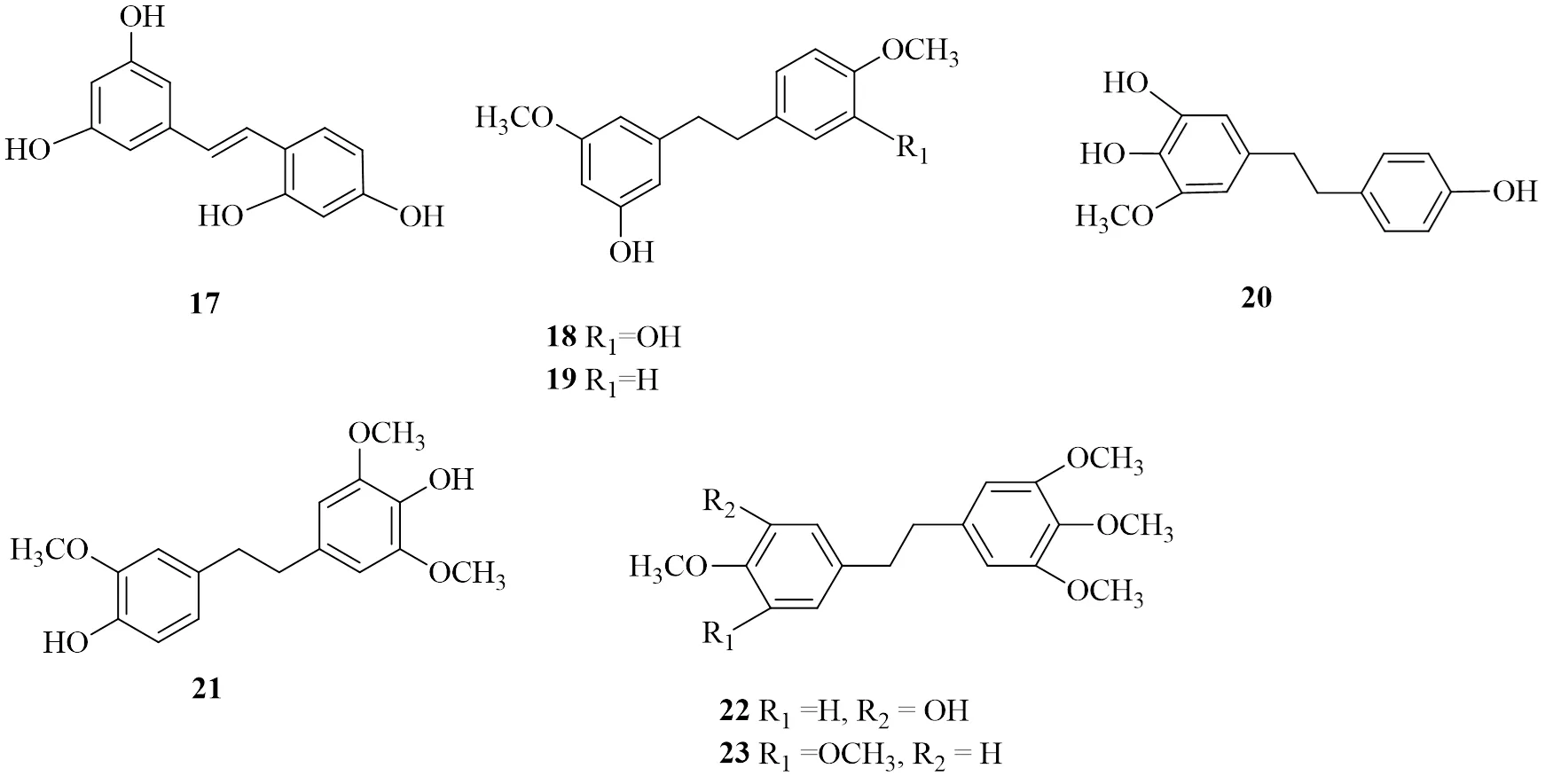
圖2 霍山石斛中聯芐的化學結構
表4 霍山石斛及其活性成分抗ALD的作用
Table 4 Anti ALD effects of D. huoshanense and its active components
動物/細胞模型霍山石斛活性成分作用方式文獻 SPF小鼠水提粗多糖GSH↓、MDA↓、GSH-Px↑、ALDH↑、ADH↑41、42 雄性SPF小鼠均一多糖AST↓、LDL-C↓、TC↓、TBIL↓、調節蛋氨酸代謝途徑43、44 雄性SPF小鼠均一多糖改善因乙醇造成的代謝紊亂45 雄性SPF小鼠水提粗多糖SOD↑、CAT↑、GSH-Px-↑、GR↑、GST↑、GSH↑、IL-1 β↓、TNF-α↓、CYP2E1↓46 雄性SPF小鼠水提液調節NF-κB和p38MAPK發揮抗炎47 L02肝細胞霍山石斛花提取物調節NF-κB發揮抗炎48
↓表示下降,↑表示上升,下同
↓means decreasing,↑means increasing,same as below
2.2 NAFLD
NAFLD是世界范圍內最常見的慢性肝病,近年來,有學者提出新術語——代謝相關脂肪性肝病(metabolic associated fatty liver disease,MAFLD),著重強調其在胰島素抵抗、肥胖和糖尿病的重要病因學作用[49]。根據流行病學統計和分析,發現全球NAFLD的患病率約為25%,而且呈持續增長趨勢[50]。到2030年,中國NAFLD患者總數預計將超過3億,成為全球NAFLD患病率增長最快的國家[51]。但目前尚無批準用于NAFLD臨床治療的藥物。霍山石斛具有顯著的抗炎和抗氧化作用,在治療NAFLD方面具有廣闊應用前景。
霍山石斛對NAFLD有干預、治療作用。姜蘇薇[52]連續8周給予高脂飼料誘導NAFLD模型,研究發現小鼠血清中TC、三酰甘油(triglyceride,TG)、谷丙轉氨酶(alanine aminotransferase,ALT)、AST顯著下降。高脂模型組中的MDA、過氧化氫(hydrogen peroxide,H2O2)含量顯著增加,GSH含量、SOD和CAT活性降低,霍山石斛多糖組的肝組織損傷標志物顯著減少,小鼠體內過氧化氫酶的活性顯著增加,小鼠體內GSH濃度增加。霍山石斛多糖可以通過提高體內抗氧化應激功效,恢復因氧化應激誘導的肝組織損傷標志物,使血清脂質的過度積累恢復正常,從而抑制肝臟脂質沉積。
2.3 化學性肝損傷
霍山石斛多糖對四氯化碳(CCl4)、亞硒酸鈉(Na2SeO3)等化學物質誘導的肝損傷具有保護作用[53]。在CCl41.5 mL/(kg·d)誘導的化學性肝損傷模型中,霍山石斛精制多糖能降低小鼠血清中ALT、AST活性,降低肝勻漿中MDA含量,增強SOD的活性,抑制肝細胞中促炎性細胞因子表達,提高機體抗氧化能力,對CCl4誘導的肝損傷具有顯著保護作用[54]。王凱等[55]研究發現霍山石斛能夠降低CCl4致小鼠化學性肝損傷肝組織中、和的mRNA表達,表明霍山石斛可以通過抑制促炎性細胞因子的表達來預防化學性肝損傷。田長城等[56]發現從霍山石斛圓球莖中分離出的DHP1多糖組分對CCl4所致的肝損傷有保護作用,DHP1能顯著降低MDA的產生,恢復肝臟中SOD、CAT和GPX活性以及GSH含量。霍山石斛多糖(DHP1A)能顯著降低小鼠血清中ALT、AST、LDH和8-羥基-2′-脫氧鳥苷的水平,闡明DHP1A具有保肝作用。除此之外,DHP1A能顯著降低炎癥細胞因子、促炎趨化因子、CD68和磷酸化NF-κB抑制蛋白激酶α(phosphonated inhibitor of nuclear factor kappa B,p-IκBα)的表達來抑制CCl4所致的炎癥反應,表明DHP1A的肝保護作用可能是調節炎癥應答[19]。從霍山石斛粗多糖中分離出來的主要活性成分半乳葡甘露聚糖(GGM)可減弱亞硒酸鈉對肝組織的細胞毒性,降低H2O2和MDA的含量,提高GSH含量,恢復肝細胞質膜的流動性,提高SOD、CAT和GST的活性,減緩亞硒酸鈉引起的大鼠肝損傷[23,57]。
綜上,霍山石斛通過抑制促炎細胞因子表達、提高抗氧化能力和抑制p-IκBα的表達從而減緩化學性肝損傷。霍山石斛及其活性成分抗化學性肝損傷的作用見表5。
表5 霍山石斛及其活性成分抗化學性肝損傷的作用
Table 5 Anti-chemical liver injury effects of D. huoshanense and its active components
動物/細胞模型霍山石斛活性成分作用方式文獻 雄性SPF小鼠精制多糖ALT↓、AST↓、MDA↓、SOD↑54 C57BL/6雄性小鼠榨汁液IL-1β↓、IL-6↓、TNF-α↓55 雄性SPF小鼠均一多糖MDA↓、SOD↑、CAT↑、GPX↑、LDH↓、GSH↑、CD68↓、p-IκBα↓56 SD雄性大鼠均一多糖MDA↓、H2O2 ↓、GSH↑、SOD↑、CAT↑、GST↑57
2.4 藥物性肝損傷
霍山石斛對化療藥物環磷酰胺(cyclophosphamide,CTX)、乙酰氨基酚(acetaminophen,APAP)等藥物所致的肝損傷具有保護作用。
李志強等[58]研究證實,與模型組相比,霍山石斛給藥組能顯著降低APAP所造成的急性肝損傷小鼠血清中的ALT、AST含量,升高肝組織中SOD活性并降低MDA水平,抑制APAP造成的小鼠肝臟氧化應激。劉偉[59]利用霍山石斛水提物探討其對CTX誘導的藥物性肝損傷作用,發現霍山石斛水提液能顯著降低小鼠血清中ALT與AST的水平,增強小鼠肝臟SOD的表達,抑制小鼠肝組織中MDA含量的升高,提高抗氧化防御能力,從而改善CTX引起的肝損傷。
2.5 肝纖維化
肝纖維化是一種炎癥性疾病,肝星狀細胞(hepatic stellate cell,HSC)的激活和細胞外基質(extracellular matrix,ECM)成分的過度沉積是導致其發展的2個主要過程[60-62]。研究發現肝纖維化治療的關鍵點是HCSs的失活和凋亡和ECM的降解[63-64]。
陸俊[65]研究發現霍山石斛多糖可以有效阻止肝臟內轉化生長因子-β1(transforming growth factor-β1,TGF-β1)表達,TGF-β1是肝纖維化發展過程中的關鍵因子,TGF-β1刺激ECM蛋白合成并抑制它們的降解的作用,減少肝ECM蛋白(I、III型膠原蛋白)在肝臟內積累,進而阻止肝纖維化的形成。Pan等[57]研究表明在亞硒酸鈉誘導的小鼠肝纖維化模型中,經GGM(50~200 mg/kg)ig后,GGM可以抑制TGF-β1和I型膠原蛋白的過度表達,防止膠原蛋白過度沉積從而發生交聯現象,GGM對亞硒酸鈉誘導的肝纖維化有預防作用,可能發展成為一種新型的抗肝纖維化藥物,為治療肝纖維化提供新的思路。
3 結語
通過藥理試驗證明,霍山石斛對ALD、NAFLD、藥物性肝損傷、化學性肝損傷、肝纖維化等肝臟疾病都有良好的治療和預防作用,見圖3。霍山石斛對肝臟疾病的作用機制主要為調節抗氧化能力、減少炎癥因子,抑制炎癥反應、調控Nrf2通路、減少肝臟脂質沉積、抑制TGF-β1和I、III型膠原蛋白合成等。針對各種肝臟疾病,霍山石斛的作用機制不盡相同,但均可產生顯著的療效,證明霍山石斛在肝臟疾病方面具有廣闊的應用前景。
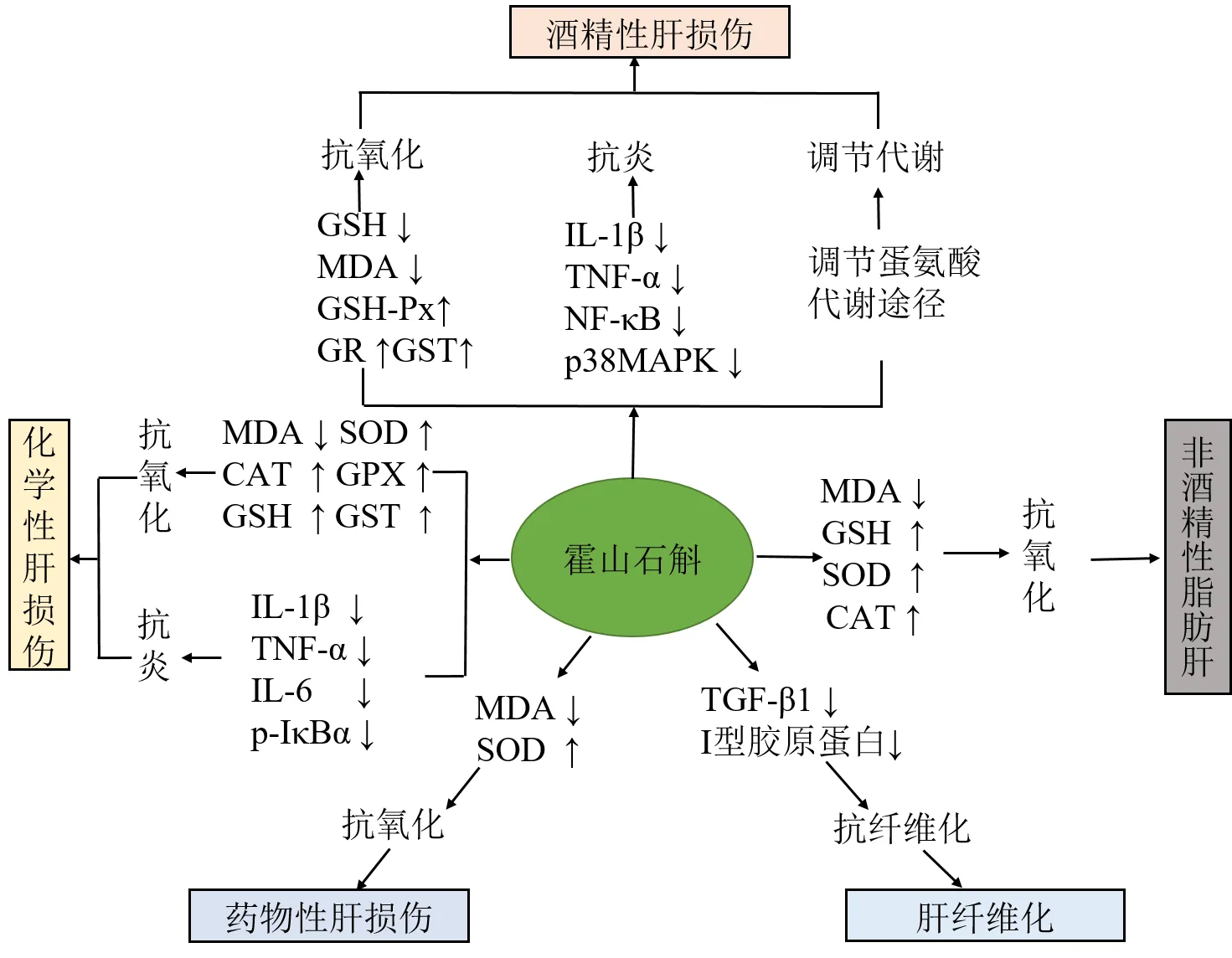
圖3 霍山石斛治療肝臟疾病的藥理作用及機制
目前為止,未見有從基因組學解釋霍山石斛治療肝臟疾病的可能機制和霍山石斛對肝癌是否有作用的報道,而已有金釵石斛破壁粉能抑制裸鼠HepG2移植瘤的生長和通過轉錄組測序技術研究金釵石斛對CCl4所致小鼠肝損傷的保護作用的報道[66-68]。因此有必要加強霍山石斛在肝臟疾病基因組學和肝癌的研究,這將有利于認識到霍山石斛對肝臟疾病的作用機制和作用靶點,為保肝藥物的開發提供合理依據。除此之外,多糖作為霍山石斛主要活性物質在治療肝臟疾病方面受到了廣泛的關注和證實,但是多糖結構解析是解釋霍山石斛多糖對肝臟疾病作用機制的最大瓶頸之一。首先,純多糖不易獲得,霍山石斛多糖的提取方法和純化方法選擇比較多,不同的方法獲得的最終產物的組成和結構也往往不同,不管采用何種提取方法,霍山石斛多糖提取效率都很低。其次,多糖結構分析困難,由于單糖組成、糖苷鍵、糖單元排列、聚合度和分支點的差異,導致多糖的結構比蛋白質或核酸大分子的復雜得多。從大多數研究報道來看,目前對霍山石斛多糖的一級結構研究比較多,包括單糖的物質的量比、平均相對分子質量和主要糖苷鍵,霍山石斛多糖的精細結構尚未得到全面的研究,因此,基于現代藥理學中的藥效學理論,無法獲得霍山石斛多糖確切的藥效團,霍山石斛多糖對肝臟疾病的作用機制研究還有很長的路要走。
霍山石斛的保肝作用僅在動物體內的藥效學得到證實,很少有研究涉及到具體途徑的機制,缺乏相關的臨床研究進一步證實其療效。因此,后續還應對霍山石斛進行保肝機制的具體途徑和相關的安全性評價和臨床實驗研究,為闡明霍山石斛多糖對肝臟的藥效物質基礎提供理論依據,為解決多糖藥品質量控制提供思路,為促進霍山石斛的資源利用和產業開發提供科學依據。
利益沖突 所有作者均聲明不存在利益沖突
[1] Liao X, Bu Y, Jia Q G. Traditional Chinese medicine as supportive care for the management of liver cancer: Past, present, and future [J]., 2019, 7(3): 370-379.
[2] Sun D J, Zhu L J, Yao D H,. Recent progress in potential anti-hepatitis B virus agents: Structural and pharmacological perspectives [J]., 2018, 147: 205-217.
[3] 順慶生, 徐一新, 魏剛, 等. 中藥石斛正本清源之霍山石斛 [J]. 廣東藥科大學學報, 2019, 35(1): 22-26.
[4] 劉剛, 俞年軍, 韓榮春, 等. 不同生長年限霍山石斛高效液相指紋圖譜研究 [J]. 中草藥, 2018, 49(6): 1424-1429.
[5] 宋丹, 郭世岳. 石斛及石斛組方防治糖尿病的研究進展 [J]. 中國中醫藥現代遠程教育, 2019, 17(7): 114-117.
[6] Liu B, Shang Z Z, Li Q M,. Structural features and anti-gastric cancer activity of polysaccharides from stem, root, leaf and flower of cultivated[J]., 2020, 143: 651-664.
[7] Li Q M, Jiang H, Zha X Q,. Anti-inflammatory bibenzyls from the stems ofhuoshanense via bioassay guided isolation [J]., 2020, 34(4): 563-566.
[8] Wang H Y, Li Q M, Yu N J,.polysaccharide regulates hepatic glucose homeostasis and pancreatic β-cell function in type 2 diabetic mice [J]., 2019, 211: 39-48.
[9] 童晨曦, 齊蕾. 霍山石斛的研究進展及可持續發展 [J]. 醫學綜述, 2015, 21(24): 4512-4514.
[10] 王超群, 李德文, 袁晨琳, 等. 霍山石斛多糖不同組分理化性質及免疫活性的比較研究 [J]. 安徽農業科學, 2018, 46(13): 160-164.
[11] 王東暉, 范蓓, 孫晶, 等. 石斛屬植物化學成分的研究進展 [J]. 中國食物與營養, 2019, 25(3): 12-18.
[12] Zha X Q, Deng Y Y, Li X L,. The core structure of apolysaccharide required for the inhibition of human lens epithelial cell apoptosis [J]., 2017, 155: 252-260.
[13] Xie S Z, Hao R, Zha X Q,. Polysaccharide ofactivates macrophages via toll-like receptor 4-mediated signaling pathways [J]., 2016, 146: 292-300.
[14] Lin J, Chang Y J, Yang W B,. The multifaceted effects of polysaccharides isolated fromon immune functions with the induction of interleukin-1 receptor antagonist (IL-1ra) in monocytes [J]., 2014, 9(4): e94040.
[15] Xie S Z, Liu B, Ye H Y,.polysaccharide regionally regulates intestinal mucosal barrier function and intestinal microbiota in mice [J]., 2019, 206: 149-162.
[16] Luo J P, Deng Y Y, Zha X Q. Mechanism of polysaccharides fromon streptozotocin-induced diabetic cataract [J]., 2008, 46(4): 243-249.
[17] Pan L H, Li X F, Wang M N,. Comparison of hypoglycemic and antioxidative effects of polysaccharides from four differentspecies [J]., 2014, 64: 420-427.
[18] Li F, Cui S H, Zha X Q,. Structure and bioactivity of a polysaccharide extracted from protocorm-like bodies of[J]., 2015, 72: 664-672.
[19] Tian C C, Zha X Q, Luo J P. A polysaccharide fromprevents hepatic inflammatory response caused by carbon tetrachloride [J]., 2015, 29(1): 132-138.
[20] Qian X P, Zha X Q, Xiao J J,. Sulfated modification can enhance antiglycation abilities of polysaccharides from[J]., 2014, 101: 982-989.
[21] Li X L, Xiao J J, Zha X Q,. Structural identification and sulfated modification of an antiglycationpolysaccharide [J]., 2014, 106: 247-254.
[22] Pan L H, Feng B J, Wang J H,. Structural characterization and anti-glycation activityof a water-soluble polysaccharide from[J]., 2013, 37(3): 313-321.
[23] Zha X Q, Luo J P, Luo S Z,. Structure identification of a new immunostimulating polysaccharide from the stems of[J]., 2007, 69(1): 86-93.
[24] Hsieh Y S Y, Cheng C E, Liao S K S,. Structure and bioactivity of the polysaccharides in medicinal plant[J]., 2008, 16(11): 6054-6068.
[25] Xie S Z, Ge J C, Li F,. Digestive behavior ofpolysaccharides in the gastrointestinal tracts of mice [J]., 2018, 107: 825-832.
[26] Liang Z Y, Zhang J Y, Huang Y C,. Identification of flavonoids inand comparison with those in allied species ofby TLC, HPLC and HPLC coupled with electrospray ionization multi-stage tandem MS analyses [J]., 2019, 42(5): 1088-1104.
[27] Ye Z, Dai J R, Zhang C G,. Chemical differentiation ofandby using HPLC fingerprints, HPLC-ESI-MS, and HPTLC analyses [J]., 2017, 2017: 8647212.
[28] 李榕生, 楊欣, 何平, 等. 鐵皮石斛根莖中菲類化學成分分析 [J]. 中藥材, 2009, 32(2): 220-223.
[29] Wu C, Gui S, Huang Y,. Characteristic fingerprint analysis ofby ultra-high performance liquid chromatography-electrospray ionization-tandem mass spectrometry [J]., 2016, 8(18): 3802-3808.
[30] Aghakhani F, Kharazian N, Lori Gooini Z. Flavonoid constituents of(Lamiaceae) species using liquid chromatography mass spectrometry [J]., 2018, 29(2): 180-195.
[31] 周秀娟, 李燕芳, 陳瑩, 等. 基于UPLC-Q Exactive四級桿-軌道阱液質聯用法快速建立清熱靈顆粒中潛在中藥質量標志物(Q-Marker)成分庫 [J]. 中草藥, 2017, 48(1): 67-74.
[32] 李燕, 王春蘭, 肖培根, 等. 鐵皮石斛化學成分的研究 [J]. 中國中藥雜志, 2010, 35(13): 1715-1719.
[33] 貢小輝. 霍山石斛與霍山產鐵皮石斛化學成分及抗氧化活性初步研究 [D]. 鎮江: 江蘇大學, 2019.
[34] Chang C C, Ku A F, Tseng Y Y,. 6, 8-di--glycosyl flavonoids from[J]., 2010, 73(2): 229-232.
[35] 秦建平, 潘有智, 郎悅, 等. 龍血通絡膠囊中化學成分的RRLC-Q-TOF MS分析 [J]. 藥物分析雜志, 2017, 37(10): 1782-1790.
[36] Fan C, Wang W, Wang Y,. Chemical constituents from[J]., 2001, 57(8): 1255-1258.
[37] 趙宏蘇, 許鳳清, 陳簫簫, 等. 霍山石斛化學成分研究 [J]. 天然產物研究與開發, 2021, 33(9): 1491-1498.
[38] Majumder P L, Sen R C. Moscatilin, a bibenzyl derivative from the orchid[J]., 1987, 26(7): 2121-2124.
[39] Na Ranong S, Likhitwitayawuid K, Mekboonsonglarp W,. New dihydrophenanthrenes from[J]., 2019, 33(3): 420-426.
[40] Yang L, Liu S J, Luo H R,. Two new dendrocandins with neurite outgrowth-promoting activity from[J]., 2015, 17(2): 125-131.
[41] 孟海濤, 汪鶴, 查學強, 等. 霍山石斛不同提取物抗小鼠亞急性酒精性肝損傷活性的比較研究 [J]. 食品科學, 2015, 36(13): 229-234.
[42] 聶春艷, 汪鶴, 潘利華, 等. 霍山石斛水溶性多糖抗亞急性酒精性肝損傷研究 [J]. 安徽農業科學, 2017, 45(17): 100-105.
[43] 王曉玉. 霍山石斛多糖干預小鼠亞急性酒精性肝損傷的蛋白質組學及代謝組學研究 [D]. 合肥: 合肥工業大學, 2014.
[44] Wang X Y, Luo J P, Chen R,. The effects of daily supplementation ofpolysaccharide on ethanol-induced subacute liver injury in mice by proteomic analysis [J]., 2014, 5(9): 2020-2035.
[45] Wang X Y, Luo J P, Chen R,.polysaccharide prevents ethanol-induced liver injury in mice by metabolomic analysis [J]., 2015, 78: 354-362.
[46] 李勝立. 六種石斛多糖對酒精性肝損傷干預作用的比較研究 [D]. 合肥: 合肥工業大學, 2013.
[47] 王鳳華, 韓吉春, 李德芳, 等. 霍山石斛水提取物通過介導NF-κB/p65和p38 MAPK減輕小鼠酒精性肝損傷 [J]. 天然產物研究與開發, 2017, 29(4): 569-574.
[48] 楊秀容. 霍山石斛花抗酒精性肝損傷活性成分篩選及其作用機制研究 [D]. 合肥: 合肥工業大學, 2021.
[49] Eslam M, Sanyal A J, George J,. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease [J]., 2020, 158(7): 1999-2014.e1.
[50] Loomba R, Friedman S L, Shulman G I. Mechanisms and disease consequences of nonalcoholic fatty liver disease [J]., 2021, 184(10): 2537-2564.
[51] 翁建平. 代謝性肝病的定義與分類探討 [J]. 中華醫學雜志, 2020, 100(6): 401-406.
[52] 姜蘇薇. 霍山石斛多糖對非酒精性脂肪性肝損傷的干預及改善作用研究 [D]. 合肥: 合肥工業大學, 2012.
[53] 李志強, 周紅秋, 歐陽臻, 等. 不同種植模式的霍山石斛對小鼠急性肝損傷的保護作用 [J]. 中成藥, 2020, 42(5): 1155-1162.
[54] 黃靜, 李勝立, 趙宏偉, 等. 霍山石斛多糖對四氯化碳致急性肝損傷小鼠的保護作用 [J]. 中國中藥雜志, 2013, 38(4): 528-532.
[55] 王凱, 韓邦興, 魏淵, 等. 5種石斛對四氯化碳致小鼠急性肝損傷的保護作用 [J]. 中國中藥雜志, 2017, 42(10): 1945-1950.
[56] 田長城, 羅建平. 霍山石斛中不同多糖組分的保肝活性 [J]. 食品科學, 2015, 36(7): 162-166.
[57] Pan L H, Lu J, Luo J P,. Preventive effect of a galactoglucomannan (GGM) fromon selenium-induced liver injury and fibrosis in rats [J]., 2012, 64(7/8): 899-904.
[58] 李志強, 周紅秋, 歐陽臻, 等. 不同生長年限霍山石斛的主要成分分析及其對急性肝損傷保護作用的比較研究 [J]. 中國中藥雜志, 2021, 46(2): 298-305.
[59] 劉偉. 三種模式種植的霍山石斛對小鼠肝臟CYP450酶表達的影響及其對肝損傷的保護作用差異的研究 [D]. 鎮江: 江蘇大學, 2019.
[60] Pellicoro A, Ramachandran P, Iredale J P,. Liver fibrosis and repair: Immune regulation of wound healing in a solid organ [J]., 2014, 14(3): 181-194.
[61] Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues [J]., 2019, 65: 37-55.
[62] 趙志敏, 景菲, 呂靖, 等. 病證結合異病同治的中醫藥抗器官纖維化臨床研究思路[J]. 世界中醫藥, 2020, 15(19): 2864-2867.
[63] Kisseleva T, Cong M, Paik Y,. Myofibroblasts revert to an inactive phenotype during regression of liver fibrosis [J]., 2012, 109(24): 9448-9453.
[64] Iredale J P, Thompson A, Henderson N C. Extracellular matrix degradation in liver fibrosis: Biochemistry and regulation [J]., 2013, 1832(7): 876-883.
[65] 陸俊. 霍山石斛多糖干預亞硒酸鈉致大鼠肝損傷和肝纖維化的研究 [D]. 合肥: 合肥工業大學, 2010.
[66] 范艷, 喻涓, 楊榆青, 等. 金釵石斛多糖調控炎性小體NLRP3對非酒精性脂肪肝大鼠的保護作用[J]. 世界中醫藥, 2021, 16(4): 566-570.
[67] 稅璘, 劉明華, 稅丕先, 等. 金釵石斛破壁粉對荷瘤小鼠腫瘤生長及免疫功能的影響 [J]. 中國新藥雜志, 2018, 27(16): 1896-1901.
[68] Zhang Y, Zhou J, Liu J,. RNA-Seq analysis of the protection byalkaloids against carbon tetrachloride hepatotoxicity in mice [J]., 2021, 137(6): 111307.
Research progress on effect and mechanism ofand its active components against liver diseases
DENG Guang-hui1, 2, YU Nian-jun1, 2, 3, 4, WANG Yan-yan1,2, YE Meng-juan1, 2, CAI Xiao1, 2, ZHANG Xiao-qian1, 2, PENG Dai-yin1, 2, 3, 4
1. Anhui University of Chinses Medicine, Hefei 230012, China 2. Institute of Conservation and Development of Traditional Chinese Medicine Resources & Anhui Academy of Traditional Chinese Medicine, Hefei 230012, China 3. MOE-Anhui Joint Collaborative Innovation Center for Quality Improvement of Anhui Genuine Chinese Medicinal Materials, Hefei 230012, China 4. Key Laboratory of Traditional Chinese Medicine Research and Development of Anhui Province, Hefei 230012, China
is a precious traditional Chinese medicinal material in China. A large number of pharmacological experiments have demonstrated thathad significant curative effects in the treatment of liver diseases, from regulating antioxidation levels, inhibiting inflammation, inhibiting transforming growth factor-β1 and I, III collagen, reducing hepatic lipid deposition, and other aspects in the treatment of liver diseases. The article reviews the pharmacological effects and mechanisms of the chemical constituents and active ingredients ofin treating liver diseases, including alcoholic liver disease, non-alcoholic fatty liver disease, chemical liver injury, drug-induced liver injury and liver fibrosis, which could serve to guide drug discovery for liver diseases and resource utilization of.
C. Z. Tang et S. J. Cheng; active components; liver protection; liver diseases; antioxidation; inhibiting inflammation
R284.1
A
0253 - 2670(2022)21 - 6959 - 09
10.7501/j.issn.0253-2670.2022.21.034
2022-06-14
國家自然科學基金聯合基金項目(U19A2009);安徽高校協同創新項目(GXXT-2019-043);省部共建安徽道地中藥材品質提升協同創新中心項目(教科信廳函 [2022]4號);安徽省教育廳項目(皖教秘科[2014]44號)
鄧光輝(1997—),男(漢族),在讀碩士研究生,研究方向為中藥資源與中藥質量。Tel: 17856419316 E-mail: 3111630539@qq.com
俞年軍,教授,研究方向為中藥質量評價。Tel: (0551)68129173 E-mail: ynj2005288@sina.com
王妍妍,教授,研究方向為中藥資源與中藥藥理。Tel: (0551)68129180 E-mail: wangyanyan@ahtcm.edu.cn
[責任編輯 王文倩]

