翼首草鯊烯合酶(PhSQS2)全長克隆、表達特性分析及蛋白功能驗證
王 蕓,吳 宇,蔣慶鋒,何 焱,蘭小中,張 磊, 2*
? 藥材與資源 ?
翼首草鯊烯合酶(PhSQS2)全長克隆、表達特性分析及蛋白功能驗證
王 蕓1,吳 宇2#,蔣慶鋒3,何 焱2, 4,蘭小中4*,張 磊1, 2*
1. 上海大學醫學院生物醫藥創新研發中心,上海 200444 2. 海軍軍醫大學藥學院 藥用植物學教研室,上海 200433 3. 西藏軍區總醫院 醫療保障中心藥劑科,西藏 拉薩 850000 4. 西藏農牧學院 西南大學藥用植物聯合研發中心,西藏 林芝 860000
從匙葉翼首草轉錄組中挖掘參與三萜合成的鯊烯合酶(squalene synthase,SQS)并研究其作用機制。以翼首草基原植物匙葉翼首草為研究對象,基于前期轉錄組數據篩選克隆基因,并進行生物信息學分析;通過煙草瞬時轉化實驗觀察PhSQS2亞細胞定位情況,利用實時熒光定量PCR分析PhSQS2在不同器官中的表達特征;構建原核表達載體經體外酶促反應鑒定PhSQS2功能。基因開放閱讀框(open reading frame,ORF)區域全長1242 bp編碼414個氨基酸,蛋白相對分子質量為47 400,理論等電點為6.57,總平均疏水性為?0.075,為不穩定蛋白。PhSQS2主要定位在細胞核和細胞質中;組織分布具有特異性,在根和葉中均有表達,葉中表達量顯著高于根中。體外酶促實驗證明PhSQS2催化法尼基焦磷酸生成鯊烯。PhSQS2的功能鑒定為解析翼首草中萜類物質生物合成途徑,提高三萜皂苷類成分含量及優質種質資源篩選培育提供了前期理論基礎。
匙葉翼首草;翼首草;鯊烯合酶(PhSQS2);生物信息學;表達特性;基因功能
中藥翼首草系藏族習用藥材,為川續斷科植物匙葉翼首草(C. B. Clarke) H?eck的干燥全草[1],具有解毒除瘟、清熱止痢、祛風通痹等功效。作為藏醫藥常用藥材之一,是二十五味余甘子丸、十二味翼首散等中藥的組方藥,多用于瘟病時疫、痢疾、熱病發燒、風濕性關節炎等疾病的治療[2]。富含皂苷類成分是川續斷科植物的一大特點,化學成分研究發現翼首草活性成分主要包括五環三萜類皂苷、環烯醚萜苷等萜類成分[3],目前已分離出齊墩果酸、熊果苷酸、匙葉翼首草苷A~D等五環三萜類化合物[4-5],馬錢苷等環烯醚萜苷類化合物[6-7]。其中三萜總皂苷具有抗腫瘤、護肝、抗炎、調節免疫等藥理活性[8],環烯醚萜苷化合物的藥理活性研究發現其具有抗氧化、抗病毒等作用[9]。
萜類化合物是植物體內廣泛存在的重要次生代謝產物,由異戊二烯結構單元構成基本骨架,主要通過異戊二烯首尾相接以及環化2種方式合成。植物胞質中的甲羥戊酸(mevalonate,MVA)和質體中的甲基赤蘚醇-4-磷酸(methylerythritol- 4-phosphate,DXP/MEP)2種生物合成途徑[10]催化生成萜類物質的基本單元異戊烯焦磷酸(isopentenyl diphosphate,IPP)及其同分異構體二甲基烯丙基焦磷酸酯(dimethylallyl diphosphate,DMAPP)。IPP和DMAPP在異戊烯基轉移酶作用下合成萜類前體異戊二烯焦磷酸鏈,包括單萜前體香葉基焦磷酸(geranyl pyrophosphate,GPP)、倍半萜前體法尼基焦磷酸(farnesyl pyrophosphate,FPP)和二萜前體香葉基香葉基焦磷酸(geranylgeranyl pyrophosphate,GGPP);其中2個FPP在鯊烯合酶(squalene synthase,SQS)作用下縮合生成三萜前體鯊烯。單萜、二萜、三萜等前體在萜類合酶的作用下生成各種萜類骨架,進一步經氧化、酰基化及糖基化等化學修飾最后形成一系列復雜萜類化合物[11]。目前已從黃花蒿[12]、刺五加[13]、三七[14]、丹參[15]、白花丹參[16]、雷公藤[17]、黃芪[18]等多種藥用植物中成功篩選克隆基因。三七中鯊烯合酶基因表達量同三萜總皂苷含量進行共分析發現兩者存在正相關關系[14],提高刺五加中鯊烯合酶基因表達量可以促進總皂苷的積累[13],而體外重組蛋白酶促反應直接證明黃花蒿鯊烯合酶可以催化FPP轉化生成鯊烯[12],由此看出鯊烯合酶是決定著法尼基焦磷酸流向的關鍵酶,是開啟植物三萜皂苷類生物合成途徑的重要開關。迄今,有關翼首草三萜皂苷類物質生物合成途徑解析的研究尚未有所報道,因此發現并證明翼首草中鯊烯合酶功能對于解析五環三萜皂苷類物質的生物合成途徑(圖1),提高三萜皂苷類等活性成分含量具有重要意義。
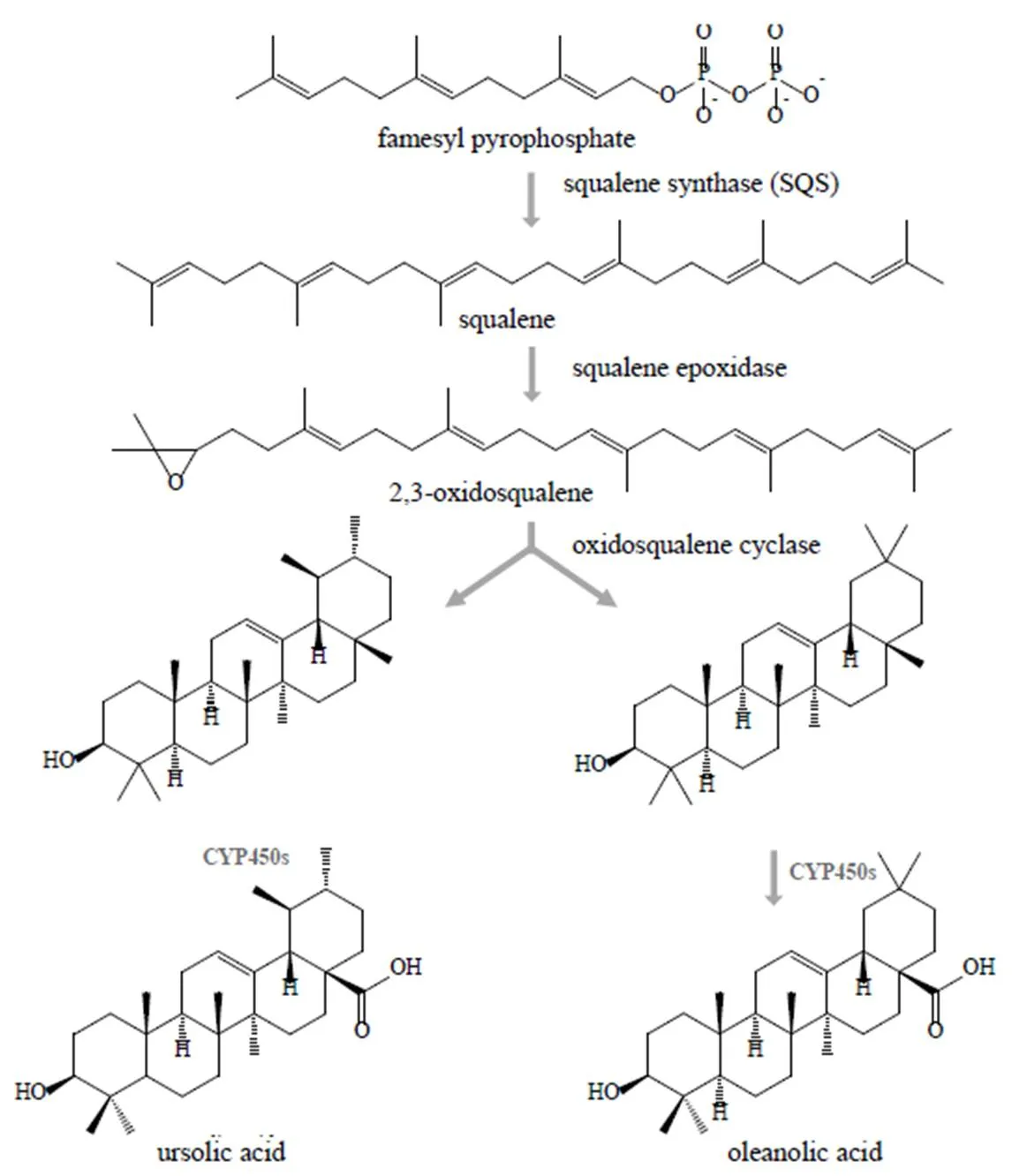
圖1 植物五環三萜生物合成途徑[19-20]
課題組前期從翼首草轉錄組數據中挖掘到1條鯊烯合酶基因[21],通過并對其進行克隆、生物信息學分析、表達模式分析、蛋白誘導表達及基因功能驗證等研究,證明PhSQS2具有鯊烯合酶的功能,為翼首草三萜皂苷類活性成分生物合成途徑解析及提高三萜總皂苷類物質的含量奠定了基礎。
1 材料
匙葉翼首草完整植株采于西藏自治區林芝市巴宜區,經西藏農牧學院蘭小中教授鑒定為川續斷科植物匙葉翼首草(C. B. Clarke) H?eck。樣品洗凈后分別收集根和葉,于液氮速凍后保存至?80 ℃冰箱。
2 方法
2.1 翼首草總RNA提取及cDNA合成
采用TransZol Up(全式金公司,中國)法提取翼首草樣品RNA,經1%瓊脂糖凝膠電泳和NanoDrop 2000c超微量分光光度計測定RNA純度和濃度。而后依次使用TransScript First-Strand cDNA Synthesis SuperMix(全式金公司,中國)和Advantage 2 PCR Kit(Clonetech公司,美國)完成雙鏈cDNA擴增,最終構建翼首草cDNA文庫,于?80 ℃冰箱保存備用。
2.2 PhSQS2基因序列數據挖掘及克隆
從翼首草轉錄組數據庫中獲得基因序列全長[21],通過Primer在線軟件設計擴增引物,引物序列見表1。翼首草RNA反轉錄后獲得的cDNA作為模板,進行普通PCR擴增完成基因克隆。
表1 引物序列
Table 1 Primers sequences
引物名稱序列(5′→3′)用途 PhSQS2-FATGGGAGGTATGGGAGAAATTTTGA克隆 PhSQS2-RGAAAGCTAACCATGTGTTATGTGAT克隆 PhSQS2-Q-FTTGGCCTCGTGAAATTTGGGqRT-PCR PhSQS2-Q-RCCAATTGCCATGACCTGAGGqRT-PCR PhSQS2-sub-FGACGAGCTGTACAAGGGATCCATGGGAGGTATGGGAGAAATTTTGA亞細胞定位 PhSQS2-sub-RCTAGAGGATCAATTCGAGCTCGAAAGCTAACCATGTGTTATGTGAT亞細胞定位 PhSQS2-pET-FGGATCCGAATTCGAGCTCATGGGAGGTATGGGAGAAATTTTGA原核表達 PhSQS2-pET-RGAGTGCGGCCGCAAGCTTGAAAGCTAACCATGTGTTATGTGAT原核表達
2.3 PhSQS2生物信息學分析
用ProtParam(http://web.expasy.org/compute)在線軟件分析PhSQS2蛋白基本理化性質;通過ProtScale(https://web.expasy.org/protscale)在線軟件對PhSQS2進行親疏水性預測;利用Pfam32.0 (http://pfam.xfam.org/search)和NCBI數據庫BLAST (CD-Search)(https://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)在線軟件對PhSQS2蛋白進行功能域的預測;依賴Swiss-Model(http:// www.expasy.ch/swissmod/SWISS-MODEL. html)在線軟件進行蛋白的三級結構預測,并用PyMOL實現PhSQS2三維結構可視化。
2.4 PhSQS2實時熒光定量PCR分析
選取翼首草基因作為內參基因[22],使用NovoScript?SYBR One-Step qRT-PCR Kit(近岸公司,上海)試劑盒進行qRT-PCR,使用2?ΔΔCt法進行處理,實驗設置3組生物學重復,數據使用平均值和標準差,并且相對定量時將目的基因在根中的表達量設為“1”。
2.5 PhSQS2亞細胞定位載體構建
選擇H I和I作為酶切位點設計引物構建- pCAMBIA1301-YFP亞細胞定位載體,測序正確后將重組定位載體轉化農桿菌用作后續亞細胞定位實驗。p-YFP載體經相同處理轉化農桿菌作為陰性對照。
2.6 PhSQS2亞細胞定位分析
取200 μL已轉入目的基因的農桿菌加入5 mL YEB(50 mg/L Rif+50 mg/L Kan)液體培養基中,28 ℃,220 r/min,振蕩培養16 h;5000 r/min,離心10 min,去上清。MS溶液重懸菌體,待菌液值約為0.6時加入終濃度為10 mmol/L嗎啉乙磺酸和100 μmol/L乙酰丁香酮,室溫靜置3 h;緩慢勻速注射于本氏煙草葉片背面,暗培養植株2~3 d后通過激光共聚焦顯微鏡觀察結果。
2.7 PhSQS2原核表達載體構建及轉化
選擇I和d III作為酶切位點設計引物構建PhSQS2-pET-32a+原核表達載體,測序正確后將重組表達載體轉化BL21(DE3)感受態細胞用作后續蛋白表達。pET-32a+載體經相同處理轉化BL21(DE3)感受態細胞后作為陰性對照。
2.8 PhSQS2重組蛋白誘導表達
取含有PhSQS2-pET-32a+和pET-32a+陽性克隆的菌液各10 μL加入1 mL含有LB(100 mg/L Amp)液體培養基中,37 ℃振蕩培養2 h。取500 μL活化后菌液加入1000 mL 乳酸桿菌(100 mg/L 磷酸腺苷)液體培養基培養到600為0.6加入終濃度為1 mmol/L的IPTG,80 r/min,16 ℃過夜培養;4 ℃離心收集菌體,5 mL 1×PBS緩沖液重懸菌體;冰上超聲(功率25%,超聲5 s,間隔5 s)破碎20 min;4 ℃離心收集上清液;使用SDS-PAGE電泳檢測上清液中是否存在目的蛋白表達。
2.9 PhSQS2體外酶促實驗及產物檢測
使用Bio-ScaleTM Mini ProfinityTM IMAC Cartridges純化柱進行蛋白純化,根據重組蛋白內含有His標簽與相應抗體特異性結合的原理經Western blotting實驗檢測是否表達最終目的蛋白,使用Bradford Protein Assay Kit(碧云天)測定蛋白濃度。
PhSQS2催化反應體系(300 μL):50 μmol/LFPP;20 mmol/LMgCl2;1 mmol/LDTT;2% Glycine;3 mmol/LNADPH;5 μg純化蛋白;50 mmol/LTris-HCl補齊。30 ℃,300 r/min反應過夜;結束后加入400 μL正己烷淬滅反應,400 μL正己烷萃取3次,合并上層有機相氮吹揮干濃縮,200 μL正己烷復溶,進行GC-MS檢測。
3 結果與分析
3.1 PhSQS2克隆及序列分析
以翼首草cDNA文庫為模板進行PCR擴增,產物經1%瓊脂糖凝膠電泳檢測,結果顯示在約1200 bp處出現一特異片段(圖2),與基因全長預期結果一致。

M-Marker 1-PhSQS2基因克隆條帶
克隆結果測序后證實與翼首草轉錄組數據中所獲序列全長完全相同。利用開放閱讀框(open reading frame,ORF)Finder(https://www.ncbi. nlm.nih.gov/orffinder)在線軟件對序列進行信息分析,發現基因ORF序列全長1242 bp,編碼414個氨基酸。利用DNAMAN軟件將其與其他相似度較高的植物氨基酸序列進行多重比對(圖3),分析結果顯示PhSQS2氨基酸序列與丹參Bunge、黃花蒿L.相似度均達到80%以上。

圖3 不同物種SQS氨基酸序列多重比對
3.2 PhSQS2生物信息學分析
基因ORF區域編碼414個氨基酸,蛋白相對分子質量為47 400,理論等電點為6.57,蛋白總平均疏水性為?0.075,屬于不穩定蛋白。采用ProtScale在線分析軟件對翼首草PhSQS2親水性/疏水性進行預測與分析,其中PhSQS2多肽鏈第248位氨基酸分值最低,親水性最強;第398位氨基酸分值最高,疏水性最強,結果同時可以看出蛋白疏水區域大于親水區域,故PhSQS2屬于疏水蛋白(圖4-A)。
利用Pfam 32.0及BLAST(CD-Search)在線軟件預測分析翼首草PhSQS2蛋白構域,結果顯示,PhSQS2含有關鍵的SQS_PSY功能域和PLN02632保守域(圖4-C),采用SWISS-MODEL在線軟件以TcSQS(PDB:3wca)作為模板經同源建模預測PhSQS2蛋白三級結構,經PyMOL可視化后結果見圖4-B。
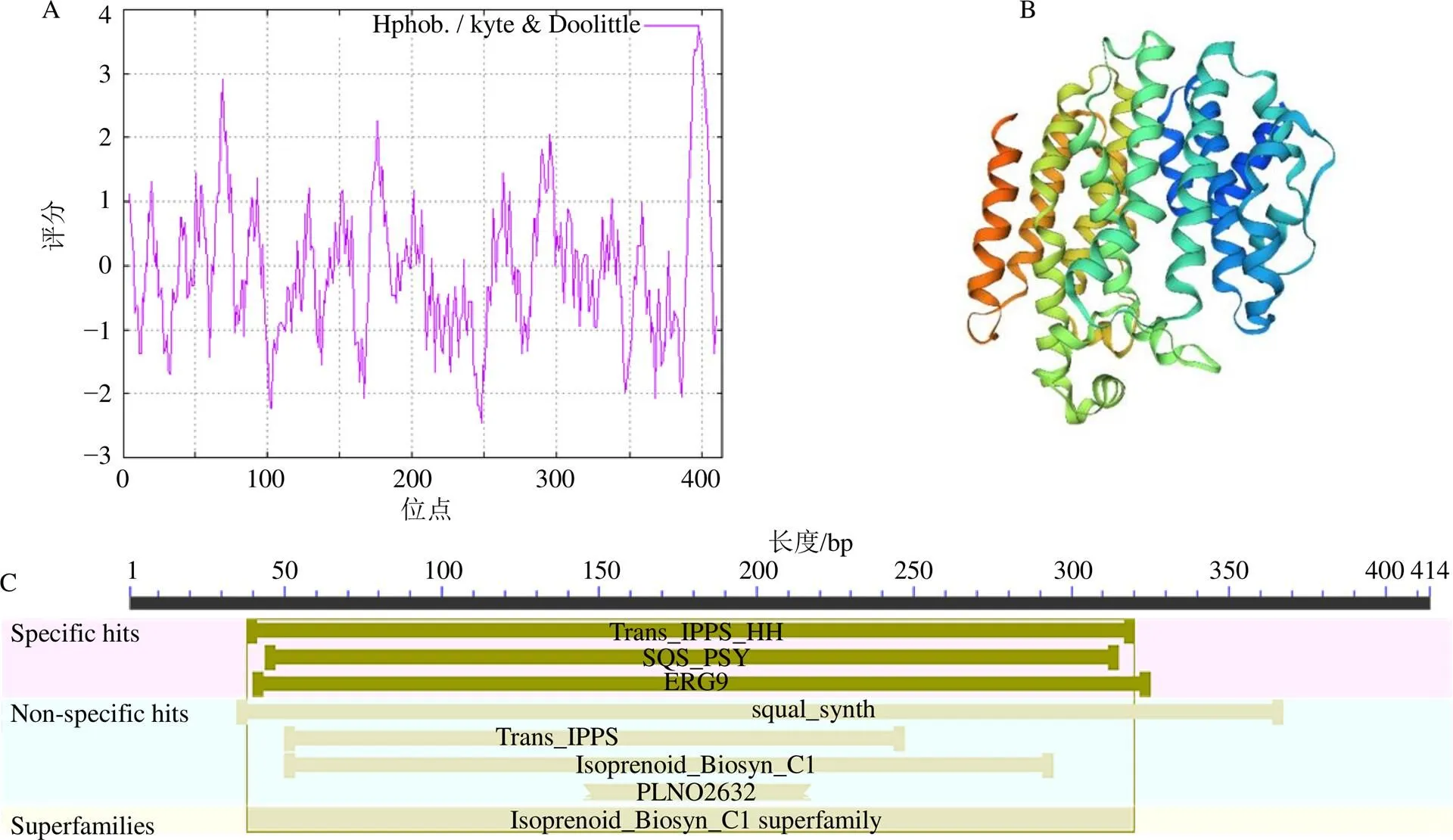
圖4 翼首草SQS2蛋白親水性/疏水性(A)、蛋白三級結構預測(B)、蛋白保守結構域(C)
3.3 PhSQS2組織表達特異性
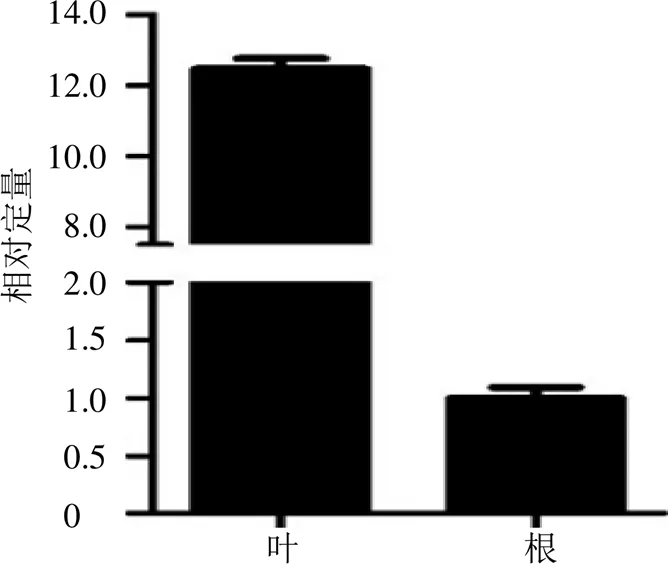
使用qRT-PCR檢測在翼首草不同組織(根、莖)中的分布情況。結果(圖5)顯示在根、葉中的表達量具有顯著差異,葉中的表達量約為根中的12.5倍。
3.4 PhSQS2亞細胞定位特征
構建PhSQS2-YFP融合表達載體并轉染本氏煙草,通過激光共聚焦顯微鏡掃描YFP黃色熒光信號(514 nm)觀察PhSQS2在煙草中亞細胞定位結果。結果顯示YFP對照組信號(圖6-A~C)分布在細胞核和細胞質;PhSQS2-YFP融合蛋白熒光信號(圖6-D~F)在細胞核和細胞質中均有存在,據此判斷PhSQS2-YFP融合蛋白定位在細胞核和細胞質中。
3.5 PhSQS2重組蛋白誘導表達
經IPTG誘導BL21(DE3)菌株表達后由SDS-PAGE檢測重組蛋白表達情況。如圖7-A所示,含有重組質粒PhSQS2-pET-32a+的菌株(PhSQS2目的蛋白相對分子質量約為47 400)在65 000附近有蛋白條帶;而pET-32a+空載體對照組菌株在相同位置無蛋白表達,僅在18 000附近表達His-Tag標簽蛋白,以上結果表明PhSQS2在大腸桿菌BL21(DE3)中成功表達。
**P<0.01
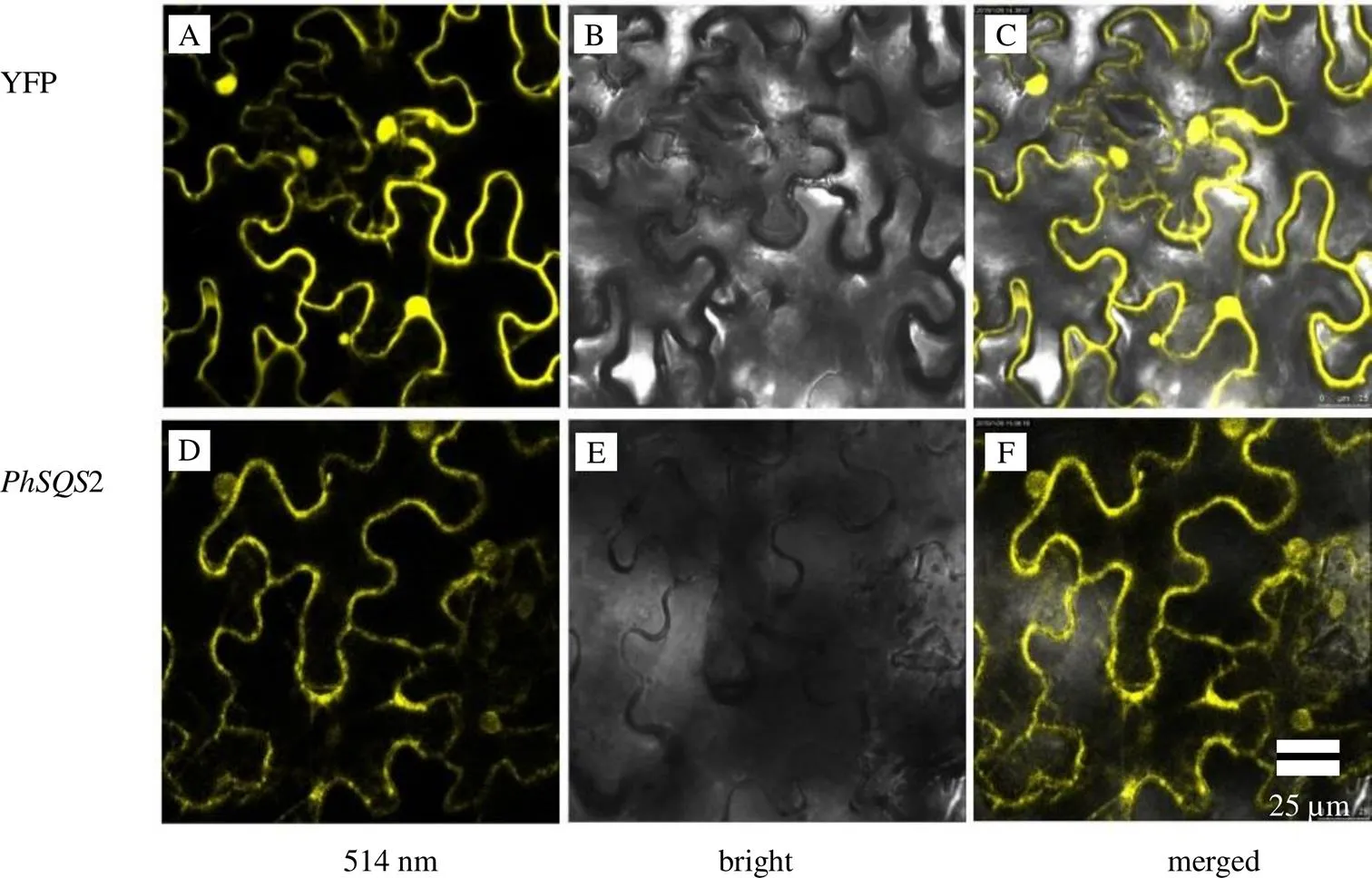
圖6 PhSQS2在煙草表皮中的亞細胞定位
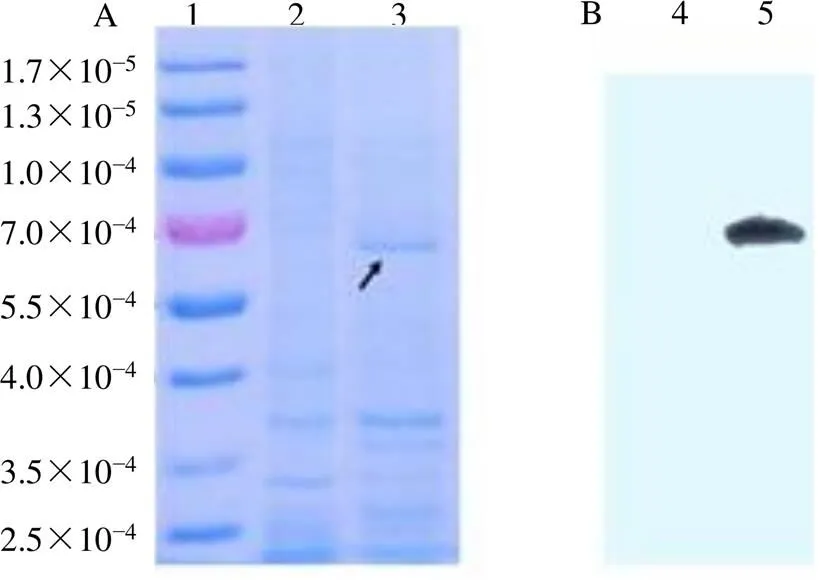
1-Marker 2、4-pET-32a+空載 3、5-PhSQS2重組蛋白
進一步利用Western blotting檢測所得蛋白是否為目的蛋白。結果如圖7-B所示,與空載體對照組相比,檢測到PhSQS2-pET-32a+表達信號,且條帶單一、純度良好。采用Bradford準曲線法對PhSQS2- pET-32a+融合蛋白進行濃度測定,最后獲得質量濃度為3.60 mg/mL的PhSQS2重組蛋白用作后續酶活實驗。
3.6 PhSQS2體外酶促產物檢測
對純化后的PhSQS2酶促反應產物進行GC-MS檢測,結果見圖8。以pET32a+空載表達的未純化蛋白作為陰性對照組,鯊烯對照品作為陽性對照,氣相色譜結果顯示PhSQS2酶促反應產物和鯊烯對照品在保留時間9.87 min處出現相同的色譜峰,對該色譜峰進行質譜分析,特征離子一致,說明PhSQS2酶促反應生成了鯊烯,PhSQS2具有鯊烯合酶的功能。
4 討論
翼首草作為常用傳統藏藥材,在西藏民間具有悠久的用藥史,其需求逐年增長,但因基原植物匙葉翼首草主要生長在西藏、云南、四川等海拔3000 m以上的草地、林間、林緣、高山草甸[23],嚴苛的生長環境制約了其后續應用,目前藥材來源主要以野生采挖為主,長期野生采挖使翼首草的野生資源瀕臨滅絕[24]。近些年對于翼首草的研究主要集中在基原植物匙葉翼首草的人工栽培[25],翼首草中活性成分生物合成途徑解析、活性成分調控,以及優良種質資源的培育等方向。生物合成途徑中的關鍵酶活性影響活性成分的產量,因此調控植物中關鍵酶基因的表達是提高活性成分產量、改善中藥材品質的重要手段。對于翼首草萜類物質途徑解析,本研究主要聚焦于SQS的克隆以及相關功能研究。體外蛋白功能驗證PhSQS2具有鯊烯合酶的功能,可催化鯊烯生成。后續構建PhSQS2過表達載體或通過激素誘導提高植物體內基因表達量,使法尼基焦磷酸更多地流向三萜類物質合成,將有利于三萜皂苷類成分的積累。組織特異性表達結果表明PhSQS2在根和葉中均有分布,葉中表達量顯著高于根中。但已有報道的翼首草三萜總皂苷代謝數據與上述轉錄數據并不一致,比較翼首草不同部位的總皂苷含量,發現根和葉中均含有豐富的總皂苷類物質,但根中含量要高于葉中[26-27]。類似的結果在三七中也被檢測到,SQS在根中的表達量要高于蘆頭和莖中,但蘆頭中總皂苷含量最高[14]。分析造成轉錄代謝分布不一致的原因,認為可能是因為SQS位于三萜合成途徑上游,下游其他關鍵酶如環氧酶、環化酶、單加氧酶等在翼首草葉中的表達影響了皂苷的合成;或是三萜合成途徑中存在著中間體的定向轉運影響了終產物的分布。但可以明確的是提高鯊烯合酶的表達量可以提高植物中三萜皂苷的含量[13],鯊烯合酶在三萜生物合成途徑中具有重要作用。挖掘到翼首草中的鯊烯合酶對于提高三萜皂苷類物質含量以及篩選培育翼首草優質種質資源具有重要意義。
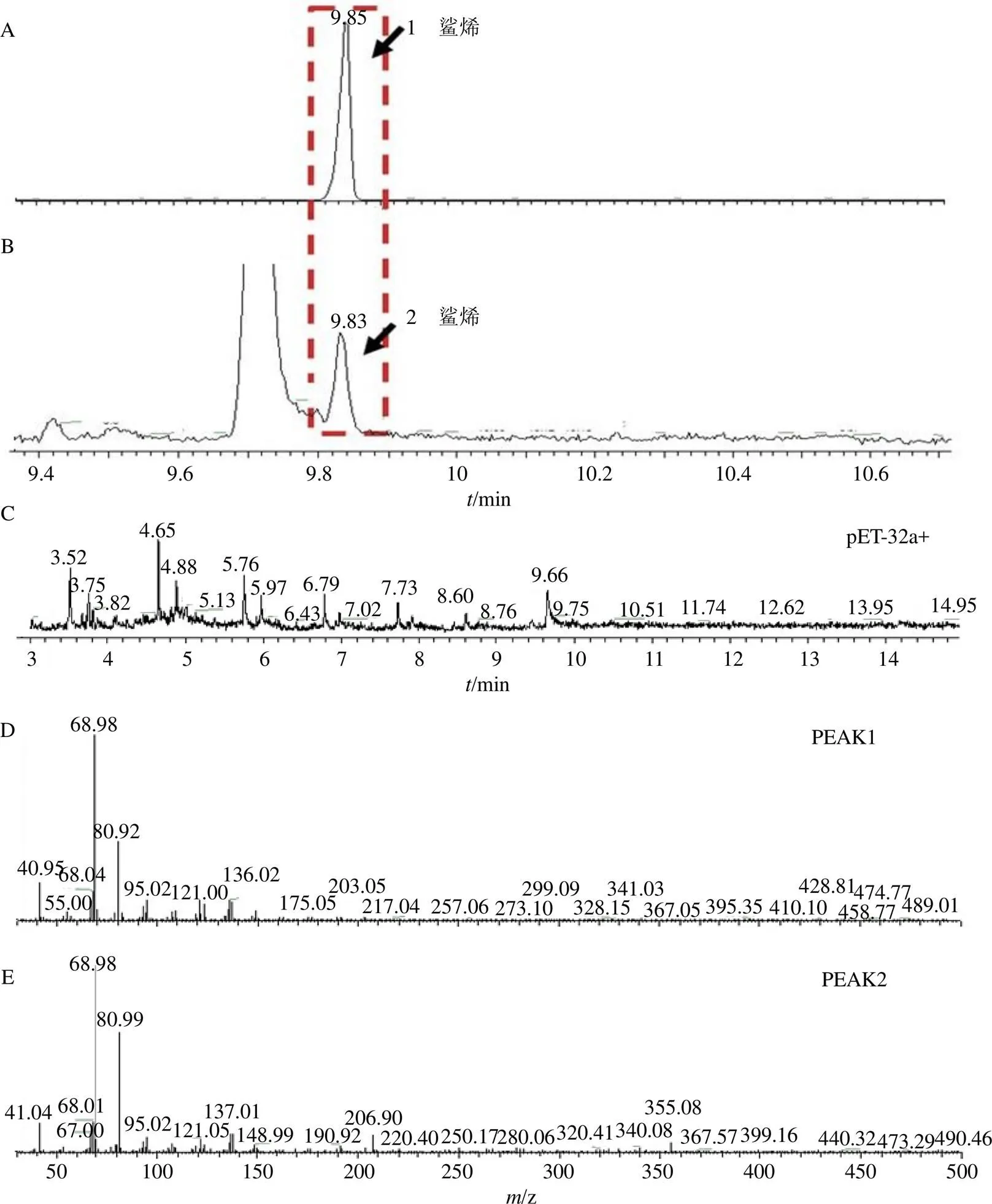
A-鯊烯對照品 B-PhSQS2 C-pET-32a+ D-峰1質譜圖 E-峰2質譜圖
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典[S]. 四部. 2020: 23.
[2] 中國科學院西北高原生物研究所. 藏藥志 [M]. 西寧: 青海人民出版社, 2019: 36.
[3] 郭晨旭, 朱國福. 藏藥翼首草化學成分及藥理作用研究進展 [J]. 世界中醫藥, 2015, 10(9): 1440-1443.
[4] 權紅, 甄梓娟, 李連強, 等. 藏藥匙葉翼首草中齊墩果酸及熊果酸的含量測定 [J]. 中國現代中藥, 2016, 18(6): 762-765.
[5] Zeng Y B, Mei W L, Zhao Y X,. Two new epimeric pairs of iridoid from mangrove plant[J]., 2007, 18(12): 1509-1511.
[6] 田軍, 吳鳳鍔, 丘明華, 聶瑞麟. 匙葉翼首花的化學成分 [J]. 天然產物研究與開發, 2000, 12(1): 35-38.
[7] Graikou K, Aligiannis N, Chinou I B,. Cantleyoside-dimethyl-acetal and other iridoid glucosides from: Antimicrobial activities [J]., 2002, 57(1/2): 95-99.
[8] Zhang L, Hu J J, Lin J W,. Anti-inflammatory and analgesic effects of ethanol and aqueous extracts of(C. B. Clarke) H?eck [J]., 2009, 123(3): 510-514.
[9] 張雪梅, 楊豐慶, 夏之寧. 藏藥翼首草的藥理作用及其質量評價研究進展 [J]. 中國藥房, 2012, 23(35): 3356-3358.
[10] Pu X J, Dong X M, Li Q,. An update on the function and regulation of methylerythritol phosphate and mevalonate pathways and their evolutionary dynamics [J]., 2021, 63(7): 1211-1226.
[11] Singh B, Sharma R A. Plant terpenes: Defense responses, phylogenetic analysis, regulation and clinical applications [J]., 2015, 5(2): 129-151.
[12] 李振秋, 王花紅, 王紅, 等. 中藥青蒿鯊烯合酶的大腸桿菌表達、純化與功能鑒定 [J]. 應用與環境生物學報, 2007, 13(3): 309-312.
[13] 邢朝斌, 龍月紅, 勞鳳云, 等. 刺五加鯊烯合酶基因的表達及其對皂苷含量的影響 [J]. 經濟林研究, 2013, 31(1): 25-29.
[14] 吳耀生, 朱華, 李珅, 等. 三七鯊烯合酶基因在三七根、莖、蘆頭中的轉錄表達與三萜皂苷合成 [J]. 中國生物化學與分子生物學報, 2007, 23(12): 1000-1005.
[15] 馬藝沔, 袁麗釵, 張林甦, 等. 2個丹參鯊烯合酶基因的克隆和鑒定 [J]. 中草藥, 2014, 45(9): 1307-1312.
[16] 榮齊仙, 姜丹, 查良平, 等. 白花丹參鯊烯合酶SQS2的克隆與原核表達分析 [J]. 中國中藥雜志, 2015, 40(7): 1259-1265.
[17] 劉雨佳, 蘇平, 王秀娟, 等. 雷公藤鯊烯合酶基因全長cDNA克隆及誘導表達分析 [J]. 藥學學報, 2016, 51(4): 657-661.
[18] 李振秋, 王曉明, 金亞明, 等. 黃芪鯊烯合酶基因的克隆和序列分析 [J]. 河北林果研究, 2011, 26(1): 16-19.
[19] Misra R C, Maiti P, Chanotiya C S,. Methyl jasmonate-elicited transcriptional responses and pentacyclic triterpene biosynthesis in sweet basil [J]., 2014, 164(2): 1028-1044.
[20] Unland K, Pütter K M, Vorwerk K,. Functional characterization of squalene synthase and squalene epoxidase in[J]., 2018, 2(6): e00063.
[21] 何焱, 李忠玥, 李卿, 等. 藏藥翼首草角鯊烯合成酶的生物信息學分析 [J]. 基因組學與應用生物學, 2020, 39(7): 3139-3150.
[22] 何焱, 李忠玥, 劉江, 等. 翼首草實時熒光定量PCR內參基因篩選 [J]. 分子植物育種, 2020, 18(9): 2987-2993.
[23] 關昕璐, 閻玉凝, 任子和, 等. 翼首草的鑒別研究 [J]. 中國中藥雜志, 2004, 29(11): 1027-1030.
[24] 甄梓娟, 徐元江, 廖志華, 等. 藏藥匙葉翼首草及其同屬植物的研究進展 [J]. 中藥材, 2016, 39(1): 223-228.
[25] 蘭小中, 周戰. 一種高海拔地區翼首草的高產人工栽培技術: CN103141291A [P]. 2013-06-12.
[26] 林升得, 江道峰, 張藝, 等. 分光光度法測定藏藥翼首草不同藥用部位總皂苷的含量 [J]. 中國實驗方劑學雜志, 2013, 19(5): 101-104.
[27] 楊榮平, 向春艷, 張小梅, 等. 不同產地翼首草中總皂苷的含量比較 [J]. 時珍國醫國藥, 2010, 21(7): 1797-1798.
Cloning, expression pattern and functional analysis of squalene synthase (PhSQS2) in
WANG Yun1, WU Yu2, JIANG Qing-feng3, HE Yan2, 4, LAN Xiao-zhong4, ZHANG Lei1, 2
1. Biomedical Innovation R&D Center, School of Medicine, Shanghai University, Shanghai 200444, China 2. Department of Pharmaceutical Botany, School of Pharmacy, Second Military Medical University, Shanghai 200433, China 3. Pharmacy Department, Medical Security Center, General Hospital of Tibet Military Region, Lhasa 850000, China 4.Animal Husbandry College and TAAHC-SWU Medicinal Plant R&D Centre, Tibet Agricultural and Animal Husbandry University, Nyingchi 860000, China
To explore the squalene synthase (SQS) from the transcriptome ofand investigate its mechanism of action.Takingas research object , thegene was cloned and bioinformatically analyzed based on preliminary transcriptome data; The subcellular localization of PhSQS2 was observed by transient transformation experiments in tobacco, and the expression characteristics of PhSQS2 in different organs were analyzed by real-time fluorescence quantitative PCR; Finally, the prokaryotic expression vector was constructed to identify the function of PhSQS2 by enzymatic reaction.Thegene was screened with the length of open reading frames 1242 bp, encoding proteins 414 amino acids. Bioinformatics analysis showed that it was an unstable hydrophobic protein with a relative molecular weight of 47 400, a theoretical PI of 6.57 and an average hydrophobicity of ?0.075. PhSQS2 was mainly localized in nucleus and cytoplasm;Its tissue distribution was specific,and it was expressed in both roots and leaves, and the expression in leaves were significantly higher than those in roots.enzymatic reactions proved that as a squalene synthase, PhSQS2 catalysed the production of squalene from farnesyl pyrophosphate.The functional identification of PhSQS2 provides a theoretical basis for the further analysis of the terpenoid biosynthesis pathway and the improvement of triterpenoid saponins from, as well as for in-depth research on the screening and cultivation of high-quality germplasm resources.
(C.B.Clarke) H?eck;; squalene synthase (PhSQS2); bioinformatics analysis; expression pattern; gene function
R286.12
A
0253 - 2670(2022)21 - 6840 - 08
10.7501/j.issn.0253-2670.2022.21.022
2022-04-03
國家自然科學基金資助項目(31970316);上海市優秀學術帶頭人計劃(19XD1405000)
王 蕓(1993—),女,助理實驗師。E-mail: ssalvia4444@shu.edu.cn
蘭小中(1973—),男,教授,研究方向為藏藥資源、中藥資源與品質調控。E-mail: lanxiaozhong@163.com
張 磊(1977—),男,教授,研究方向為中藥資源與品質調控。E-mail: starzhanglei@aliyun.com
#共同第一作者:吳 宇(1988—),女,助教,研究方向為重要活性天然產物的生物合成與代謝調控。E-mail: wuyuagnes@163.com
[責任編輯 時圣明]

