短期牦牛放牧對(duì)青藏高原高寒草地土壤真菌群落的影響
王永宏,田黎明,艾鷖,陳仕勇,澤讓東科*
(1.西南民族大學(xué)青藏高原研究院,四川若爾蓋高寒濕地生態(tài)系統(tǒng)國(guó)家野外科學(xué)觀察研究站,四川成都 610041;2.四川大學(xué)生命科學(xué)學(xué)院,四川成都 610065;3.西南民族大學(xué)畜牧獸醫(yī)學(xué)院,四川 成都 610041)
青藏高原是全球海拔最高、面積最大的高原,具有極其重要的生態(tài)價(jià)值[1]。高寒草地約占青藏高原總面積的60%[2],是全球最獨(dú)特的草地生態(tài)系統(tǒng)之一,在保護(hù)青藏高原生物多樣性方面發(fā)揮著重要的生態(tài)作用,同時(shí)維持著區(qū)域的經(jīng)濟(jì)發(fā)展[3]。青藏高原是我國(guó)主要牧區(qū)之一[4],放牧作為主要的草地利用方式,對(duì)青藏高原的經(jīng)濟(jì)發(fā)展與生態(tài)環(huán)境具有重要影響[5]。然而,隨著放牧強(qiáng)度嚴(yán)重超載,加之氣候變暖,最終導(dǎo)致青藏高原高寒草甸發(fā)生了不同程度的退化[6-7]。持續(xù)高強(qiáng)度放牧?xí)?duì)草地造成不可恢復(fù)的損害,但單一限制牧民放牧?xí)璧K青藏高原的經(jīng)濟(jì)發(fā)展[8]。因此,探究青藏高原地區(qū)牦牛放牧、經(jīng)濟(jì)發(fā)展與草地生態(tài)健康的平衡具有重要社會(huì)意義。
微生物是生態(tài)系統(tǒng)中主要的分解者之一,微生物多樣性與生態(tài)系統(tǒng)功能直接相關(guān),微生物豐富度越高,群落功能越穩(wěn)定[9]。放牧通過(guò)采食、踐踏與排泄行為影響土壤性質(zhì)和微生物群落,家畜會(huì)通過(guò)排泄方式返還給土壤部分碳[10],家畜的消化與分解過(guò)程,會(huì)使排泄物結(jié)構(gòu)變簡(jiǎn)單,從而利于微生物的利用與生長(zhǎng)。放牧行為會(huì)影響土壤真菌群落的結(jié)構(gòu),放牧強(qiáng)度也會(huì)對(duì)微生物群落產(chǎn)生極大的影響。放牧強(qiáng)度過(guò)高會(huì)改變土壤的容重,降低植被覆蓋度,增加土壤表面的紫外線強(qiáng)度,改變土壤溫度,從而使微生物的生長(zhǎng)條件惡化[11],導(dǎo)致微生物生物量下降。土壤真菌的底物為難分解的有機(jī)質(zhì),在放牧地的土壤微生物群落競(jìng)爭(zhēng)中處于劣勢(shì),土壤微生物群落向以細(xì)菌為主的結(jié)構(gòu)轉(zhuǎn)變[12]。但Wang等[13]通過(guò)添加不同形式的碳發(fā)現(xiàn)真菌主要同化不穩(wěn)定碳,雖然對(duì)葡萄糖利用能力不及細(xì)菌,但當(dāng)葡萄糖碳可用性增加時(shí),真菌是固定葡萄糖碳的關(guān)鍵競(jìng)爭(zhēng)類群。放牧通過(guò)多種方式影響土壤真菌群落,但牦牛放牧強(qiáng)度對(duì)于真菌群落的影響仍不清楚。
全球范圍的研究表明,土壤真菌的豐富度和植物多樣性僅存在微弱的關(guān)系,并提出氣候因素、土壤和空間變量是真菌豐富度與群落結(jié)構(gòu)的最佳預(yù)測(cè)因子[14]。針對(duì)青藏高原的研究表明在考慮環(huán)境因子時(shí)真菌豐富度與植物豐富度呈正相關(guān),但氣候、空間和土壤仍是真菌群落組成的主要預(yù)測(cè)因子[15]。放牧作為草地利用的主要形式之一,許多研究揭示了其對(duì)真菌群落的影響[16-19]。例如,青藏高原圍封試驗(yàn)發(fā)現(xiàn)放牧活動(dòng)會(huì)降低土壤有機(jī)碳,間接增加真核生物的豐富度與多樣性[16];究其原因主要是放牧通過(guò)減少土壤碳輸入使土壤pH升高,從而為真菌生長(zhǎng)提供更適合的條件,使土壤真菌的α多樣性與土壤pH呈正相關(guān)[17]。將真菌根據(jù)功能群進(jìn)一步劃分后發(fā)現(xiàn),不同的真菌功能群對(duì)放牧的響應(yīng)并不相同:放牧?xí)黾诱婢S腐菌、降低植物病原菌,兔子放牧降低了外生菌根和叢枝菌根真菌[18-19];通過(guò)全球范圍草地的整合分析發(fā)現(xiàn)重度和中度放牧?xí)档蛥仓婢S度,而輕度放牧的影響卻不顯著[20]。前期研究表明土壤因子是放牧影響土壤真菌的重要媒介之一,但放牧對(duì)土壤的影響具有一定的滯后性,因此短期放牧對(duì)土壤化學(xué)計(jì)量的影響并不顯著[21],然而短期放牧對(duì)土壤真菌是否有影響及其影響方式報(bào)道較少。
真菌群落的生態(tài)功能,是通過(guò)物種之間的相互作用實(shí)現(xiàn)的,物種間的競(jìng)爭(zhēng)、協(xié)作等過(guò)程直接或間接相互聯(lián)系,形成一個(gè)復(fù)雜的互作網(wǎng)絡(luò)[22]。網(wǎng)絡(luò)分析能夠通過(guò)模塊化量化共現(xiàn)網(wǎng)絡(luò)的相互作用程度,進(jìn)一步細(xì)分了真菌類群的生態(tài)功能[23]。以往的研究中將真菌群落作為一個(gè)整體,探究其多樣性及豐度對(duì)放牧活動(dòng)的響應(yīng);或者僅研究特定的功能群對(duì)于放牧的響應(yīng),忽略了不同真菌間的競(jìng)爭(zhēng)與合作關(guān)系。真菌群落擁有復(fù)雜的結(jié)構(gòu),不同真菌類群間具有怎樣的相互作用及其相互作用是否會(huì)削弱特定真菌類群對(duì)外界干擾的響應(yīng)仍需進(jìn)一步探究。
本研究在川西北高寒草甸進(jìn)行短期(2年)不同強(qiáng)度牦牛放牧處理,利用二代測(cè)序技術(shù)對(duì)土壤真菌群落結(jié)構(gòu)進(jìn)行探究,通過(guò)不同真菌物種的共現(xiàn)特征進(jìn)行真菌類群劃分,研究牦牛短期放牧對(duì)土壤真菌群落構(gòu)成是否有影響,若有影響是通過(guò)何種方式實(shí)現(xiàn)的,從而為高寒草甸放牧管理提供基礎(chǔ)數(shù)據(jù)與依據(jù)。
1 材料與方法
1.1 試驗(yàn)地概況
本試驗(yàn)在“四川若爾蓋高寒濕地生態(tài)系統(tǒng)國(guó)家野外科學(xué)觀察研究站”進(jìn)行,位于青藏高原東緣四川省阿壩藏族羌族自治州(32°48'N,102°33'E),試驗(yàn)區(qū)年均氣溫1.5℃、年均降水750 mm,海拔為3504 m。試驗(yàn)地優(yōu)勢(shì)植物種為垂穗披堿草(Elymus nutans)、高山嵩草(Kobresia pygmaea)、矮嵩草(Kobresia humilis),植被類型為典型高寒草甸。
1.2 試驗(yàn)設(shè)計(jì)與樣品采集
于2014年選取一處典型高寒草甸夏季牧場(chǎng)進(jìn)行圍封,圍封一年確保草地初始狀況較為均一,2015年5月進(jìn)行放牧試驗(yàn),牦牛的放牧?xí)r間為每年的5月下旬到9月下旬。試驗(yàn)設(shè)計(jì)為3個(gè)放牧處理和一個(gè)對(duì)照處理,每個(gè)處理設(shè)置3個(gè)重復(fù);放牧處理為輕度放牧(1頭牦牛·hm-2)、中度放牧(2頭牦牛·hm-2)與重度放牧(3頭牦牛·hm-2),對(duì)照處理為圍封禁牧。試驗(yàn)地總面積為10 hm2,其中每個(gè)放牧處理樣地面積為1 hm2,每個(gè)對(duì)照處理樣地面積均為0.33 hm2,樣地的詳細(xì)情況見(jiàn)Mipam等[21,24]的報(bào)道。試驗(yàn)期間每個(gè)月對(duì)每塊樣地隨機(jī)選取4個(gè)點(diǎn),進(jìn)行植物群落調(diào)查與生物量樣品收集。于放牧處理第2年8月底采集土壤樣品,對(duì)每塊樣地隨機(jī)選取4個(gè)點(diǎn),每個(gè)點(diǎn)用土鉆采集5個(gè)0~10 cm的土柱混合為一個(gè)土壤樣品;土壤樣品分為兩部分,一部分陰干用于土壤理化性質(zhì)檢測(cè),另一部分低溫保存用于土壤真菌群落測(cè)定。
1.3 環(huán)境因子測(cè)定
植物群落豐富度通過(guò)計(jì)算每個(gè)調(diào)查的樣方的植物物種數(shù)來(lái)確定,Shannon-Wiener多樣性指數(shù)和Pielou均勻度指數(shù)根據(jù)以下公式計(jì)算:
式中:H為Shannon-Wiener多樣性指數(shù),J為Pielou均勻度指數(shù),S為物種豐富度,Pi為每個(gè)樣方中的物種i的相對(duì)重要性,其計(jì)算方法為物種i的個(gè)體數(shù)與樣方總個(gè)體數(shù)的比值。植物凈生產(chǎn)力使用可移動(dòng)扣籠法估計(jì),其方法為在每個(gè)放牧區(qū)放置4個(gè)可移動(dòng)扣籠,在試驗(yàn)期每月收獲可移動(dòng)扣籠內(nèi)與外的生物量,并在收獲完當(dāng)月生物量后隨機(jī)移動(dòng)扣籠,通過(guò)籠內(nèi)與籠外收獲生物量的差值獲得當(dāng)月的家畜消耗量,估算各試驗(yàn)地凈初級(jí)生產(chǎn)力。
采用烘干法測(cè)定土壤含水率,環(huán)刀法測(cè)定土壤容重;將陰干土壤揀除草根、石塊等雜物后用研砵碾碎,過(guò)2 mm篩后用于土壤全效養(yǎng)分檢測(cè),采用電位法測(cè)定土壤pH,重鉻酸鉀氧化外加熱法測(cè)定土壤有機(jī)質(zhì),凱氏定氮法測(cè)定土壤全氮,NaOH熔融-鉬銻抗比色法測(cè)定土壤全磷,火焰分光光度計(jì)法測(cè)定土壤全鉀;用過(guò)0.15 mm篩的陰干土壤測(cè)速效養(yǎng)分,采用堿解擴(kuò)散法測(cè)定土壤堿解氮含量,NaHCO3浸提-鉬銻抗比色法測(cè)定土壤速效磷,乙酸銨浸提-火焰光度計(jì)法測(cè)定土壤速效鉀,以上所有測(cè)定方法均參照鮑士旦[25]。
1.4 土壤真菌群落測(cè)定
土壤總DNA用QIAamp? DNA Stool Mini Kit(QIAGEN,德國(guó))試劑盒進(jìn)行提取,用引物ITS5-1737F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS2-2043R(5'-GCTGCGTTCTTCATCGATGC-3')對(duì)真菌ITS1區(qū)域進(jìn)行PCR擴(kuò)增,PCR過(guò)程為:通過(guò)98℃保持30 s進(jìn)行預(yù)變性,然后進(jìn)入循環(huán);循環(huán)過(guò)程為98℃變性15 s、降到50℃退火30 s、72℃延伸30 s完成循環(huán),循環(huán)次數(shù)為25~27次;最后72℃保持5 min,于4℃保存。回收PCR產(chǎn)物后在Microplate reader(BioTek,F(xiàn)Lx800)上進(jìn)行定量,用Illumina公司的TruSeq Nano DNALT Library Prep Kit制備測(cè)序文庫(kù),采用Illumina MiSeq測(cè)序平臺(tái)進(jìn)行雙端測(cè)序。
1.5 生信分析
將原始雙端測(cè)序數(shù)據(jù)利用滑動(dòng)窗口法進(jìn)行質(zhì)控,窗口設(shè)置為10 bp,步長(zhǎng)設(shè)置為1 bp,從5'端進(jìn)行窗口滑動(dòng),窗口的堿基平均測(cè)序準(zhǔn)確率≥99%(Q20),從第一個(gè)平均質(zhì)量低于該標(biāo)準(zhǔn)的窗口進(jìn)行截?cái)啵コ財(cái)嗪笮∮?50 bp和含有模糊堿基N的序列。使用軟件FLASH(v1.2.7)將Read1與Read2進(jìn)行堿基配對(duì),重疊堿基長(zhǎng)度≥10 bp,最后根據(jù)Barcode序列對(duì)樣本進(jìn)行拆分。使用QIIME(quantitative insights into microbial ecology,v1.8.0)的USEARCH(v5.2.236)去除嵌合體序列,調(diào)用UCLUST工具,進(jìn)行序列比對(duì),將序列按照97%的相似度進(jìn)行可操作分類單元(operational taxonomic unit,OTU)的劃分,選取豐度高的序列作為代表序列,將代表序列與UNITE數(shù)據(jù)庫(kù)比對(duì)進(jìn)行分類學(xué)注釋。
1.6 統(tǒng)計(jì)分析
利用SPSS對(duì)土壤理化性質(zhì)進(jìn)行單因素方差分析(P<0.05)。使用QIIME計(jì)算真菌的α多樣性指數(shù),用R的aov函數(shù)對(duì)α多樣性指數(shù)進(jìn)行單因素方差分析;用R的mixOmics包進(jìn)行有監(jiān)督判別分析,對(duì)不同放牧強(qiáng)度處理的組間差異進(jìn)行分析,并進(jìn)行可視化;使用R的Hmisc包進(jìn)行所有處理OTU的相關(guān)分析,保留大于0.6的相關(guān)關(guān)系,用Gephi可視化真菌共生網(wǎng)絡(luò)并計(jì)算模塊性,并將真菌模塊的相對(duì)豐度與環(huán)境因子進(jìn)行相關(guān)性分析;用R的pacman包進(jìn)行環(huán)境因子的篩選,將真菌門(mén)分類水平下的相對(duì)豐度用篩選出的環(huán)境因子進(jìn)行冗余分析(redundancy analysis,RDA),并將預(yù)測(cè)因子進(jìn)行分類,對(duì)真菌群落結(jié)構(gòu)變化進(jìn)行方差分解(variance partitioning analysis,VPA)。用R的ggplot 2包可視化真菌的群落組成與真菌模塊結(jié)構(gòu);用R的aov函數(shù)對(duì)各模塊的相對(duì)豐度進(jìn)行單因素方差分析,用TukeyHSD函數(shù)進(jìn)行多重比較,并可視化。
2 結(jié)果與分析
2.1 不同放牧強(qiáng)度對(duì)環(huán)境因子的影響
由表1可知,短期放牧處理下放牧強(qiáng)度間植物群落特征差異比土壤性質(zhì)更大,植物多樣性隨放牧強(qiáng)度的增加而增加,中度與重度放牧顯著增加了植物群落多樣性(P<0.05);均勻度呈現(xiàn)相似的變化規(guī)律,但僅有重度放牧相比于對(duì)照顯著增加了植物均勻度;放牧?xí)黾又参锶郝涞牡厣蟽舫跫?jí)生產(chǎn)力,并且輕度與中度放牧強(qiáng)度顯著增加了植物群落的生產(chǎn)力,中度放牧的草地生產(chǎn)力最高。不同放牧強(qiáng)度的土壤容重存在顯著差異,輕度放牧與重度放牧顯著降低了土壤容重;土壤化學(xué)性質(zhì)方面,放牧強(qiáng)度增加使土壤速效磷含量升高,并且重度放牧與對(duì)照相比顯著增加;土壤pH在不同放牧強(qiáng)度間具有顯著差異,放牧活動(dòng)使土壤酸性增強(qiáng),中度放牧的土壤pH值最小,顯著小于對(duì)照組和輕度放牧。

表1 不同放牧強(qiáng)度對(duì)環(huán)境因子的影響Table 1 Effect of different grazing intensities on environmental factors
2.2 不同放牧強(qiáng)度對(duì)土壤真菌群落的影響
2.2.1土壤真菌群落的組成 結(jié)果表明,土壤真菌群落主要由子囊菌門(mén)(Ascomycota)、擔(dān)子菌門(mén)(Basidiomycota)和 接 合 菌 門(mén)(Zygomycota)組 成,還 包 括 少 量 的 球 囊 菌 門(mén)(Glomeromycota)、隱 真 菌 門(mén)(Rozellomycota)和壺菌門(mén)(Chytridiomycota);其中土壤中子囊菌門(mén)數(shù)量最多,輕度、中度、重度的相對(duì)豐度比對(duì)照分別增加了31.05%、7.69%、40.53%;而作為土壤真菌群落另一主要組成成分,擔(dān)子菌門(mén)在輕度、中度、重度的相對(duì)豐度比對(duì)照組分別降低了37.34%、17.10%、47.42%。測(cè)序結(jié)果還包含了原生生物纖毛蟲(chóng)門(mén)(Ciliophora)和絲足蟲(chóng)門(mén)(Cercozoa)與植物界的被子門(mén)(Anthophyta),但其相對(duì)豐度值較低,不影響土壤真菌的整體群落結(jié)構(gòu)(圖1)。
2.2.2土壤真菌群落的α多樣性 土壤真菌群落的α多樣性指數(shù)在不同放牧強(qiáng)度中均無(wú)顯著差異(表2)。Chao1豐富度指數(shù)利用群落中檢測(cè)到1和2次的OTU數(shù)估算群落的物種數(shù)。Chao1豐富度指數(shù)隨放牧強(qiáng)度呈現(xiàn)先增加后減少的趨勢(shì),輕度放牧的豐富度最高,中度放牧與重度放牧的土壤真菌Chao1豐富度指數(shù)值大致相同。放牧處理同樣具有土壤真菌多樣性增加的趨勢(shì),但重度放牧的Shannon多樣性指數(shù)最大,其多樣性最高。
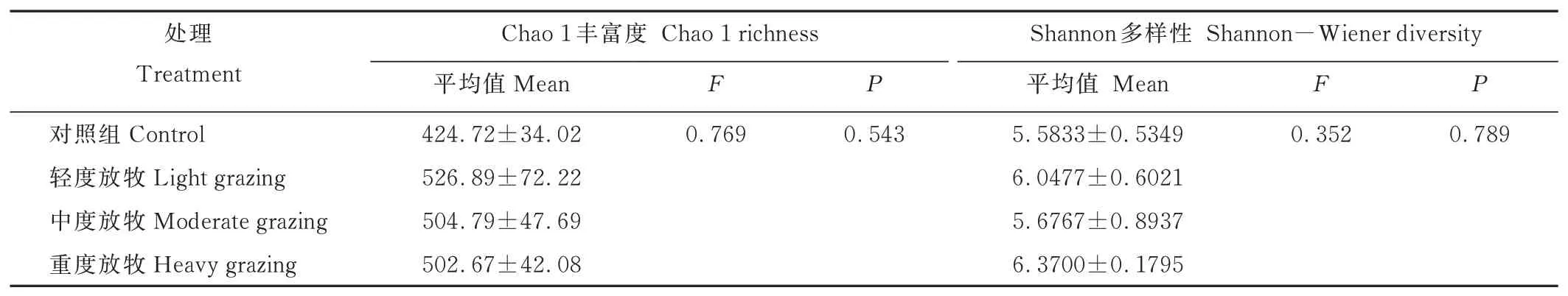
表2 不同放牧強(qiáng)度土壤真菌群落α多樣性的單因素方差分析結(jié)果Table 2 Results of One-way ANOVA analysis of soil fungal community α diversity at different grazing intensities
2.2.3土壤真菌群落的組間差異分析 結(jié)果表明,偏最小二乘法判別分析(partial least squares discrimination analysis,PLS-DA)的兩個(gè)坐標(biāo)軸的解釋度分別為11.5%和11.6%;其中對(duì)照組和重度放牧兩個(gè)處理的組內(nèi)各樣本距離近,組內(nèi)重復(fù)效果好;中度放牧與對(duì)照組距離最近,其對(duì)土壤真菌群落結(jié)構(gòu)的影響最小,重度放牧對(duì)土壤真菌群落的影響最為明顯。對(duì)照組處于排序的中間位置,可見(jiàn)不同的放牧強(qiáng)度對(duì)土壤真菌群落結(jié)構(gòu)的影響是不同的(圖2)。
2.3 土壤真菌群落共現(xiàn)網(wǎng)絡(luò)
基于真菌群落OTU數(shù)據(jù)相關(guān)性構(gòu)建了共現(xiàn)網(wǎng)絡(luò)圖,共得到了308個(gè)節(jié)點(diǎn)、3078條邊的真菌網(wǎng)絡(luò)結(jié)構(gòu)。對(duì)真菌網(wǎng)絡(luò)進(jìn)行模塊劃分后,得到模塊化值為0.936的模塊網(wǎng)絡(luò),并劃分為4個(gè)主要的模塊。模塊1包含OTUs種類最多,共有94個(gè)節(jié)點(diǎn),占網(wǎng)絡(luò)總數(shù)的30.52%;其次為模塊2,共有84個(gè)節(jié)點(diǎn),占網(wǎng)絡(luò)總節(jié)點(diǎn)數(shù)的27.27%;模塊3由57個(gè)節(jié)點(diǎn)組成,占網(wǎng)絡(luò)總節(jié)點(diǎn)數(shù)的18.51%;模塊4包含了27個(gè)節(jié)點(diǎn),占網(wǎng)絡(luò)總數(shù)的8.77%。其中模塊2節(jié)點(diǎn)連通度高,和其他節(jié)點(diǎn)的相互作用更強(qiáng),對(duì)真菌群落的影響更加強(qiáng)烈(圖3A)。
子囊菌門(mén)作為土壤中主要的真菌類群,也是4個(gè)模塊的主要組成部分。作為組成種類最豐富的模塊,模塊1的子囊菌門(mén)真菌由52種OTUs組成,其在模塊1的相對(duì)豐度為56.09%;而擔(dān)子菌門(mén)的相對(duì)豐度為41.37%,包括31個(gè)OTUs種類,是各個(gè)模塊中擔(dān)子菌門(mén)相對(duì)豐度最高的模塊。模塊2未能識(shí)別的真菌豐度增加;但其主要組成類群子囊菌門(mén)的相對(duì)豐度為59.51%,由46種真菌組成;擔(dān)子菌門(mén)包含了16種真菌,在模塊2的相對(duì)豐度為12.56%。模塊3則基本由子囊菌門(mén)組成,其子囊菌門(mén)包括了25種OTUs,相對(duì)豐度則為82.51%。模塊4是4個(gè)主要模塊結(jié)構(gòu)最簡(jiǎn)單的,其子囊菌門(mén)的相對(duì)豐度也是4個(gè)模塊中最少的(33.13%),僅包含11種OTUs;擔(dān)子菌門(mén)的相對(duì)豐度為17.45%,由9個(gè)真菌種組成;模塊4的接合菌門(mén)相對(duì)豐度相對(duì)于其他模塊明顯增加,雖然只包含2種OTUs,但其相對(duì)豐度為18.54%(圖3B)。
2.4 不同放牧強(qiáng)度對(duì)土壤真菌模塊的影響
模塊1、模塊2與模塊3在不同放牧強(qiáng)度的相對(duì)豐度差異不顯著。模塊1的相對(duì)豐度隨放牧強(qiáng)度呈現(xiàn)先增加后減少的趨勢(shì),模塊1的輕度放牧相對(duì)豐度最高;模塊3的放牧處理相對(duì)豐度均高于對(duì)照處理,并隨著放牧強(qiáng)度的增加呈現(xiàn)逐漸增大的趨勢(shì);雖然模塊4的相對(duì)豐度最少,但其對(duì)于放牧強(qiáng)度的響應(yīng)最強(qiáng)烈,模塊4的重度放牧相對(duì)豐度顯著高于(P<0.1)對(duì)照組,而輕度放牧和中度放牧與對(duì)照差異不顯著,與重度放牧差異也不顯著(圖4)。
2.5 土壤真菌與環(huán)境因子的關(guān)系
2.5.1環(huán)境因子對(duì)真菌群落的影響 通過(guò)對(duì)環(huán)境因子進(jìn)行共線性排除與模型篩選,選擇植物群落Shannon-Wiener多樣性指數(shù)和土壤化學(xué)性質(zhì)全磷、全鉀、速效磷以及速效鉀作為真菌門(mén)分類水平的預(yù)測(cè)因子進(jìn)行冗余分析,第一、二解釋軸的解釋度分別為43.67%和25.02%,組成真菌群落的主要類群子囊菌門(mén)受土壤速效磷與植物群落多樣性的影響,擔(dān)子菌門(mén)則與土壤全鉀和速效鉀呈正相關(guān)關(guān)系(圖5A)。進(jìn)一步對(duì)真菌群落結(jié)構(gòu)進(jìn)行方差分解后發(fā)現(xiàn),土壤因子對(duì)真菌類群變化的解釋度更高,其排除植物因子的解釋度為39.1%,而植物因子排除土壤的解釋度為4.9%(圖5B)。
2.5.2環(huán)境因子與真菌模塊間的關(guān)系 由圖6可知,植物群落特征與各真菌模塊相關(guān)性較弱,作為真菌群落的主要組成類群,模塊1與模塊2對(duì)環(huán)境因子的響應(yīng)是相反的,均受到土壤全磷與全鉀的顯著影響,土壤的全磷與全鉀含量與模塊1的相對(duì)豐度呈顯著正相關(guān),與模塊2顯著負(fù)相關(guān)。模塊3是受土壤性質(zhì)影響最多的真菌類群,與堿解氮、速效磷等土壤速效養(yǎng)分呈顯著正相關(guān),也受到土壤物理性質(zhì)的影響,與土壤含水率極顯著正相關(guān),與土壤容重極顯著負(fù)相關(guān)。模塊4受環(huán)境影響相對(duì)較小,僅與土壤全鉀呈顯著負(fù)相關(guān)。
3 討論
3.1 短期處理下放牧強(qiáng)度對(duì)土壤真菌群落結(jié)構(gòu)的影響
多年禁牧試驗(yàn)表明放牧通過(guò)提高堿性土壤pH和土壤溫度增加青藏高原土壤真核生物的多樣性與豐富度[16];但也有研究表明放牧強(qiáng)度對(duì)真菌群落的影響是通過(guò)提高子囊菌門(mén)的相對(duì)豐度,進(jìn)而通過(guò)競(jìng)爭(zhēng)排斥的過(guò)程間接降低真菌豐富度與多樣性[26]。通過(guò)對(duì)短期放牧不同強(qiáng)度真菌群落的組成和結(jié)構(gòu)進(jìn)行比較發(fā)現(xiàn),放牧處理均增加了土壤中子囊菌門(mén)的相對(duì)豐度,但真菌豐富度和多樣性均呈現(xiàn)大于對(duì)照組的趨勢(shì),與之前的研究結(jié)果并不完全相同。本研究各處理間的α多樣性指數(shù)統(tǒng)計(jì)學(xué)差異不顯著,其可能的原因是高寒牧場(chǎng)的土壤性質(zhì)與微生物群落對(duì)短期放牧強(qiáng)度梯度處理具有較強(qiáng)的抵抗力[27];另一方面,由于試驗(yàn)區(qū)域較大從而導(dǎo)致土壤微生物空間異質(zhì)性較高。
本研究結(jié)果表明,土壤因子解釋了真菌群落變異的39.1%,是真菌群落變化的主要驅(qū)動(dòng)因子,與之前的研究結(jié)果相似[14-15]。作為研究區(qū)土壤真菌的主要組成部分,放牧處理的子囊菌門(mén)相比于對(duì)照組均有不同程度的增加,輕度放牧與重度放牧的子囊菌門(mén)相對(duì)豐度明顯增加,與楊文高[28]在牦牛糞便分解試驗(yàn)中牛糞分解增加子囊菌門(mén)豐度的結(jié)果一致。子囊菌門(mén)是牛糞分解過(guò)程中的主導(dǎo)類群,其在牛糞分解過(guò)程中分泌大量的纖維素與半纖維素分解酶,并利用牛糞中的有機(jī)質(zhì)與營(yíng)養(yǎng)成分[29],同時(shí)放牧使植物與牛糞碎屑等混入土壤中,使土壤中的纖維素含量增加。此外,子囊菌門(mén)的底物具有廣譜性,通過(guò)不穩(wěn)定碳激活后,可以利用有機(jī)碳等天然穩(wěn)定結(jié)構(gòu)作為底物[30],因而放牧活動(dòng)過(guò)程中家畜排泄的不穩(wěn)定碳可能進(jìn)一步促進(jìn)子囊菌門(mén)對(duì)有機(jī)質(zhì)的利用。并且子囊菌門(mén)與植物多樣性呈正相關(guān),放牧強(qiáng)度增加引起的植物多樣性增加,從而增加根系分泌物的種類[31],進(jìn)一步促進(jìn)子囊菌門(mén)對(duì)有機(jī)質(zhì)的利用。土壤氮磷循環(huán)具有強(qiáng)烈的相互作用,土壤磷可以促進(jìn)氮的礦化[32],提高土壤的有效氮進(jìn)而改變微生物群落。土壤微生物相比于植物來(lái)說(shuō)生長(zhǎng)速度更快,其遺傳結(jié)構(gòu)對(duì)磷有更高的需求,因此土壤微生物比植物更容易受到磷的限制[33]。子囊菌門(mén)相比于擔(dān)子菌門(mén)的生長(zhǎng)速度更快[34],放牧處理土壤中較高的磷含量為其快速繁殖提供了條件。相反,擔(dān)子菌門(mén)的相對(duì)豐度在各放牧處理均降低,對(duì)環(huán)境擾動(dòng)的抵御能力低于子囊菌門(mén),其可能原因是擔(dān)子菌門(mén)是主要以木質(zhì)素為底物的寡養(yǎng)性真菌[35],放牧活動(dòng)使其底物濃度降低。此外,土壤的物理結(jié)構(gòu)決定了真菌的群落結(jié)構(gòu),擔(dān)子菌門(mén)真菌的菌絲體結(jié)構(gòu)簡(jiǎn)單,菌絲分枝角較小,菌絲節(jié)間長(zhǎng),菌絲體內(nèi)部孔隙較少;而作為土壤中另一類主要的真菌類群,子囊菌門(mén)菌絲體的孔隙率高,對(duì)空間的侵占能力更強(qiáng)[36]。本研究中,輕度放牧和重度放牧的土壤表層容重顯著低于對(duì)照組,土壤孔隙度的增加為子囊菌門(mén)提供了更有利的繁殖條件。
3.2 土壤真菌的共現(xiàn)網(wǎng)絡(luò)及其模塊
微生物網(wǎng)絡(luò)模塊的形成主要有兩個(gè)原因,一是環(huán)境因子對(duì)微生物的選擇使模塊類群具有不同于其他模塊的生態(tài)位,二是模塊類群中的微生物具有較強(qiáng)的相互作用[37]。微生物群落實(shí)現(xiàn)其功能有兩種不同的形式,較高的微生物豐富度造成較大的功能冗余以確保單個(gè)功能;或較高的微生物豐富度形成較大的功能多樣性,從而同時(shí)支持多個(gè)功能[38-39]。本研究的真菌共現(xiàn)網(wǎng)絡(luò)根據(jù)真菌類群的相互作用劃分為4個(gè)主要的模塊,由于其組成結(jié)構(gòu)復(fù)雜,加上短期放牧對(duì)土壤性質(zhì)影響較小,放牧強(qiáng)度對(duì)模塊1、2、3的影響不顯著;模塊4的相對(duì)豐度最小且組成分類更豐富,對(duì)土壤條件變化敏感,重度放牧的相對(duì)豐度顯著高于對(duì)照組,表明模塊豐度越高(模塊結(jié)構(gòu)越復(fù)雜),抵抗外界干擾的能力越強(qiáng)。Hernandez等[37]得到的微生物群落網(wǎng)絡(luò)沿脅迫梯度模塊化程度降低的結(jié)果,表明高脅迫環(huán)境的模塊結(jié)構(gòu)更少,即模塊結(jié)構(gòu)越大對(duì)外界脅迫的抵抗能力越強(qiáng)。這是由于網(wǎng)絡(luò)中各類群間的聯(lián)系是有限的,模塊結(jié)構(gòu)能夠維持其內(nèi)部微生物類群豐度波動(dòng)的影響不擴(kuò)散到其他模塊[40]。
通過(guò)探究各模塊的相對(duì)豐度與環(huán)境因子間的相關(guān)關(guān)系發(fā)現(xiàn),植物群落特性對(duì)真菌模塊的相對(duì)豐度的影響較小,影響各模塊豐度的主要因素仍為土壤性質(zhì)。與環(huán)境因子對(duì)真菌群落結(jié)構(gòu)的影響結(jié)果相同,土壤全磷和全鉀對(duì)模塊的相對(duì)豐度影響更強(qiáng)。尹亞麗等[41]研究表明土壤全鉀對(duì)真菌群落的影響并不顯著;與之不同的是本研究將真菌群落進(jìn)行類群劃分發(fā)現(xiàn),模塊1與土壤全鉀呈極顯著正相關(guān),而其他3個(gè)模塊與土壤全鉀呈負(fù)相關(guān)。其可能的原因是模塊1真菌的主要營(yíng)養(yǎng)方式為營(yíng)腐生,其他類群的腐生菌類群豐度降低,Peng等[42]研究幾種腐生菌發(fā)現(xiàn),鉀離子通過(guò)定殖在植物上的真菌促進(jìn)植物生長(zhǎng)。不同于Xu等[43]得到的土壤速效磷與微生物量磷呈負(fù)相關(guān)的結(jié)果,本試驗(yàn)真菌模塊對(duì)土壤磷的響應(yīng)大不相同,模塊1與土壤全磷顯著正相關(guān),模塊2與全磷顯著負(fù)相關(guān),這是因?yàn)橥寥廊讓?duì)真菌的影響是通過(guò)與其共生的植物實(shí)現(xiàn)的[19]。但由于不同放牧強(qiáng)度間土壤全磷差異不顯著,土壤真菌模塊1與模塊2對(duì)不同放牧強(qiáng)度的響應(yīng)也不顯著。本研究的模塊1與模塊2是構(gòu)成真菌群落的主要類群,二者相對(duì)豐度對(duì)環(huán)境因子的響應(yīng)是相反的,造成這一結(jié)果的可能原因是同一模塊占據(jù)相同的生態(tài)位,親緣關(guān)系相近的真菌利用相同的底物,功能也趨于一致。放牧活動(dòng)對(duì)土壤容重有直接的影響,以往的研究表明土壤容重可以通過(guò)影響土壤孔隙度和土壤溫濕度進(jìn)而改變微生物的群落,使微生物群落與土壤容重呈負(fù)相關(guān)[44]。土壤容重變小使其孔隙度增大[45],真菌擁有活躍的菌絲,能夠隨環(huán)境的變化與刺激改變其形態(tài)[46],土壤容重變小為真菌菌絲的生長(zhǎng)提供了空間。本研究?jī)H有模塊3的相對(duì)豐度與土壤物理性質(zhì)存在顯著相關(guān)關(guān)系,并且模塊3與堿解氮、速效磷等速效養(yǎng)分呈正相關(guān),其可能的原因是該類群的組成單一,對(duì)環(huán)境因子敏感[47];模塊4的真菌相對(duì)豐度最小,但其組成分類更豐富,模塊3與模塊4的組成與結(jié)構(gòu)差異及其對(duì)不同放牧強(qiáng)度的響應(yīng)表明,親緣關(guān)系較遠(yuǎn)的真菌模塊具有更高的模塊內(nèi)關(guān)聯(lián)復(fù)雜性,因而對(duì)環(huán)境變化具有更強(qiáng)的抵抗力,但這與Wagg等[38]得到的結(jié)果相反。
4 結(jié)論
短期放牧處理可增加土壤真菌群落的多樣性與豐富度,但空間異質(zhì)性與放牧歷時(shí)較短使得不同放牧強(qiáng)度的真菌群落結(jié)構(gòu)差異不顯著。土壤因子是不同放牧強(qiáng)度土壤真菌群落變化的主要驅(qū)動(dòng)因子,放牧處理通過(guò)牛糞返還增加土壤中的不穩(wěn)定碳和改變土壤孔隙兩個(gè)方面提高子囊菌門(mén)的相對(duì)豐度,競(jìng)爭(zhēng)排斥作用使放牧處理的擔(dān)子菌門(mén)相對(duì)豐度減少。通過(guò)共現(xiàn)網(wǎng)絡(luò)模塊化分析將土壤真菌分為不同的模塊類群發(fā)現(xiàn),真菌各物種間的相互作用使真菌群落構(gòu)成不同的模塊類群,但土壤因子仍是真菌相互作用類群變化的主要預(yù)測(cè)因子。

