過渡態(tài)理論速率系數(shù)與標(biāo)準態(tài)和熱力學(xué)函數(shù)*
郭思宇,孫 如,徐敏敏,李淑瑾
(蘇州大學(xué)材料與化學(xué)化工學(xué)部,江蘇 蘇州 215123)
在20 世紀前葉,簡單碰撞理論和過渡態(tài)理論這兩個反應(yīng)速率理論是化學(xué)動力學(xué)發(fā)展史上的重要里程碑。在統(tǒng)計力學(xué)和量子力學(xué)的基礎(chǔ)上建立的反應(yīng)速率理論,英國化學(xué)家波蘭尼(Michanel Poanyi)稱之為過渡態(tài)理論,而美國化學(xué)家艾林(Henry Eyring)將其稱為活化絡(luò)合物理論。過渡態(tài)或活化絡(luò)合物是反應(yīng)系統(tǒng)勢能面上的馬鞍點,可借助于量子力學(xué)理論計算出。只要知道過渡態(tài)的結(jié)構(gòu),可以根據(jù)光譜數(shù)據(jù)用統(tǒng)計力學(xué)的方法,不需要通過化學(xué)動力學(xué)實驗就能計算出反應(yīng)速率系數(shù)的理論值, 所以又稱為絕對反應(yīng)速率理論[1-2]。
化學(xué)動力學(xué)過渡態(tài)理論中有一基本假設(shè) “由反應(yīng)物分子變成生成物分子,中間要經(jīng)過一個過渡態(tài), 而形成這個過渡態(tài)需要一定的活化能,過渡態(tài)與反應(yīng)物之間建立化學(xué)平衡”[1]。用熱力學(xué)方法推導(dǎo)過渡態(tài)速率系數(shù)時,涉及過渡態(tài)與反應(yīng)物之間化學(xué)平衡的熱力學(xué)平衡常數(shù),而熱力學(xué)平衡常數(shù)與熱力學(xué)標(biāo)準狀態(tài)有關(guān)。各種物理化學(xué)教材在化學(xué)熱力學(xué)部分都有較詳細熱力學(xué)標(biāo)準態(tài)的敘述。用熱力學(xué)方法推導(dǎo)過渡態(tài)理論的化學(xué)反應(yīng)速率系數(shù)時選擇標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài)得到準平衡常數(shù)[1,3]。在化學(xué)動力學(xué)中,常用反應(yīng)物質(zhì)的濃度(mol/dm3)隨時間的變化率來表示化學(xué)反應(yīng)的速率,而在氣相化學(xué)反應(yīng)中,壓力比濃度容易測定,所以經(jīng)常用反應(yīng)物質(zhì)的壓力(Pa或者kPa)隨時間的變化率來表示化學(xué)反應(yīng)的速率,同一化學(xué)反應(yīng),由于化學(xué)反應(yīng)速率的表示不同,則會帶來反應(yīng)速率系數(shù)的不同。
隨著量子化學(xué)計算在化學(xué)反應(yīng)動力學(xué)中的應(yīng)用,過渡態(tài)理論使化學(xué)動力學(xué)研究進入一個嶄新的階段。用量子化學(xué)方法可計算反應(yīng)系統(tǒng)的勢能面,得到摩爾活化熱力學(xué)函數(shù)值是以標(biāo)準壓力p(105pa)為標(biāo)準狀態(tài)的,用過渡態(tài)理論計算速率系數(shù),如取標(biāo)準濃度c(1 mol/dm3)為標(biāo)準態(tài),則兩種標(biāo)準狀態(tài)下的摩爾活化熱力學(xué)函數(shù)則不盡相同,需要換算。本文選以理想氣體反應(yīng)為例用熱力學(xué)方法推導(dǎo)了兩種標(biāo)準態(tài)下(標(biāo)準濃度c和標(biāo)準壓力p)過渡態(tài)理論反應(yīng)速率系數(shù)及摩爾活化熱力學(xué)函數(shù)(如摩爾活化吉布斯自由能、摩爾活化化熵等)相互之間的關(guān)系,并用量子化學(xué)計算研究案例討論了兩種標(biāo)準態(tài)下結(jié)果之間的轉(zhuǎn)換。這些結(jié)果對常見物理化學(xué)教材過渡態(tài)理論部分忽略之處給予了補充,有利于物理化學(xué)過渡態(tài)理論的教學(xué)和加深其應(yīng)用的理解。
1 兩種熱力學(xué)標(biāo)準態(tài)下的過渡態(tài)理論速率系數(shù)
過渡態(tài)理論認為化學(xué)反應(yīng)中反應(yīng)物通過形成過渡態(tài)(TS≠)而成為生成物,過渡態(tài)與反應(yīng)物之間很快達成并保持熱力學(xué)平衡,這為認識化學(xué)反應(yīng)奠定了理論基礎(chǔ)。過渡態(tài)也稱活化絡(luò)合物,它是反應(yīng)系統(tǒng)勢能面反應(yīng)坐標(biāo)上的馬鞍點。過渡態(tài)的壽命是極短的,目前研究過渡態(tài)物種的實驗手段有吸收與發(fā)射光譜、激光光電子能譜和實時飛秒檢測等。量子化學(xué)計算可獲得過渡態(tài)的諧振動頻率、幾何構(gòu)型和反應(yīng)的熱力學(xué)函數(shù)值等。用統(tǒng)計熱力學(xué)方法可以根據(jù)過渡態(tài)理論的基本假設(shè)推導(dǎo)出兩種熱力學(xué)標(biāo)準態(tài)下反應(yīng)的速率系數(shù)。
1.1 標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài)的過渡態(tài)理論速率系數(shù)
在物理化學(xué)教材中,用標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài)的速率系數(shù)與活化熱力學(xué)函數(shù)的關(guān)系式為式(1)或式(2)[1]:
(1)
(2)
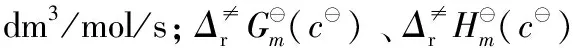
1.2 標(biāo)準壓力p(105 Pa)為熱力學(xué)標(biāo)準狀態(tài)的過渡態(tài)理論速率系數(shù)
用熱力學(xué)方法推導(dǎo)過渡態(tài)理論速率常數(shù),根據(jù)過渡態(tài)理論的基本假設(shè)之一,活化絡(luò)合物和反應(yīng)物之間存在快平衡,該反應(yīng)的準熱力學(xué)平衡常數(shù)與反應(yīng)物質(zhì)熱力學(xué)標(biāo)準態(tài)的化學(xué)勢有關(guān)。
1.2.1 兩種熱力學(xué)標(biāo)準狀態(tài)下標(biāo)準化學(xué)勢之間的關(guān)系
設(shè)理想氣體混合物中任意一組分B,其濃度為cB(mol/dm3),壓力為pBPa。
在溫度T時,選標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài),則該組分B的化學(xué)勢μB表示為式(3):
(3)
若選標(biāo)準壓力p(105pa)為熱力學(xué)標(biāo)準態(tài),則該組分B的化學(xué)勢μB表示為式(4):
(4)
對于理想氣體,用SI制單位,則pB與cB的關(guān)系為式(5):
pB=cBRT×103
(5)
將式(5)代入式(4)整理后得式(6):
(6)
化學(xué)勢μB是狀態(tài)函數(shù),與熱力學(xué)標(biāo)準態(tài)的選擇無關(guān),比較式(3)和式(6)可得式(7):
(7)
式(7)為在溫度T時標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài)的化學(xué)勢和標(biāo)準壓力p(105pa)為熱力學(xué)標(biāo)準態(tài)之間的關(guān)系。物理化學(xué)教材[1]中也給出了兩種標(biāo)準態(tài)化學(xué)勢之間的關(guān)系式,但忽略了物理量之間單位的換算,式(7)則考慮了物理量之間單位的換算。
1.2.2 兩種熱力學(xué)標(biāo)準狀態(tài)下標(biāo)準摩爾活化Gibbs自由能之間的關(guān)系
根據(jù)熱力學(xué)標(biāo)準吉布斯自由能變化值與標(biāo)準化學(xué)勢之間的關(guān)系,在過渡態(tài)理論中,化學(xué)反應(yīng)體系過渡態(tài)與反應(yīng)物之間在兩種熱力學(xué)標(biāo)準狀態(tài)下標(biāo)準活化Gibbs自由能分別可表示為式(8)和式(9):
(8)
(9)
對于單分子氣相化學(xué)反應(yīng)ABC → AB+C 或者雙分子氣相化學(xué)反應(yīng)A+BC → AB+C,根據(jù)過渡態(tài)理論基本假定,它們的機理分別為(i)或(ii):
(i)
或
(ii)
在反應(yīng)機理(i)中,∑vB=0;而在反應(yīng)機理(ii)中∑vB=-1。用n代表反應(yīng)物的分子數(shù),則機理(i)和機理(ii)的∑vB=1-n。
整理式(7)、(8)和(9)三式,得式(10):
(10)
1.2.3 標(biāo)準壓力p(105Pa)為熱力學(xué)標(biāo)準狀態(tài)的過渡態(tài)理論速率系數(shù)
式(1)為大家熟知的標(biāo)準濃度c(1 mol/dm3)為熱力學(xué)標(biāo)準態(tài)的速率系數(shù),將式(10)代入式(1),則有:
(11)
在化學(xué)反應(yīng)動力學(xué)中,用壓力表示的速率系數(shù)kp[(Pa)1-n/s1]與濃度表示的速率系數(shù)k[(mol·dm-3)1-n/s]之間的關(guān)系為:
kp=k(RT×103)1-n
(12)
將式(12)代入式(11),則有:
(13)
式(13)是選擇標(biāo)準壓力p為熱力學(xué)標(biāo)準態(tài)時過渡態(tài)理論速率系數(shù)的計算公式,與文獻[4]的結(jié)論一致。
2 兩種熱力學(xué)標(biāo)準態(tài)下標(biāo)準摩爾活化焓、標(biāo)準摩爾活化熵之間的關(guān)系
2.1 兩種熱力學(xué)標(biāo)準態(tài)下標(biāo)準摩爾活化焓
在式(10)兩邊除T后 對T偏微分,則有:
(14)
根據(jù)吉布斯-亥姆霍茲(Gibbs-Helmholtz)方程,則得到兩種熱力學(xué)標(biāo)準態(tài)下標(biāo)準摩爾活化焓的關(guān)系式(15):
(15)
2.2 兩種熱力學(xué)標(biāo)準態(tài)下標(biāo)準摩爾活化熵
在式(10)兩邊對T偏微分,則有式(16):
(16)
由熱力學(xué)基本方程式可得式(17):
(17)
3 過渡態(tài)理論速率系數(shù)研究案例
以我們課題組研究反式白藜蘆醇(ROH)修復(fù)2′-脫氧鳥苷自由基[10]中的部分結(jié)果為案例,說明過渡態(tài)理論在研究反應(yīng)體系動力學(xué)方面的應(yīng)用。在研究修復(fù)反應(yīng)系統(tǒng)時運用量子化學(xué)密度泛函理論(DFT) 計算獲得了修復(fù)反應(yīng)系統(tǒng)中反應(yīng)物、過渡態(tài)的優(yōu)化構(gòu)型、各反應(yīng)機理的吉布斯自由能壘,在此基礎(chǔ)上運用過渡態(tài)理論計算了各反應(yīng)的速率系數(shù),揭示主要反應(yīng)機理,確定了主要修復(fù)位點。用過渡態(tài)理論計算得到的修復(fù)反應(yīng)速率常數(shù)與實驗上多酚化合物修復(fù)脫氧鳥苷自由基的速率常數(shù)(108~109dm3/mol/s)一致。
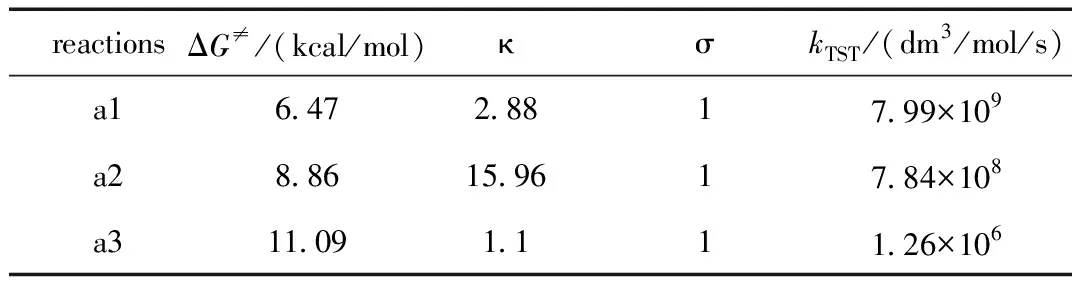
表1 反應(yīng)吉布斯自由能壘ΔG≠, 隧道校正因子κ,反應(yīng)路徑簡并度σ和在1 mol/dm3標(biāo)準狀態(tài)下的速率系數(shù)kTSTTable 1 Gibbs Free Energy Barriers ΔG≠,the tunneling correction κ, the reaction path degeneracy σ and the rate constants kTST at 1 mol/dm3 standard state
在用過渡態(tài)理論計算速率系數(shù)時,涉及到了兩種熱力學(xué)標(biāo)準狀態(tài)下反應(yīng)吉布斯自由能壘ΔG≠之間的換算關(guān)系式(10)。在298.15 K時,以苯為非極性溶劑模型中ROH通過氫轉(zhuǎn)移(HT)機理修復(fù)2′-脫氧鳥苷堿基脫氫自由基的主要修復(fù)反應(yīng)在文獻[10]中標(biāo)記為a1、a2和a3。表1歸納了文獻[10]中a1~a3反應(yīng)吉布斯自由能壘(ΔG≠)、隧道效應(yīng)校正因子(κ)、反應(yīng)路徑簡并度(σ)和在1 mol/dm3標(biāo)準狀態(tài)下過渡態(tài)理論的速率系數(shù)kTST。
在實際應(yīng)用過渡態(tài)理論計算反應(yīng)的速率系數(shù)時,考慮了反應(yīng)的隧道效應(yīng)校正因子(κ)和反應(yīng)路徑簡并度(σ), 則式(1)修正為式(18):
(18)
在式(18)中,吉布斯自由能壘ΔG≠的熱力學(xué)標(biāo)準態(tài)為標(biāo)準濃度c(1 mol/dm3),而用量子化學(xué)計算得到的表1中反應(yīng)吉布斯自由能壘ΔG≠的熱力學(xué)標(biāo)準態(tài)為標(biāo)準壓力p,因此不能用表1中的ΔG≠代入式(18)計算速率系數(shù)。
標(biāo)準濃度c和標(biāo)準壓力p的兩熱力學(xué)標(biāo)準態(tài)的反應(yīng)吉布斯自由能壘斯需根據(jù)式(10)進行換算。以表1中反應(yīng)a1為例, 兩者之間的換算為:ΔG≠(c)=ΔG≠(p) -1.90=4.57 kcal/mol,將ΔG≠(c)代入式(18),則可計算得到kTST=7.99×109dm3/mol/s。依次類推根據(jù)式(18)可以計算出反應(yīng)a2和a3的kTST。
過渡態(tài)速率理論在化學(xué)動力學(xué)研究中有很廣泛的應(yīng)用,理解兩種熱力學(xué)標(biāo)準狀態(tài)下過渡態(tài)理論的速率系數(shù)及標(biāo)準摩爾活化熱力學(xué)函數(shù)之間的關(guān)系顯得尤為重要。
4 結(jié) 語
通過上述討論可知,標(biāo)準摩爾活化吉布斯自由能、標(biāo)準摩爾活化焓和標(biāo)準摩爾活化熵是與熱力學(xué)標(biāo)準態(tài)有關(guān)的物理量,基于過渡態(tài)理論的基本假定,我們較為詳細地用熱力學(xué)方法導(dǎo)出了兩種熱力學(xué)標(biāo)準態(tài)下過渡態(tài)理論速率系數(shù)公式、標(biāo)準摩爾活化吉布斯自由能、標(biāo)準摩爾活化焓和標(biāo)準摩爾活化熵之間的關(guān)系。本文是對物理化學(xué)教材中熱力學(xué)方法處理過渡態(tài)理論內(nèi)容的補充,有助于對過渡態(tài)理論的理解和應(yīng)用。

