膜解剖技術在胃癌根治術中應用的效果分析
莫波 王佩 童宜欣 何志軍 梁俊 郝志楠
胃癌是臨床上最常見的惡性腫瘤之一,其中相當部分的胃癌病人發現時已為進展期,預后較差[1-2]。D2根治術是目前治療胃癌的標準術式,但是術后復發率較高,影響預后生存[3]。膜解剖(membrane anatomy)是近年來興起的腫瘤外科新理論[4-5]。膜解剖要求在D2根治術的基礎上完整切除胃相關系膜,在保持切除系膜完整性的同時進行淋巴結清掃,減少癌細胞泄露于腹腔的風險,降低術后并發癥的發生[6-7],從而取得更好地腫瘤學根治效果[8-9]。高遷移率族蛋白B1(high mobility group protein B1,hMGB1)是一種重要的促炎性細胞因子,hMGB-1可能與病人手術創傷后恢復狀況有關[10-11]。本文探討胃癌根治術中應用膜解剖對降低并發癥發生的效果。
對象與方法
一、對象
2018年8月~2020年10月我院診治的的胃癌病人146例。納入標準:病理診斷為胃癌,可耐受本研究方案,具有擇期胃癌根治術的指征;年齡20~75歲;胃癌術前分期為Ⅰ期、Ⅱ期、Ⅲa期;認知功能正常者。排除標準:伴有嚴重內科疾病者;心肺功能差、嚴重貧血以至于無法耐受腹腔鏡胃腸手術長時間的氣腹者;合并妊娠、病態肥胖、腸梗阻和嚴重腹腔內粘連者。根據1∶1隨機信封抽簽原則把病人分為膜解剖組與對照組各73例,兩組病人的腫瘤直徑、體重指數、性別、年齡、臨床分期、腫瘤位置、組織學分化等對比,差異無統計學意義(P>0.05)。見表1。本研究獲得醫院倫理委員會批準。
表1 兩組一般資料比較
二、方法
1.治療方法:(1)膜解剖組:在膜解剖理論指導下行腹腔鏡胃癌根治術,在橫結腸中段沿結腸帶向右分離胃結腸韌帶,然后向右側掀開胃網膜右系膜與橫結腸系膜,在胃網膜右動靜脈根部離斷,沿結腸帶向左掀起胃網膜左系膜,并在胃網膜左動靜脈根部結扎離斷,然后依次掀起胃右系膜、胃左系膜、胃后系膜及胃短系膜,并在胃右靜動脈根部、胃左動靜脈根部及胃后血管及胃短血管分支根部分別離斷。分離系膜及離斷血管的過程中,始終保持系膜緣即信封口的完整,從而完成胃全系膜切除及D2淋巴結清掃。遵循以上原則,對于胃竇部腫瘤行遠端胃根治術,針對賁門胃體部腫瘤行全胃切除術。按腫瘤根治術原則,胃切緣距離腫瘤病灶>5 cm,十二指腸及食管切緣大于2 cm,消化道重建均采用Roux-Y吻合。(2)對照組:給予傳統血管導向下行腹腔鏡胃癌D2根治術,手術方式按照參考文獻[10]所述進行。腫瘤病灶切除及重建同膜解剖組。
2.觀察指標:(1)圍手術指標:記錄兩組的手術時間、術中出血量、淋巴結清掃個數、術后排氣時間、術后下床時間與術后住院時間;(2)記錄兩組術后7天出現的并發癥情況,包括切口感染、肺部感染、腹腔出血、吻合口漏等;(3)在術后1天、術后3天、術后7天評 定與記錄病人的疼痛VAS評分,分為0~100分評分,分數越高,疼痛越嚴重;(4)在術后1天、術后3天、術后7天分別向病人抽取2 ml靜脈血,在2小時內將靜脈血置于離心機中離心后,取上層血清保存于-80 ℃冰箱中。采用酶聯免疫法檢測血清hMGB-1的濃度;(5)所有病人均進行隨訪,記錄復發率、死亡率。
三、統計學分析
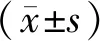
結果
1.圍手術組指標對比:膜解剖組的手術時間、術中出血量、淋巴結清掃個數、術后排氣時間、術后下床時間與術后住院時間少于對照組,差異有統計學意義(P<0.05)。見表2。

表2 兩組圍手術組指標對比
2.并發癥情況對比:膜解剖組術后7天的切口感染、肺部感染、腹腔出血、吻合口漏等并發癥發生率為2.7%,對照組為21.9%,兩組比較,差異有統計學意義(P<0.05)。見表3。
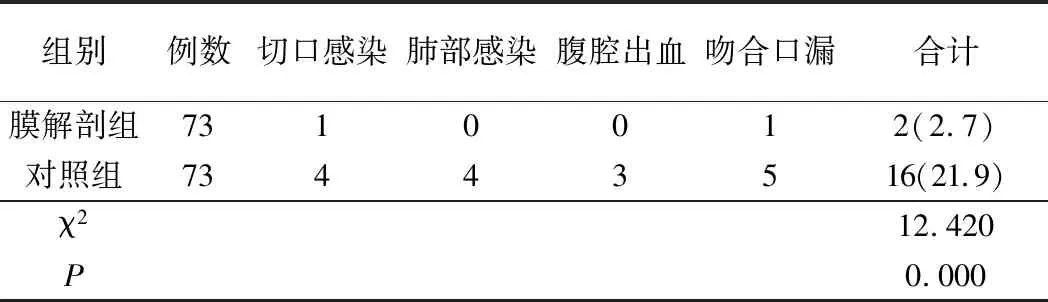
表3 兩組術后并發癥發生率比較(例,%)
3.兩組疼痛評分比較:膜解剖組術后1天、術后3天、術后7天的疼痛VAS評分低于對照組(P<0.05)。見表4。

表4 兩組術后不同時間點疼痛評分比較
4.兩組血清hMGB-1含量比較:膜解剖組術后1天、術后3天、術后7天的血清hMGB-1含量低于對照組,兩組比較,差異有統計學意義(P<0.05)。見表5。
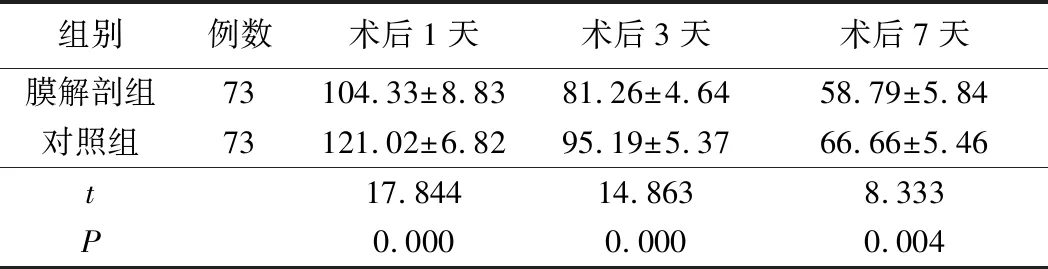
表5 兩組術后不同時間點血清hMGB-1含量比較(μg/L)
5.兩組隨訪情況及預后對比:所有病人隨訪至2021年10月1日,膜解剖組的復發率、死亡率分別為16.4%、8.2%,對照組分別為31.5%和20.5%,兩組比較,差異有統計學意義(P<0.05)。
討論
當前胃癌的發病率、病死率位居消化道腫瘤首位,預后效果不佳的原因主要為術后胃癌復發[13]。現代研究表明,幾乎所有的器官或組織,表面都有解剖的第三元素—吻合口漏膜(主要是筋膜,體腔內者其外還有漿膜)覆蓋,其包繞著器官或組織及其血供,懸掛于體后壁,形成千姿百態的系膜,多躺臥并融合于系膜床[14]。在胃癌病人中,腫瘤的“第五轉移”潛行其內,打破系膜不僅可導致手術過程中出血量增加,而且可導致“第五轉移”從系膜內泄露至手術野,導致術后復發。傳統胃癌根治術重點在淋巴結清掃,而忽略了胃系膜的“整塊切除”。在膜解剖理論指導下行胃癌根治術強調從根部處理血管,層面強調行走在固有筋膜間隙,而非臟層腹膜的剝離,可保持系膜完整性[15]。本研究顯示膜解剖組的手術時間、術中出血量、淋巴結清掃個數、術后排氣時間、術后下床時間與術后住院時間少于對照組;膜解剖組術后7天的切口感染、肺部感染、腹腔出血、吻合口漏等并發癥發生率低于對照組,表明膜解剖在胃癌根治術的應用能有效降低并發癥的發生,減少手術創傷,促進病人康復。
傳統的胃癌D2根治術對胃系膜的創傷比較大,很多病人術后疼痛比較嚴重[16]。膜解剖要求沿著器官組織間系膜與系膜之間的天然間隙去操作,不僅可以最大限度地減少創傷,而且能夠做到胃癌的完整系膜切除,可達到精準的手術境界[17]。本研究顯示,膜解剖組術后1天、術后3天、術后7天的疼痛VAS評分都低于對照組,表明膜解剖在胃癌根治術的應用能有效緩解病人的疼痛狀況。
胃癌轉移除了四大轉移途徑之外,還包括系膜轉移,表現為癌細胞從胃系膜裸區脫落或淋巴結破裂進入胃相鄰系膜,然后沿系膜脂肪轉移[18]。hMGB-1作為大多組織中含量豐富的細胞因子,是最主要的一種炎癥因子和損傷信號分子之一。hMGB-1較其他炎癥因子轉錄激活較晚,介導炎性級聯反應從而導致組織發生損傷,也可反映腫瘤的轉移情況[19]。本研究顯示,膜解剖組術后1天、術后3天、術后7天的血清hMGB-1含量均低于對照組,表明膜解剖能有效減輕機體損傷。從機制上分析,沿著膜橋進入膜間隙將膜連同包裹內的脂肪淋巴組織一并清除,避免了傳統術式沿著肝總動脈或脾動脈剝除淋巴結時創面的滲血,從而減輕對病人的創傷,有利于hMGB-1表達恢復正常[20]。
胃由完整系膜包裹,其中固有筋膜包繞胃、周圍血管、脂肪結締組織和淋巴組織[21]。有別于傳統的基于器官解剖和血管解剖的腫瘤外科手術,將膜解剖理論與胃癌根治術相結合,通過腹腔鏡實施創新性的腫瘤外科手術,沿著膜橋進入膜間隙將膜連同包裹內的脂肪淋巴組織一并清除,具有系膜切除更完整、預后更好的優點[22-23]。本研究所有病人隨訪至2021年10月1日,膜解剖組的復發率、死亡率低于對照組。胃癌根治術的膜解剖不僅需切除胃,還包括將可能有腫瘤細胞殘留的胃周圍系膜一起切除,盡可能保持胃周圍系膜的完整性,降低了癌泄露的風險,從而可降低腫瘤復發率與死亡率[24-25]。手術中要注意以下事項:當前腸腹側系膜與背側系膜部分分化成肝、膽、胰、脾等實質器官時,不能在根治手術中一起切除[26]。前腸與中腸及系膜旋轉形成復雜的三維結構,在手術中要細致操作進行切除。胰腺被膜剝除需要注意解剖層次,注意保護十二指腸并注意胰腺上緣血管走行。在剝離網膜囊的推進過程中要主動辨識橫結腸邊緣血管、胰腺下緣、十二指腸升部、結腸中血管等組織結構,避免醫源性損傷[27-28]。
胃癌根治術中應用膜解剖能有效降低并發癥的發生,減少手術創傷,促進病人康復,緩解疼痛,降低復發率、死亡率。

