術前化療后行細胞減滅術聯合腹腔熱灌注化療治療結直腸癌腹膜轉移的安全性及療效分析
吳國慶 周思成 張景 陳海鵬 鄭朝旭 周海濤 裴煒 梁建偉
腹膜轉移是結直腸癌第1常見遠處轉移部位,僅次于肝轉移[1-2]。細胞減滅術(cytoreductive surgery,CRS)聯合腹腔熱灌注化療(hyperthermic intraperitoneal chemotherapy,HIPEC)逐漸成為結直腸癌腹膜轉移的一線治療方案[3]。對于部分結直腸癌腹膜轉移的病人,CRS+HIPEC治療后中位生存時間可以達到40個月[4]。CRS+HIPEC是一項技術復雜且可能危及生命的手術,術后并發癥發生率高達37.9%~60.5%[5]。術后并發癥的發生會使病人一般情況惡化并且影響病人后續輔助治療。術前化療已被證明有益于Ⅳ期結直腸癌病人的總體生存[6]。在此基礎上,我們推測在CRS+HIPEC前給予術前化療是否也能給予伴有同時性腹膜轉移的結直腸癌病人進一步帶來生存獲益。此外,術前化療后行CRS+HIPEC的安全性仍有待證實。本研究探討CRS+HIPEC前行術前化療的結直腸癌腹膜轉移病人的生存優勢以及圍手術期安全性。
對象與方法
一、對象
2017年6月~2019年6月在中國醫學科學院腫瘤醫院和桓興腫瘤醫院接受CRS+HIPEC治療的結直腸癌引起的同時性腹膜轉移的病人52例。納入標準:(1)同時性腹膜轉移;(2)病理檢查證實為結直腸惡性腫瘤;(3)年齡18~75歲;(4)ECOG評分<1。排除標準:合并其他惡性腫瘤;姑息性手術,如短路手術或單純腸造口術;3周期以內的術前化療。病人均簽署知情同意書,本研究的設計與開展經過醫院倫理委員會審批通過。
二、方法
1.根據CRS+HIPEC前有無進行術前化療將病人分為術前化療組和未術前化療組,其中20例(38.5%)的病人接受了術前化療。術前化療方案主要有XELOX、FOLFOX和FOLFOIRI,其中6例病人接受了貝發珠單抗靶向治療,見表1。腹膜癌指數(peritoneal carcinomatosis index,PCI)用于評估腹膜轉移的范圍與嚴重程度,對于腹腔的13個定義區域,每個區域的評分范圍為0~3[7]。細胞減滅(completeness of the cytoreduction score,CC)評分分級如下:CC0-1,細胞完全減滅(CC0表示無肉眼可見腫瘤殘留,CC1表示殘留結節小于0.25 cm),或細胞不完全減滅(CC2-3)[8]。化療毒性指標,包括白細胞計數、血小板計數、ALT水平、肌酐水平,分別于CRS+HIPEC術前與術后第1、3、5天清晨測定。嚴重肝、腎損害或骨髓抑制的病人被認為不適合進行HIPEC。根據不良事件通用術語標準對術后30天內的并發癥進行記錄和分級[9]。

表1 20例病人術前化療方案
2.觀察指標:收集兩組病人臨床病理資料。臨床資料包括年齡、性別、體質指數、合并癥、原發腫瘤位置、輔助化療;病理資料包括病理類型、病理T分期、病理N分期、PCI指數、肝轉移;圍手術期相關資料包括HIPEC方案、CC評分、有無腹水、手術時間、術中出血量、并發癥、首次排氣時間、術后住院時間。隨訪資料包括中位隨訪時間及3年總體生存率(overall survival,OS)。
3.隨訪:所有病人通過門診復查的形式進行隨訪。前2年每3個月接受1次門診隨訪,2年之后每6~12個月接受1次門診隨訪。每次隨訪均進行胸腹盆CT和實驗室檢查,包括腫瘤標志物(CEA和CA19-9)。本研究的長期終點是3年OS。OS定義為從手術日期到死亡或最后一次隨訪(2021年12月31日)的時間。
三、統計學方法
結果
1.基線資料和臨床特征:術前化療組接受完全性細胞減滅術(CC0-1)的病人比例明顯高于未術前化療組的病人(80.0% 和46.9%,P=0.018)。此外,術前化療組PCI指數<12的病人的比例顯著多于未術前化療組(80.0% 和 50.0%,P=0.031)。兩組病人性別、年齡、BMI指數、術前CEA水平、合并癥、腫瘤位置、組織學類型、T分期、N分期、肝轉移、有無腹水、HIPEC化療方案和輔助化療等比較,差異無統計學意義(P>0.05),見表2。
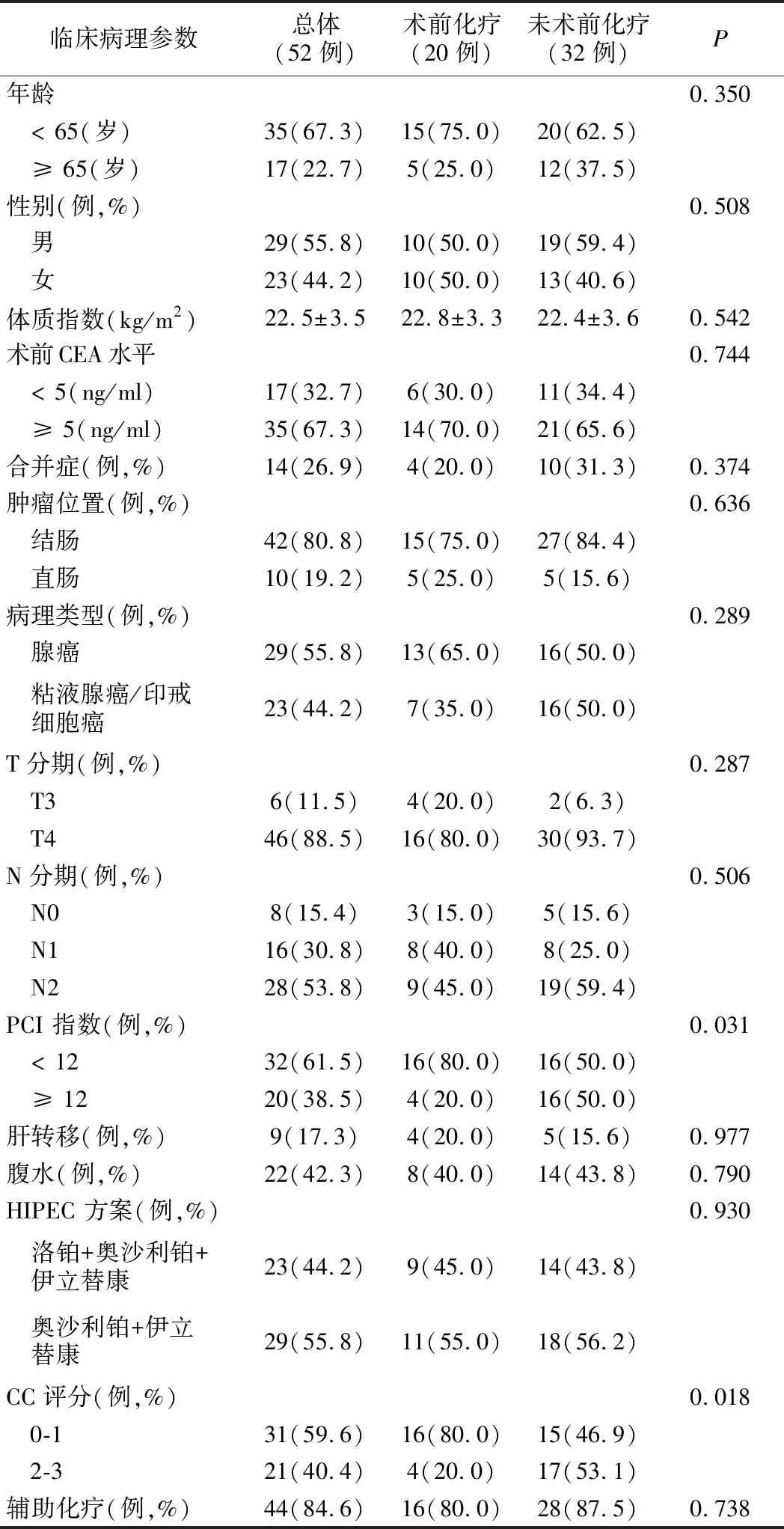
表2 52例病人臨床病理特征
2.手術資料與術后恢復情況:術前化療組病人平均手術時間短于未術前化療組,但是未達到統計學差異(245.5 分鐘 和289.4 分鐘,P=0.082)。術前化療組出現血小板降低的比例明顯高于未術前化療組(30.0%和6.3%,P=0.043)。兩組病人3~4級術后并發癥(40.0%和31.3%,P=0.519)、術后住院時間(15.4和13.9 d,P=0.333)和二次手術率(1.9%和0,P=1.000)等比較,差異均無統計學意義,見表3。

表3 52例病人手術參數與圍手術期指標
此外,術前化療組病人術后第1天平均血小板計數(151.9 和197.7×109/L,P=0.036)和白細胞計數(4.7 和 7.2×109/L,P=0.030)明顯低于未術前化療組病人(圖1A,B)。兩組病人術前與術后第1、3、5天ALT和肌酐水平比較無明顯差異(圖1C,D)。
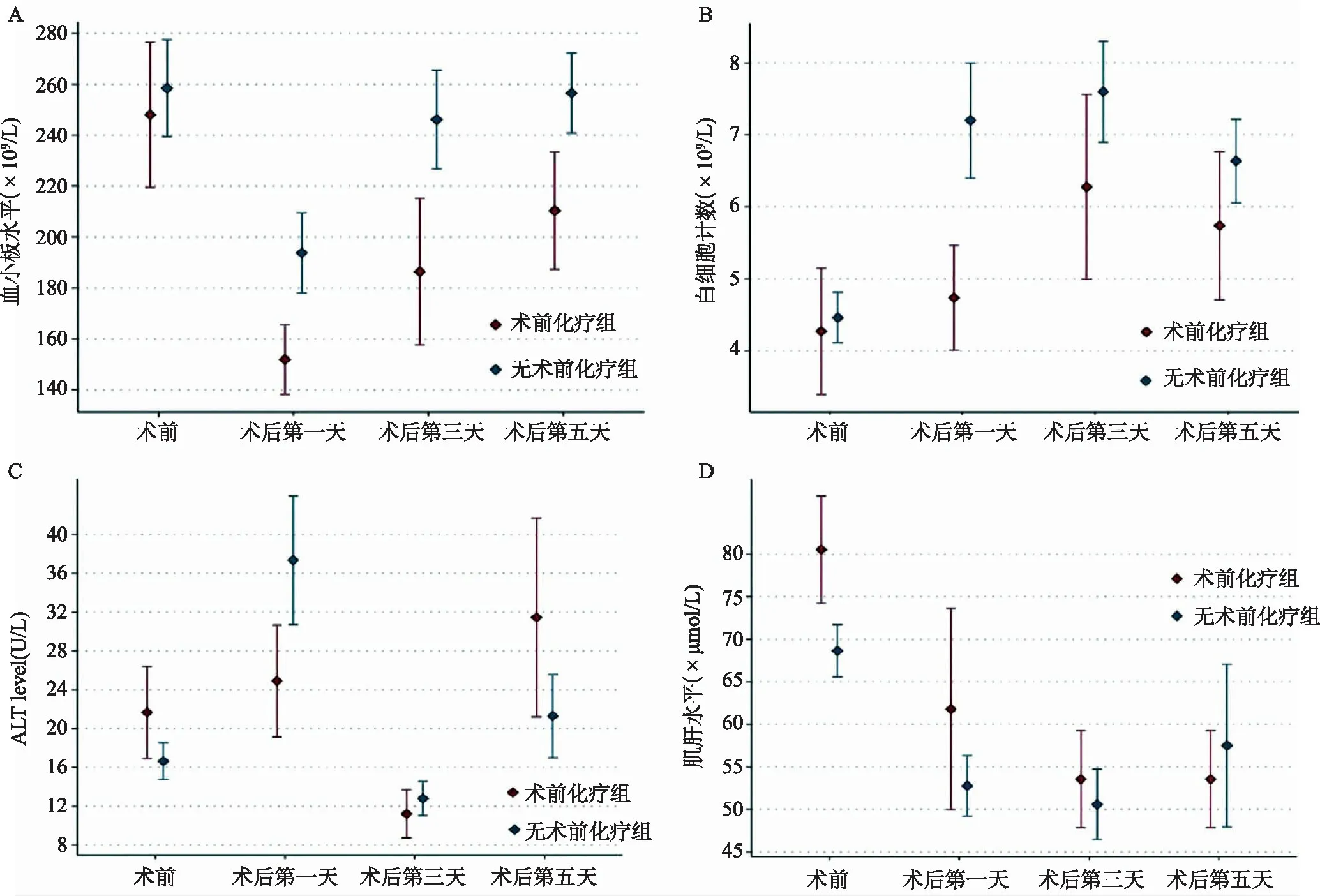
圖1A 術后第1、3、5天化療組與無化療組平均血小板計數變化 圖1B 術后第1、3、5天化療組與無化療組平均白細胞計數變化 圖1C 術后第1、3、5天化療組與無化療組平均ALT計數變化 圖1D 術后第1、3、5天化療組與無化療組平均肌酐計數變化
3.生存分析:全組中位隨訪時間28.5(13~40)個月,3例失訪。隨訪期間,28例死于腫瘤復發和轉移,其中術前化療組6例,未術前化療組22例。全組病人中位生存時間為24個月,1年和2年OS分別為65.1%和42.1%(圖2A)。術前化療組2年OS明顯高于未術前化療組病人( 67.4%和32.2%,P=0.044)(圖2B)。
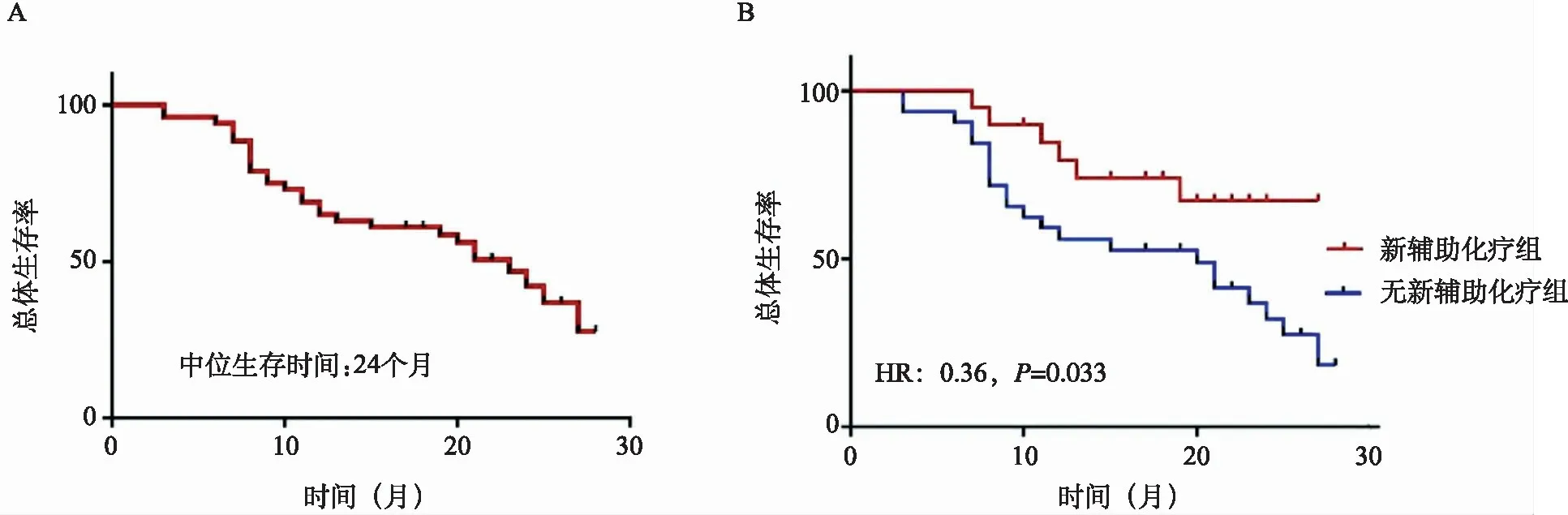
圖2A 全組病人總體生存曲線 圖2B 術前化療組與未術前化療組病人總體生存曲線
進行影響OS的單因素分析顯示,術前化療、PCI指數和CC評分與OS明顯相關(P<0.05)。多因素分析消除混雜因素干擾,結果顯示CC評分是影響OS的獨立危險因素(HR 2.99,95% CI 1.14~7.84,P=0.026)。然而,術前化療(HR 0.55,95%CI 0.22~1.39,P=0.204)和PCI評分(HR 1.49;95%CI 0.61~3.66;P=0.381)不是影響OS的獨立危險因素,見表4。
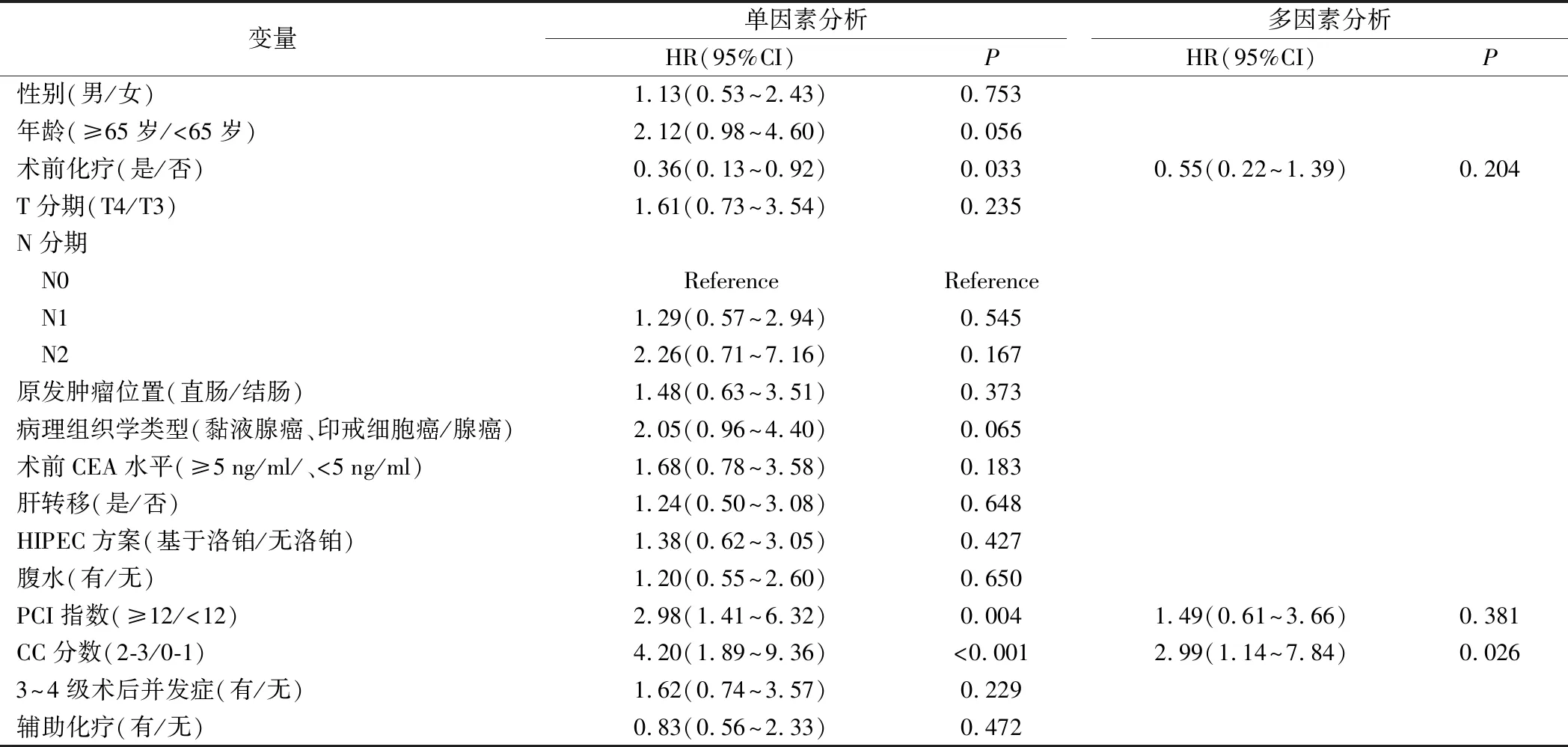
表4 52例病人總體生存的單因素及多因素Cox回歸分析
討 論
不同于闌尾黏液性腫瘤,結直腸癌引起的腹膜轉移通常表現為腫瘤廣泛進展和預后不良。CRS+HIPEC可以為某些結直腸癌腹膜轉移病人帶來生存獲益[3]。除了CRS+HIPEC治療,圍手術期全身化療已被證明可以延長腹膜轉移病人的生存期[10]。然而,化療的最佳時機,特別是術前化療的安全性和長期療效仍然未知。我們的數據顯示,在術前化療后接受CRS + HIPEC的病人具有可接受的術后并發癥發生率和死亡率。雖然術前化療對血小板和白細胞有一定的影響,但在術后密切監測和積極治療下,這些反應并沒有轉化為嚴重并發癥。生存預后方面,與未行術前化療的病人相比,接受術前化療的病人OS有所改善,但在控制了混雜因素后,術前化療并不是OS改善的獨立預后因素。但本研究在化療藥物的選擇上缺乏統一的標準,部分病人使用了貝伐珠單抗等靶向藥物,這可能會影響術前化療的安全性和腫瘤治療效果的評估。
CRS+HIPEC是一項技術復雜且可能危及生命的手術,在10個指定的國際治療中心,發病率為12%~52%,死亡率為0.9%~5.8%[11]。因此,術前化療所引起的骨髓抑制、神經毒性、胃腸道反應等不良反應是否會進一步增加CRS+HIPEC后的并發癥發生率和死亡率仍值得探討。Devilee 等[12]對91例行CRS和HIPEC病人行術前化療的安全性和有效性進行評估,結果顯示,術前化療沒有顯著增加嚴重并發癥發生率或死亡率。Leimkühler等[13]研究發現,在接受術前化療的病人和未接受術前化療的病人之間,并發癥發生的嚴重程度和持續時間是相似的。我們的研究同樣發現行術前化療的病人術后更容易出現血小板降低。此外,術前化療組病人術后第1天平均血小板水平和白細胞水平明顯低于未術前化療組。然而,我們發現,這些對血小板和白細胞的不利影響似乎并未轉化為嚴重的術后并發癥。
理論上,術前化療可以有效降低原發腫瘤和腹膜轉移灶的腫瘤負荷,從而提高長期生存率。在本研究中,接受術前化療的病人PCI評分顯著低于未接受術前化療的病人,同時接受術前化療的病人中達到完全細胞減滅(CC0-1)的比例較高。多因素Cox回歸分析結果顯示,術前化療并不是OS的保護因素,CC評分與OS獨立相關,但術前化療組生存超過2年的病人多于未接受術前化療組。這可能是由于樣本量較小亦或是Cox回歸中部分變量交互等原因導致的。大規模多機構注冊研究顯示,PCI指數和CC評分均與行CRS+HIPEC病人的長期預后相關[14],使用術前化療降低腫瘤負荷,增加完全細胞減滅的可能是一種有效而有價值的策略。Beal等[6]對298例病人的回顧性分析表明,術前化療有益于接受CRS+HIPEC病人的生存,盡管術前化療在控制混雜因素后也未被確定為OS的獨立因素。與之相似的是,Devilee等[12]報道,在CRS+HIPEC前,術前化療與OS的改善明顯相關。
綜上所述,CRS+HIPEC前進行術前化療安全可行,具有相對較低的死亡率和可接受的并發癥發生率。雖然術前化療對血小板和白細胞有一定的影響,但這些影響似乎不會轉化為嚴重的術后并發癥。然而,需要大樣本隨機對照研究來證實在CRS+HIPEC前行術前化療是否可以帶來生存獲益。

