IgA腎病患者血尿酸與腎臟病理及預后的相關性研究
王一鑫 靳蕊霞 崔向飛
IgA 腎病(immunolobulin A nephropathy,IgAN)是一種由免疫介導的腎臟疾病,好發于年輕人,在亞洲占原發性腎小球疾病的15%~40%,在中國占30%~40%,是我國常見的腎小球疾病之一[1]。IgAN已成為我國終末期腎臟病(end-stage renal disease,ESRD)的重要病因之一[2]。有報道指出,約1/3的患者在首次確診IgAN 后20 年內逐漸進展為ESRD[3]。
目前的研究顯示,24 h 尿蛋白超過1.0 g、患有高血壓、腎功能異常和腎穿刺病理分級高是IgAN進展為ESRD 的主要危險因素[4]。尿酸是人體飲食攝入及內源性嘌呤代謝的最終產物,在血液pH 正常時,約90%的尿酸以尿酸根離子的形式存在。尿酸主要經腎臟和腸道排出體外,其中腎臟占2/3,由于腎臟排泄受損導致的高尿酸血癥占全部患者的90%[5]。有研究表明,高尿酸血癥與IgAN 進展有著緊密聯系[6]。該研究旨在分析IgAN 伴高尿酸血癥患者的臨床與病理資料的特點,分析IgAN 預后的危險因素,為治療IgAN 患者以及改善預后提供依據。現報道如下。
1 資料與方法
1.1 一般資料 選取2016 年8 月-2020 年8 月在錦州醫科大學附屬第一醫院腎臟內科經腎活檢確診為原發性IgAN 的患者101 例,(1)納入標準:①腎活檢明確診斷為原發性IgAN;②年齡≥18 歲;③隨訪時間≥12 個月。(2)排除標準:①腎穿刺病理結果腎小球<10 個[7];②無完整隨訪數據。根據腎活檢前血尿酸水平,當男性及絕經后女性血尿酸>420 μmol/L、絕經前女性血尿酸>360 μmol/L 時,定義為高尿酸血癥[8],將患者分為高尿酸血癥組44 例和正常血尿酸組57 例。本研究經醫院醫學倫理委員會審核批準,患者已簽署知情同意書。
1.2 方法 收集患者的臨床資料,如年齡、性別、體重指數(BMI)和血壓、尿常規、24 h 尿蛋白定量、血生化等相關檢查結果;以及患者的病理資料,即牛津病理分型結果。BMI=體重(kg)/身高2(m2)。估算的腎小球濾過率(eGFR)使用慢性腎臟病流行病學協作公式(chronic kidney disease epidemiology collaboration equation,CKDEPI)計算[9]。
1.3 觀察指標及評價標準(1)臨床指標評價標準。(2)病理評估標準。牛津分型按2017 年診斷標準進行病理診斷[10],見表1。(3)研究終點事件。每3 個月對患者血肌酐進行隨訪,以血肌酐較基線值倍增,或進展至終末期腎病為終點事件,以未發展到終點事件為腎臟存活。

表1 牛津病理分型
1.4 統計學處理 采用SPSS 22.0 軟件包進行統計分析。正態分布的計量資料采用()表示,兩組間比較采用獨立樣本t 檢驗;非正態分布計量資料采用M(P25,P75)表示,組間比較采用秩和檢驗。計數資料采用率(%)表示,組間比較采用χ2檢驗。應用多因素logistic 回歸分析影響IgAN 患者伴發高尿酸血癥的相關危險因素。采用Kaplan-Meier 法生存分析高尿酸血癥對IgAN 腎臟預后的影響。以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者臨床資料比較 IgAN 患者101 例,男58 例,女43 例,平均年齡(40.84±14.10)歲;正常血尿酸組57 例(56.44%),高尿酸血癥組44 例(43.56%)。高尿酸血癥組高血壓比例、血肌酐、尿素氮、甘油三酯水平均較正常血尿酸組高,而eGFR 水平較正常血尿酸組低,差異均有統計學意義(P<0.05);兩組的性別、年齡、BMI、血紅蛋白、總膽固醇、血漿白蛋白、24 h 尿蛋白定量比較,差異均無統計學意義(P>0.05)。見表2。
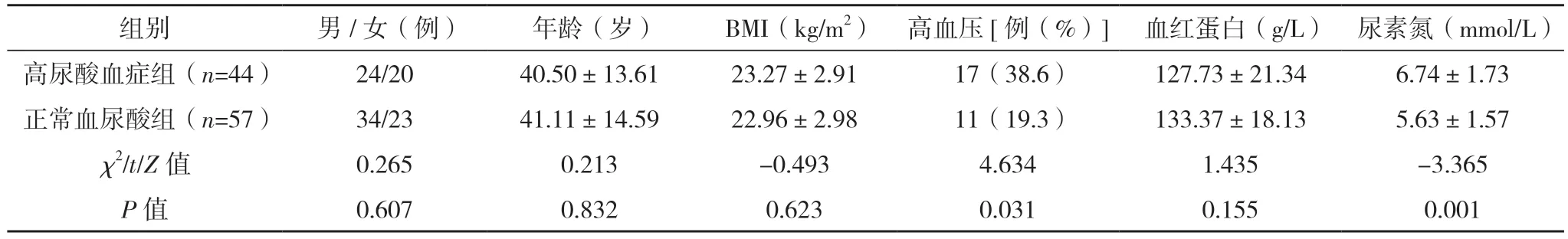
表2 兩組患者的臨床資料比較
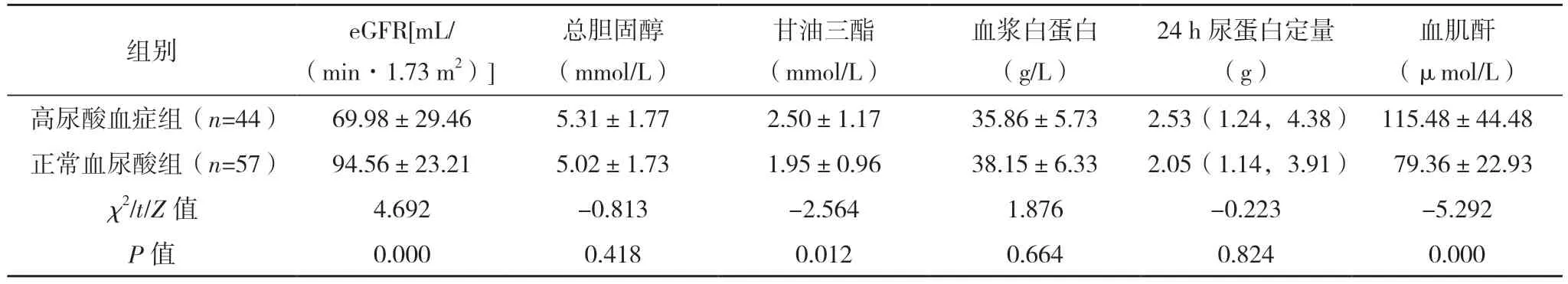
表2(續)
2.2 兩組患者病理結果比較 高尿酸血癥組患者的腎小管萎縮/間質纖維化發生情況與正常血尿酸組比較,差異有統計學意義(P<0.05);兩組系膜細胞增生、內皮細胞增生、腎小球節段性硬化或粘連、新月體比較,差異均無統計學意義(P>0.05)。見表3。
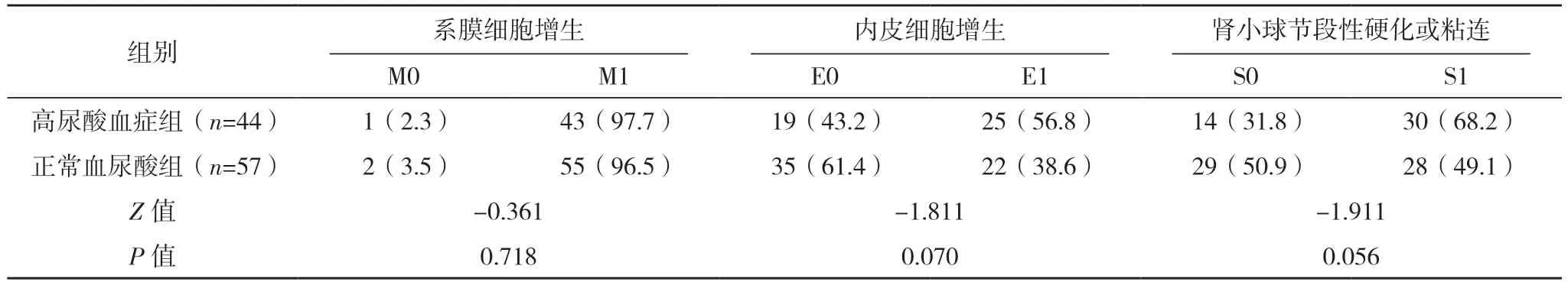
表3 兩組病理結果比較[例(%)]

表3(續)
2.3 IgAN 患者伴發高尿酸血癥危險因素分析 將高血壓、尿素氮、eGFR、甘油三酯、血肌酐、腎小管萎縮/間質纖維化應用多因素logistic 回歸分析,結果顯示:尿素氮、腎小管萎縮/間質纖維化是IgAN 患者伴發高尿酸血癥的獨立危險因素(P<0.05),見表4。
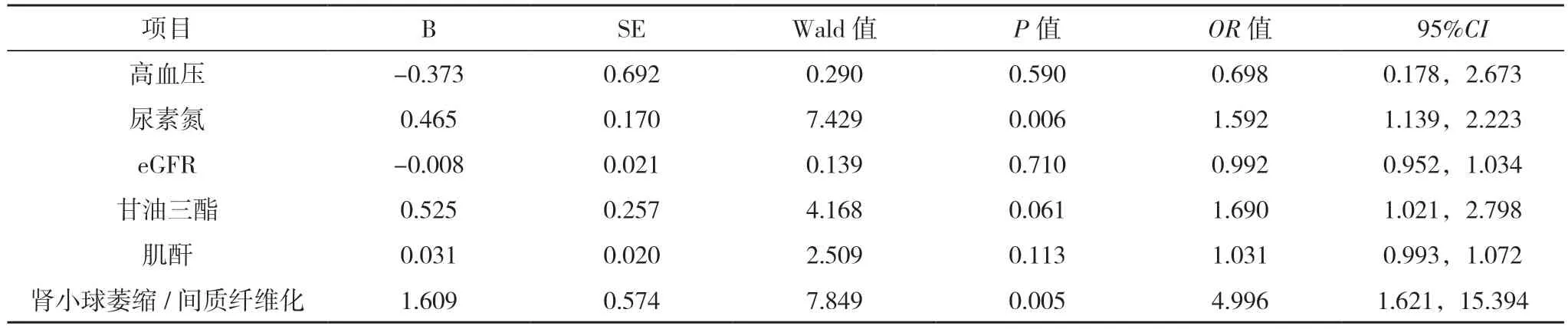
表4 IgAN患者伴發高尿酸血癥的多因素logistic回歸分析結果
2.4 血尿酸水平與IgAN 預后的關系 隨訪中位時間20 個月,隨訪最長時間40 個月。正常血尿酸組達到終點事件5 例,高尿酸血癥組達到終點事件13 例。Kaplan-Meier 生存曲線提示,IgAN 伴高尿酸血癥組患者的腎臟存活率低于正常血尿酸組,差異有統計學意義(P=0.008),見圖1。
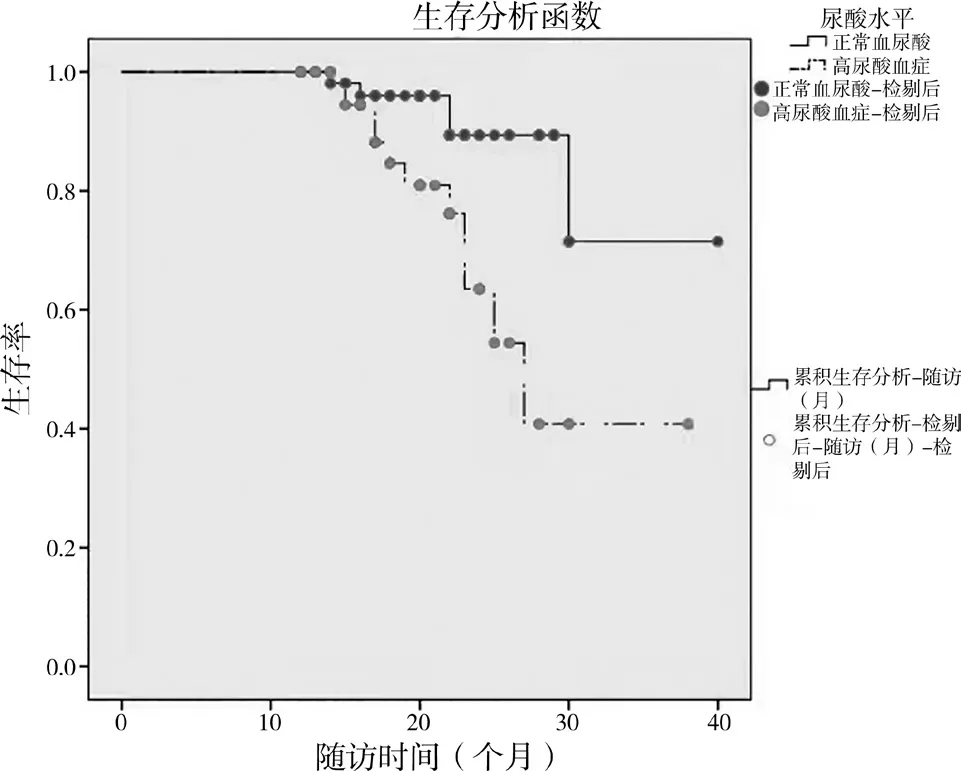
圖1 高尿酸血癥與正常血尿酸組IgAN患者腎臟存活率的生存曲線
3 討論
IgAN 是一種由免疫介導的腎臟疾病,是ESRD的重要病因之一[2]。目前公認的危險因素主要為24 h 尿蛋白超過1.0 g、患有高血壓、腎功能異常和腎穿刺病理分級高[4]。近年來,越來越多的研究強調尿酸在慢性腎臟病中的作用。研究伴高尿酸血癥的IgAN 患者的腎臟病理特征有助于更好地了解高尿酸血癥與腎臟病理之間的關系,并為干預策略提供有意義的證據。
尿酸是人體的代謝產物,由嘌呤化合物代謝產生。腎臟作為排泄人體代謝產物的主要器官,也承擔著排泄人體內2/3 尿酸的重要任務;而剩下的1/3經過胃腸道排泄,腸道幾乎完全降解了尿酸,大便中只剩下很少的尿酸,這種機制在腎衰竭時略有增加,可能是對腎臟清除尿酸功能下降的一種代償機制[11]。郭海華等[12]研究顯示,腎功能損害重的IgAN 患者更容易出現尿酸排泄障礙,導致高尿酸血癥的發生,提示腎功能受損傷是IgAN 患者伴發高尿酸血癥的危險因素。尿酸作為人體內的抗氧化劑,在異常增高的情況下,與NO 發生反應,導致NO被大量消耗,從而引起血管內皮細胞的功能障礙,進而導致高血壓和血管病變;也有研究顯示高尿酸血癥與血脂異常有關,雖然發病機制尚未闡明,但蔣茜等[13]研究發現高尿酸腎病大鼠血脂明顯升高。
IgAN 的發病機制尚未有統一結論,目前“四重打擊學”說是被學者們廣泛接受的IgAN 發病機制[14]。目前已有多項研究提示血尿酸對腎臟病理造成損傷,從而參與IgAN 的進展。高尿酸損傷腎臟病理的機制分為直接機制和間接機制兩種。尿酸轉換為尿酸鹽結晶,沉積于腎小管與腎間質中,導致炎性反應及纖維化的形成,從而直接損傷腎臟病理[15];血尿酸對腎臟病理的間接損傷機制則為損傷血管內皮細胞、激活RAAS 系統、產生炎癥級聯反應等[16],同時高尿酸激活了PI3K/AKt 信號通路,導致α 平滑肌激動蛋白表達上調、刺激腎小管上皮轉分化,產生大量細胞外基質,從而促進腎間質纖維化的進展,導致腎臟病理的損傷[17]。Myllymnaki 等[18]研究也顯示高尿酸血癥可以導致腎小球、腎間質和腎血管的損傷。最近的一項研究發現,高尿酸血癥患者腎小球硬化比例比正常血尿酸患者更高[19]。Fan 等[20]和Zhou 等[21]的研究也發現尿酸水平與牛津病理分型中的S、T 密切相關。上述研究均證明了尿酸對腎臟病理造成損傷,參與IgAN 的進展。
血尿酸與IgAN 預后關系復雜,目前有關血尿酸與IgAN 預后關系尚未明確,高尿酸血癥和IgAN之間可能的因果關系是一個爭議的來源。Lu 等[22]對208 名原發性IgAN 患者進行隨訪研究,生存曲線分析顯示高尿酸血癥組患者的腎臟預后明顯差于正常尿酸血癥組,且他們的結果認為尿酸是IgAN患者預后的一個有價值的預測指標。Zhou 等[21]研究顯示,血尿酸是IgAN 患者腎功能進展的危險因素,尤其是在eGFR 正常的IgAN 患者中。另一項研究表明,血尿酸水平在416~529 mmol/L 的人患CKD 的風險幾乎是血尿酸<416 mmol/L 的2 倍[23]。但Nagasawa 等[24]對935 名原發性IgAN 患者研究結果顯示,高尿酸血癥是女性患者腎功能進展的獨立危險因素,而在男性中則并未顯示出這種關系。Srivastava 等[25]報道了3 885 名IgAN 患者的隊列研究的研究,平均隨訪時間7.9 年,結果顯示在CKD 1~3 期的患者中,高尿酸血癥是腎衰竭的獨立危險因素,但在CKD 4~5 期的患者中,血尿酸水平的升高與腎衰竭的風險無關。
本研究結果顯示,高尿酸血癥組尿素氮、血肌酐水平均較正常血尿酸組高,而eGFR 水平較血尿酸正常組低,差異均有統計學意義(P<0.05),表明尿酸水平越高,IgAN 患者腎功能損害越嚴重,這與李玉鳳等[26]研究結果一致。同時本研究顯示,高尿酸血癥組高血壓比例、甘油三酯水平均較正常血尿酸組高,差異均有統計學意義(P<0.05)。多因素logistic 回歸分析顯示,尿素氮、腎小管萎縮/間質纖維化是IgAN 患者伴發高尿酸血癥的獨立危險因素(P<0.05)。本研究還發現高尿酸血癥組患者的腎小球萎縮/間質纖維化發生情況與正常組血尿酸比較,差異有統計學意義(P<0.05),這與任慧敏等[27]結果相同。Kaplan-Meier 生存曲線提示,IgAN 伴高尿酸血癥組患者的腎臟存活率低,差異有統計學意義(P<0.05),這與崔炯等[28]結果一致。
綜上所述,高尿酸血癥患者的腎臟病理損傷程度較正常血尿酸患者嚴重,腎臟存活率更低,提示高尿酸血癥參與腎臟病理損害的過程。盡早使用藥物治療高尿酸血癥,可能對改善患者的預后有積極意義。

