氫溴酸高烏甲素注射劑藥品不良反應及風險因素分析
李 霞,田月潔,霍艷飛,謝彥軍,常 虹,孫春曉,許莉莉
(山東省藥品不良反應監測中心,山東 濟南 250014)
高烏甲素(LA)是從高烏頭中提取的一種二萜類生物堿,是高烏頭的主要化學成分,具有中樞鎮痛、抗風濕性關節炎、抗心律失常、抗氧化、抗癌、免疫調節等生物活性[1-2]。臨床上主要使用其氫溴酸鹽,用于治療癌痛和各種手術后中度以上疼痛[3]。近年國內有氫溴酸高烏甲素注射劑引起帕金森樣綜合征、過敏反應甚至過敏性休克的文獻報道[4-8],有研究表明,高劑量高烏甲素有誘發心律失常等心臟毒性[9]。為進一步了解氫溴酸高烏甲素注射劑藥品不良反應發生的特點和影響因素,本文對山東省藥品不良反應監測數據庫中涉及氫溴酸高烏甲素注射劑的藥品不良反應進行分析,探討可能的發生機制和影響因素,旨在提高氫溴酸高烏甲素注射劑臨床使用的安全性。
1 資料與方法
1.1 資料來源
通過檢索山東省藥品不良反應監測數據庫(2017年1月1日至2021年12月31日)中懷疑藥品涉及氫溴酸高烏甲素注射劑的報告,篩選關聯性評價為“可能、很可能、肯定”的共計1196例,按照國家藥品不良反應監測中心報告質量評估標準進行規整,1196例報告均納入統計分析。
1.2 方法
對納入分析報告涉及用藥時間、用法用量、不良反應表現和累及系統、不良反應結果等進行整理和歸納,用SPSS20和Microsft Excle軟件進行統計分析。
2 結果
2.1 整體情況
2.1.1 報告類型 本組數據中,一般報告為1047例,占87.54 %,嚴重報告149例,占12.46 %;新的一般報告為202例,占16.89 %。
2.1.2 人口學情況 1196例患者中,男性613例,女性583例,男女比例為1.05:1。0~14歲患者26例,占2.17 %;15~64歲患者850例,占71.07 %;65歲及以上患者319例,占26.67 %,不詳1例。
2.1.3 用藥情況 對給藥途徑和用藥劑量進行統計,給藥途徑以靜脈滴注居多,用藥劑量多為說明書推薦的劑量。詳見表1。說明書中推薦的劑量為“靜脈滴注:一日4~8 mg,溶于葡萄糖氯化鈉注射液500 ml中靜滴”,“肌內注射:一次4 mg,溶于注射用水中(依據本品的動物試驗研究結果,肌內注射濃度不宜超過2 mg/ml),一日1~2次”,實際存在超過說明書劑量使用的現象,且說明書未推薦局部用藥和用藥劑量。
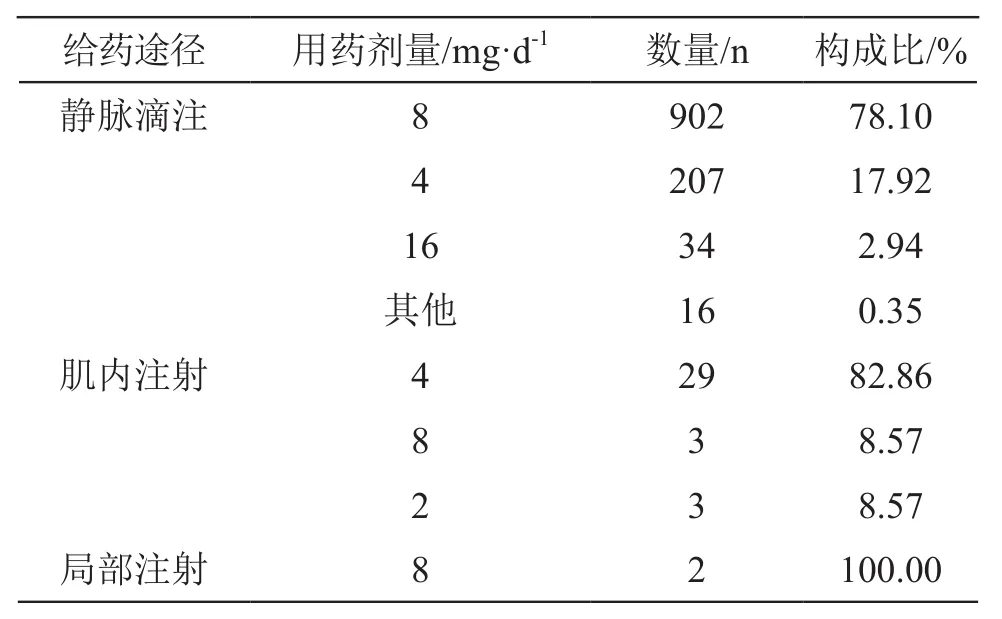
表1 氫溴酸高烏甲素注射劑給藥途徑和用藥劑量情況
2.1.4 不良反應發生時間 對用藥時間和不良反應發生時間進行計算并統計,不良反應發生主要集中在用藥1天內,共775例,占總數的64.80 %,其次為2~7 d的346例,占28.93 %。
2.1.5 不良反應累及系統和表現 對本組數據中不良反應表現進行拆分和統計,共得到1917例次不良反應表現,不良反應主要累及系統為皮膚及其附件損害、胃腸系統損害、中樞和外周神經系統損害等;不良反應主要表現為瘙癢、皮疹、蕁麻疹、惡心、嘔吐、頭暈、胸悶、心悸等。詳見表2。說明書不良反應項描述為“個別患者出現蕁麻疹、心慌、胸悶、頭暈等,停藥后很快消失”,皮疹、惡心、寒戰、過敏反應、肝功能異常等均未提及。
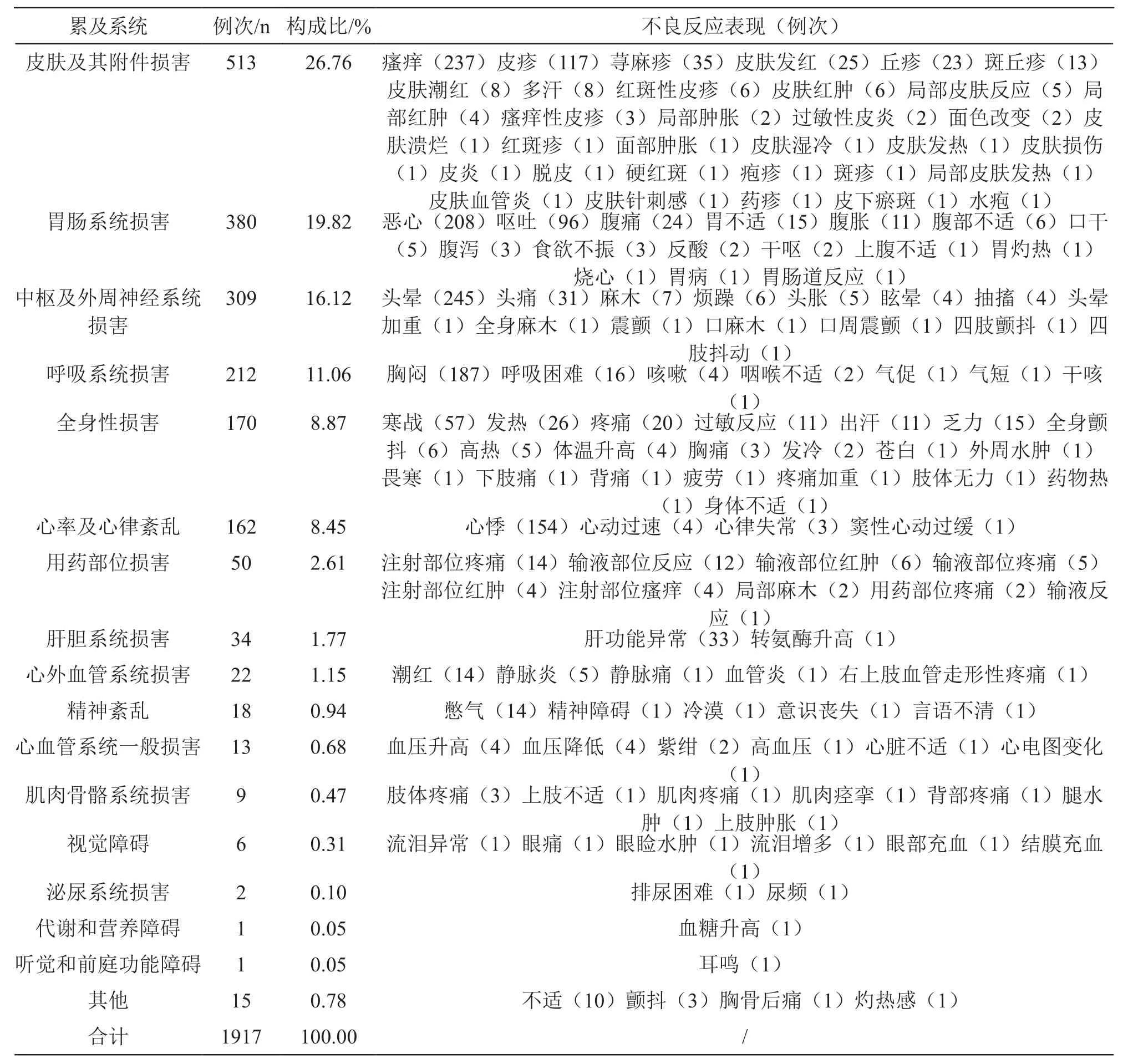
表2 不良反應累及系統及不良反應表現
2.1.6 用藥原因 對用藥原因進行統計,多為止痛或各類需止痛的相關疾病,如止痛(869例)、椎間盤突出(22例)、骨折(14例)、肢體疼痛(9例)、急性疼痛(9例)等。說明書中對于適應癥的描述為“用于中度以上疼痛”,與說明書推薦的適應癥基本一致。
2.1.7 不良反應結果 對本組數據的不良反應結果進行統計,患者轉歸情況均以痊愈或好轉為主,其中痊愈646例,占54.01 %,好轉543例,占45.40 %,不詳5例,占0.42 %,未好轉2例,占0.17 %。
2.2 嚴重不良反應報告分析
按照《藥品不良反應報告和監測管理辦法》的標準判斷,氫溴酸高烏甲素注射劑藥品不良反應中嚴重報告為149例,對嚴重報告情況進行了統計分析,并對不同劑型的嚴重不良反應占比情況進行了對比分析。
2.2.1 嚴重不良反應報告患者人口學特征 本組數據中,男性患者88例,女性患者61例,男女比例為1.44:1,男性數量多于女性。0~14歲患者1例,占0.67 %,15~64歲患者共99例,占66.44 %,65歲及以上患者共48例,占32.21 %,年齡不詳1例。
2.2.2 嚴重不良反應報告用藥情況和不良反應發生時間 對嚴重不良反應報告給藥途徑進行統計,其中靜脈滴注141例,占94.63 %,肌內注射8例,占5.37 %。對患者的用藥劑量進行統計,靜脈滴注中用量居多的為8 mg/d,共116例,占82.27 %,其次為4 mg/d,共22例,占15.60 %,還有12 mg/d共3例,占2.13 %,存在一定超過說明書劑量使用的現象。肌內注射中用量均為4 mg/d,共8例,均為說明書推薦的用法用量。
2.2.3 嚴重不良反應報告劑型 對嚴重不良反應報告涉及的劑型進行統計,注射液124例,占83.22 %,粉針劑25例,占16.78 %。進一步分析嚴重不良反應占比在劑型之間是否存在差異,將劑型和是否嚴重報告的數量進行了卡方檢驗。經卡方分析,卡方值為9.962,P=0.002<0.05,表明嚴重不良反應的占比在不同劑型之間存在顯著性差異,氫溴酸高烏甲素注射液嚴重不良反應報告占比顯著高于注射用氫溴酸高烏甲素。詳見表3。
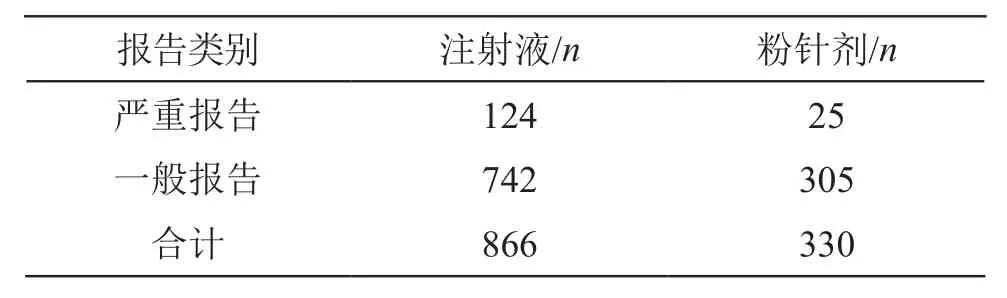
表3 氫溴酸高烏甲素注射劑不同劑型之間的嚴重不良反應占比對比
2.2.4 嚴重不良反應累及系統和表現 對本組數據中不良反應名稱進行拆分和統計,共得到303例次不良反應表現。結果表明,嚴重不良反應主要累及系統為皮膚及其附件損害、呼吸系統損害、全身性損害等;不良反應主要表現為瘙癢、皮疹、胸悶、呼吸困難、寒戰、發熱、心悸、肝功能異常等。詳見表4。
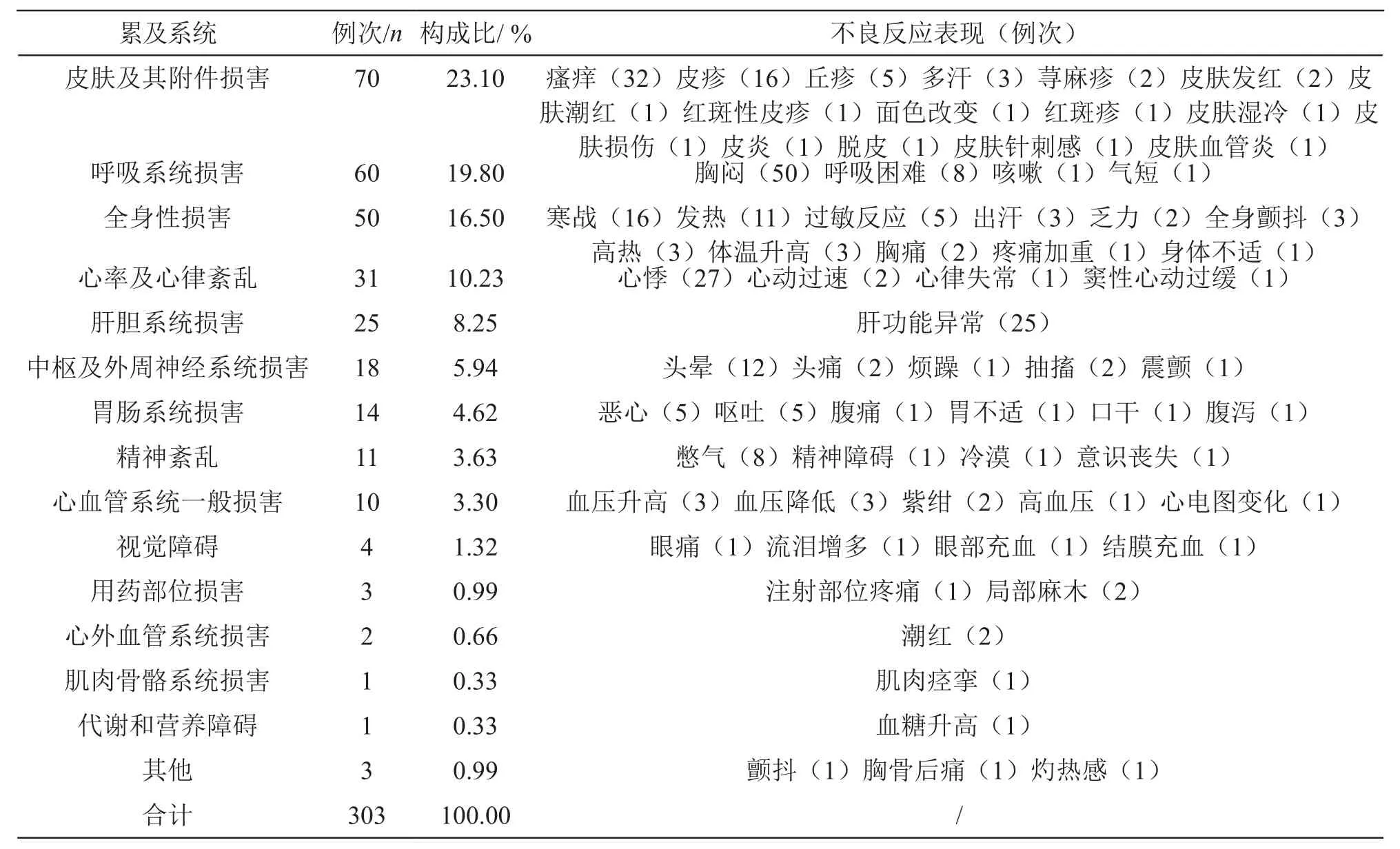
表4 嚴重不良反應累及系統及不良反應表現
2.2.5 嚴重不良反應結果 本組數據中,患者轉歸情況多為痊愈或好轉,其中痊愈56例,占37.58 %,好轉87例,占58.39 %,不詳4例,占2.68 %,未好轉2例,占1.34 %,不良反應表現為過敏反應、丘疹、瘙癢,可能是上報時不良反應未好轉。
3 討論
氫溴酸高烏甲素為國內首創的非成癮性鎮痛藥[10],臨床應用廣泛。通過對山東省氫溴酸高烏甲素注射劑的不良反應情況的分析,探討氫溴酸高烏甲素注射劑的不良反應發生可能的風險因素,并提出風險防控建議。
3.1 風險因素分析
3.1.1 產品的不穩定性可能是增加不良反應發生的風險因素 高烏甲素最早是將高烏頭根粉末使用強堿研磨后提取[11],氫溴酸高烏甲素在純化過程中可能殘留有其他生物堿;其結構中包含1個易水解的酯鍵,增加了其貯存的不穩定性[12]。劉秀花等[13]考察氫溴酸高烏甲素原料藥的穩定性后發現,氫溴酸高烏甲素對光較敏感。氫溴酸高烏甲素分子中的酯基和酰胺基在水溶液中易出現水解和氧化,粉針劑在一定程度上解決了這個問題,但仍有文獻報道氫溴酸高烏甲素凍干粉在強光照射下不穩定[14]。
3.1.2 雜質和輔料可能是過敏反應發生的風險因素氫溴酸高烏甲素注射劑中氫溴酸高烏甲素、雜質或輔料均可能是過敏反應發生的風險因素。氫溴酸高烏甲素原料藥中檢測到的5個雜質與主成分結構相似的二萜類生物堿。其輔料有甘露醇,甘露醇注射液說明書中記載甘露醇可引起皮疹、呼吸困難、過敏性休克等,甘露醇可能是過敏性休克發生的過敏原[3]。
3.1.3 注射液劑型可能是嚴重藥品不良發生的風險因素 數據分析顯示氫溴酸高烏甲素注射液嚴重報告占比顯著高于注射用氫溴酸高烏甲素。氫溴酸高烏甲素注射液在生產工藝中采用高溫加熱滅菌,導致主成分的酯鍵水解斷裂生成刺烏寧,而注射用粉針劑不含降解雜質刺烏寧。
3.1.4 藥品說明書警示力度不足 所有企業的產品說明書不良反應項下內容為“個別患者出現蕁麻疹、心慌、胸悶、頭暈等,停藥后很快消失。”,對于可能引起皮疹、頭痛、發熱、過敏反應、過敏性休克、肝功能異常等不良反應未記載,尤其是過敏性休克、肝功能異常等嚴重不良反應,警示力度不足,在臨床使用時容易忽視氫溴酸高烏甲素注射劑引發的不良反應。
3.2 風險防控建議
建議進一步關注氫溴酸高烏甲素注射劑的不良反應情況,目前生產企業說明書不良反應項描述較簡單,對于新的、嚴重不良反應,如過敏反應、過敏性休克、肝功能異常等未提及,國家藥品監督管理局局發布了《國家藥監局關于修訂氫溴酸高烏甲素注射劑說明書的公告(2022年第35號)》,生產企業應按照要求及時修訂說明書,以提醒臨床和公眾安全用藥,應深入分析不良反應發生的因素,減少藥品不良反應發生。建議生產企業對氫溴酸高烏甲素注射劑的光照不穩定性進一步研究,可改進包裝,采用棕色玻璃瓶,并避光存儲、運輸[15];建議生產企業加強對醫療機構氫溴酸高烏甲素注射劑可能導致嚴重不良反應的宣傳,提高醫務人員的風險意識,用藥時加強監護,一旦出現不良反應,及時采取治療措施,減少用藥風險。

