藤枝愈痹顆粒治療類風濕關節炎作用機制的網絡藥理學和分子對接技術探討*
莊 麗,陳照宇,韓光明,楊 倩,張 艷
(山東省日照市中醫醫院,山東 日照 276800)
類風濕關節炎是一種慢性、侵蝕性自身免疫性疾 病,主要臨床表現為對稱性關節炎[1],常伴有嚴重的疼痛和腫脹,嚴重者甚至會導致關節損傷和殘疾,嚴重影響患者的生活質量[2]。目前,全球的發病率為0.3%~1.0%,我國類風濕關節炎的患病人數隨人口老齡化趨勢逐年增加[3]。由于發病原因不明且發病機制復雜,其病理機制尚不明確。臨床常用的非甾體抗炎藥及糖皮質激素等抗類風濕關節炎藥物,一定程度上緩解了病情,但長期使用會產生副作用[4]。中醫認為,類風濕關節炎屬“歷節風”“頑痹”等范疇,由風、寒、濕三氣雜至所致[5-6]。中醫藥治療類風濕關節炎歷史悠久,潛力和優勢明顯。藤枝愈痹顆粒是根據全國名老中醫孫學全主任醫師臨床經驗方藤枝愈痹方制備而成的顆粒劑,由雞血藤、絡石藤、青風藤、海風藤、桂枝、桑枝、豨薟草、薏苡仁等組方,具有祛風除濕、散寒止痛功效。其治療類風濕關節類的療效顯著,但由于中藥復方成分復雜,具體的物質基礎及作用機制并不明確。網絡藥理學是通過構建藥物、靶點及疾病之間的復雜調控網絡,從整體上揭示中藥與疾病的相關性,進而系統闡述中藥多成分、多靶點、多通路的潛在分子機制[7]。本研究中基于網絡藥理學和分子對接技術,對藤枝愈痹顆粒治療類風濕關節炎的活性成分、作用靶點及作用機制進行預測和分析。現報道如下。
1 資料與方法
1.1 資料收集
本研究中所用數據庫信息見表1。

表1 數據庫信息Tab.l Information of databases
1.2 方法
藤枝愈痹顆粒活性成分及成分靶點獲取:以口服生物利用度(OB)≥30%和類藥性(DL)≥0.18為篩選條件,通過TCMSP數據庫檢索藤枝愈痹顆粒中雞血藤、青風藤、海風藤、絡石藤、桂枝、桑枝、豨薟草、薏苡仁的活性成分及成分靶點,并借助Uniprot數據庫對成分靶點進行標準化處理。
類風濕關節炎潛在靶點獲取與篩選:以“rheumatoid arthritis”為關鍵詞,分別在GeneCards及DisGeNET數據中檢索類風濕關節炎的靶點,取上述數據庫的共有靶點為類風濕關節炎的潛在靶點。并將上述獲得的成分靶點與類風濕關節炎的潛在靶點分別輸入Venny 2.0.2數據庫,得到的共有靶點即為藤枝愈痹顆粒治療類風濕關節炎的潛在靶點。
中藥-活性成分-共有靶點網絡構建:按照一一對應的關系,分別將組成藤枝愈痹顆粒的中藥、活性成分及共有靶點導入Cytoscape 3.7.0軟件中,構建中藥-活性成分-共有靶點網絡,并對其進行拓撲參數分析,根據度值篩選位置靠前的成分為核心成分。網絡中度值越大,表明網絡中與其他節點連線越多,位置越重要。
蛋白互作網絡(PPI)構建:將上述共有靶點導入String數據庫中,最小交互打分值設置為0.7,物種設置為“智人”種,構建PPI,作用結果借助Cytoscape 3.7.0軟件進行網絡拓撲參數分析,并根據度值篩選位置靠前的靶點為核心靶點。
GO功能富集分析和KEGG通路富集分析:采用DAVID數據庫對共有靶點進行分析,其中GO功能富集分析包括生物過程(BP)、分子功能(MF)和細胞組成(CC)3個部分。設定P<0.05為富集結果較好的過程及通路,采用R語言作圖分析。
分子對接驗證:將得到的核心成分與核心靶點采用Autodock Vina軟件進行分子對接驗證。通過TCMSP數據庫獲取核心成分的MOL2格式,并借助ChemDrew 3D軟件進行能量最小化處理,再采用Autodock 1.5.6軟件保存為PDBQT文件格式,備用。采用RCSB PDB數據庫獲取核心靶點的晶體結構,并通過Autodock軟件進行去水加氫、去配體等處理后保存為PDBQT文件格式,備用。最后采用Autodock Vina軟件對核心成分與核心靶點進行分子對接處理。以最低結合能評價結合的分子對接結果,結合能越低,對接結果越好。本研究中以結合能不高于-5 kJ/mol為兩者相互作用較好[8]。
2 結果
2.1 活性成分及成分靶點
通過TCMSP數據庫共篩選出活性成分88個,其中桂枝7個,海風藤21個,雞血藤23個,絡石藤9個,青風藤6個,桑葉3個,豨薟草9個,薏苡仁9個(表2),剔除無靶點及重復成分后得到67個活性成分。得到藤枝愈痹顆粒成分靶點1196個,剔除重復項后得到164個成分靶點。

表2 藤枝愈痹顆粒活性成分Tab.2 Active components in Tengzhi Yubi Granules
2.2 治療類風濕關節炎的潛在靶點
通過GeneCards及DisGeNET數據庫分別獲得類風濕關節炎靶點5018個、2723個,取交集后得到潛在靶點1879個,再與上述的164個成分靶點取交集后得到共有靶點85個,即為藤枝愈痹顆粒治療類風濕關節炎的潛在靶點(圖1)。
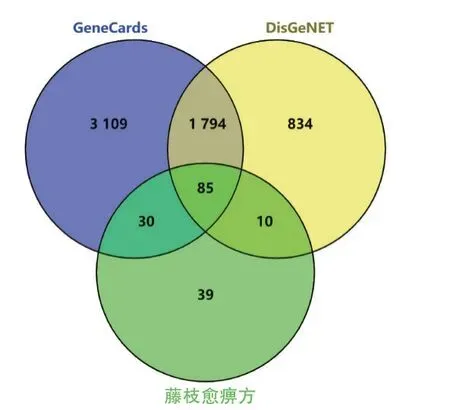
圖1 藤枝愈痹顆粒活性成分與類風濕關節炎共有靶點維恩圖Fig.1 Venn diagram of the common targets of the active components in Tengzhi Yubi Granules and RA
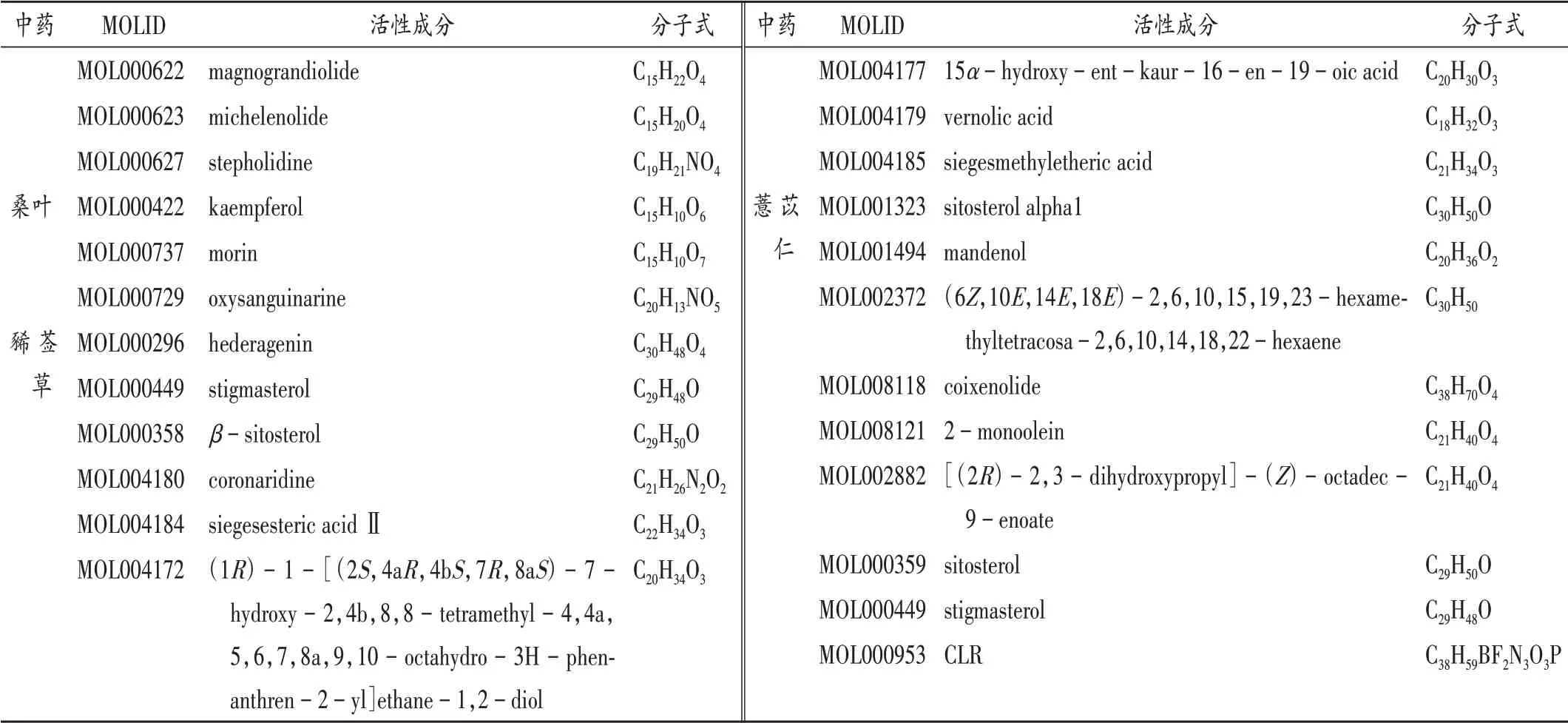
續表2藤枝愈痹顆粒活性成分Continued Tab.2 Active components in Tengzhi Yubi Granules
2.3 中藥-活性成分-共有靶點網絡構建
將中藥、活性成分及共有靶點導入Cytoscape 3.7.0軟件中構建中藥-活性成分-共有靶點網絡(圖2),包含158個節點、507條邊。根據度值篩選得到木犀草素、山柰酚、甘草查耳酮A等10個成分為核心成分,詳見表3。
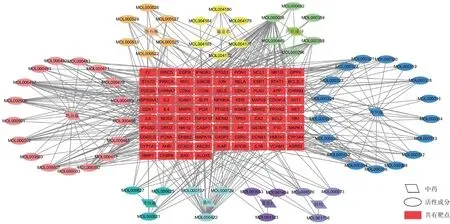
圖2 中藥-活性成分-共有靶點網絡Fig.2 Network of TCM-active components-common targets
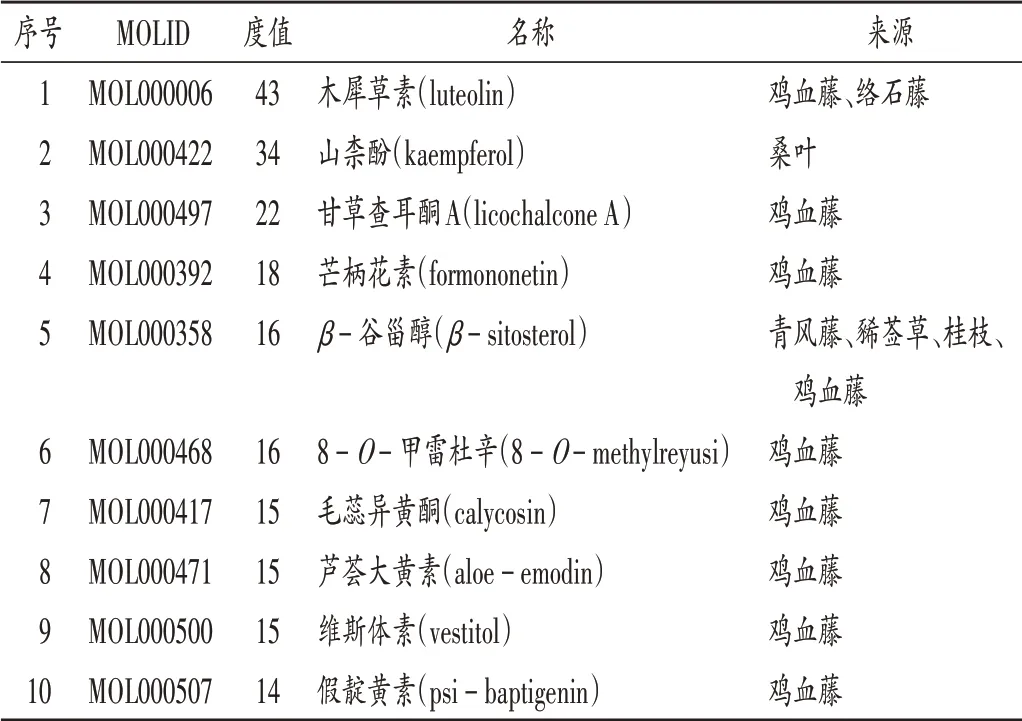
表3 藤枝愈痹顆粒核心成分信息Tab.3 Information of core components of Tengzhi Yubi Granules
2.4 PPI構建
通過String數據庫構建PPI(圖3),其中包含85個節點、569條邊。根據度值篩選得到白細胞介素6(IL-6)、信號轉導及轉錄激活因子3(STAT3)、促分裂原活化的蛋白激酶8(MAPK8)、促分裂原活化的蛋白激酶1(MAPK1)、絲氨酸/蘇氨酸蛋白激酶1(AKT1)等10個靶點為核心靶點,詳見表4。
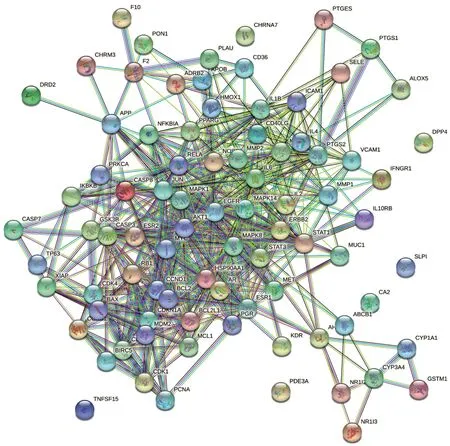
圖3 藤枝愈痹顆粒治療類風濕關節炎的PPIFig.3 PPI of Tengzhi Yubi Granules in the treatment of RA

表4 核心靶點信息Tab.4 Information of core targets
2.5 GO功能富集分析和KEGG通路富集分析
通過DAVID數據庫,對共有靶點進行分析。其中,GO功能富集分析主要涉及對脂多糖的反應、對細菌來源分子的反應、對金屬離子的反應等1619條生物過程;細胞周期蛋白依賴性蛋白激酶全酶復合物、絲氨酸/蘇氨酸蛋白激酶復合物及蛋白激酶復合物等38條細胞組成;核受體活性、配體激活的轉錄因子活性、泛素樣蛋白連接酶結合等120條分子功能,根據P值各篩選前10條結果作圖,詳見圖4。KEGG通路富集分析發現,共有靶點主要富集在腫瘤壞死因子(TNF)、白細胞介素17(IL-17)及磷脂酰肌醇3激酶-絲氨酸/蘇氨酸蛋白激酶(PI3K-AKT)等130條信號通路,根據P值篩選排名前20條結果作圖,詳見圖5。
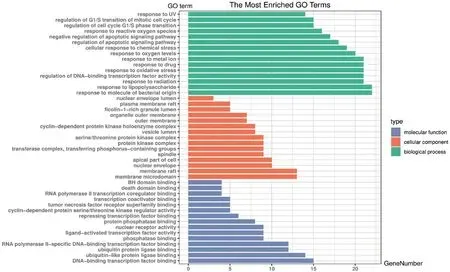
圖4 GO功能富集分析條形圖Fig.4 Bar chart of GO function enrichment analysis
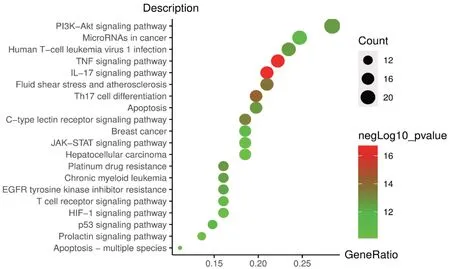
圖5 KEGG通路富集分析氣泡圖Fig.5 Bubble diagram of KEGG pathway enrichment analysis
2.6 通路-核心靶點網絡構建
為了更加清晰地反映通路與核心靶點間的關系,構建了通路-核心靶點網絡(圖6),網絡中節點越大,度值越大。可見,MAPK1,AKT1,MAPK8等靶點富集的信號通路較多,是其核心靶點。
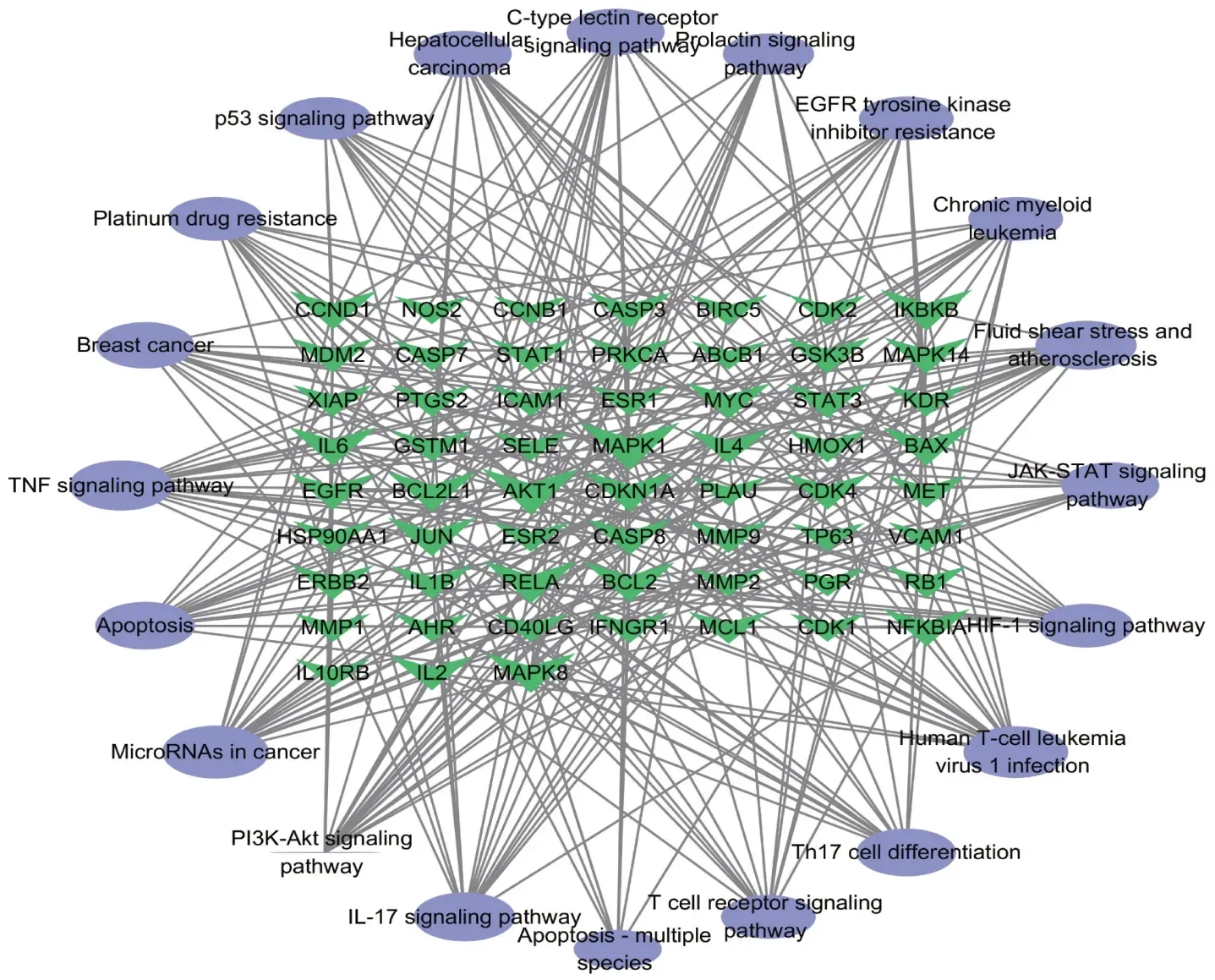
圖6 通路-核心靶點網絡Fig.6 Network of pathways-core targets
2.7 分子對接驗證
采用Autodock Vina軟件對排名前10個核心成分與核心靶點進行分子對接驗證(圖7)。結果顯示,核心成分與核心靶點的對接結合能均低于-5 kJ/mol,表明對接結果良好(圖7 A)。甘草查耳酮A與IL-6、山柰酚與表皮生長因子受體(EGFR)的結合能最低(分別為-9.1,-9.0 kJ/mol),表明其結合能力最強。采用Pymol軟件展示其結合模式(圖7 B和圖7 C),甘草查耳酮A與IL-6在GLN,SER,ASN處形成氫鍵,山柰酚與EGFR在LEU,SER,MET處形成氫鍵,故具有較強的結合力。

圖7 分子對接圖A.Heat map of molecular docking scoring between the core components and core targets B.Binding pattern diagram of licochalcone A and IL-6 C.Binding pattern diagram of kaempferol and EGFRFig.7 Diagram of molecular docking
3 討論
類風濕關節炎的病理特征為反復性的關節滑膜炎及血管翳,具有較高的致殘率,病因復雜,通常與激素、環境、遺傳等因素有關[9]。本研究中基于網絡藥理學方法,通過TCMSP數據庫共篩選得到藤枝愈痹顆粒活性成分67個,主要包括木犀草素、山柰酚、甘草查耳酮A等。木犀草素能抑制類風濕關節炎模型大鼠NLRP3炎性小體的高表達,使VEGF及缺氧誘導因子-1α(HIF-1α)的表達水平下降,并增加骨組織內保護素的表達,從而保護骨關節[10]。山柰酚可顯著抑制TNF-α誘導的MAPK活化,進而抑制類風濕關節炎成纖維細胞樣滑膜細胞的遷移和侵襲[11]。甘草查耳酮能通過增強p62的磷酸化和表達來激活Kelch樣環氧氯丙烷相關蛋白1-核因子E2相關因子2(Keap1-Nrf2)信號,抑制細胞增殖和阻滯細胞周期,誘導凋亡,抑制促炎細胞因子分泌,進而抑制關節炎[12]。毛蕊異黃酮通過激活p62/Nrf2連接的血紅素加氧酶1(HO-1)抑制類風濕關節炎滑膜成纖維細胞中促炎細胞因子的表達,可顯著抑制IL-6和IL-33的分泌[13]。β-谷甾醇能顯著下調類風濕關節炎模型小鼠的炎性細胞因子,減輕其關節腫脹而保護關節[14]。上述活性成分為藤枝愈痹顆粒抗類風濕關節炎的物質基礎,對于后續研究具有重要意義。
PPI及KEGG通路富集分析結果顯示,藤枝愈痹顆粒可能通過IL-6,STAT3,AKT1等靶點調控TNF,IL-17,PI3K/Akt等信號通路,從而發揮治療類風濕關節炎的作用。IL-6為多效應細胞因子,其過度表達可使機體免疫功能失衡而處于病理狀態。研究顯示,IL-6水平的升高可加重患者關節腫痛及類風濕關節炎病情[15]。TNF-α作為一種前細胞因子,可促進IL-6、趨化因子、前列腺素等的大量分泌,導致類風濕關節炎炎性反應與骨破壞[16]。IL-6可促進IL-17的分泌及表達,使滑膜組織增生,加重骨及軟骨的破壞。研究表明,降低患者血清IL-6及IL-17的表達水平,可明顯改善類風濕關節炎的免疫炎性反應[17]。STAT3是類風濕關節炎的關鍵致病因子,可抑制滑膜細胞凋亡,促進血管生成,激活Jun激酶(JNK)/STAT3信號通路,促進類風濕關節炎炎性反應。研究顯示,通過抑制JNK1和STAT3的磷酸化,可抑制JNK/STAT3信號通路活化,從而對類風濕關節炎模型大鼠的炎性損傷及骨組織病變起到保護作用[18]。AKT1被認為與類風濕關節炎滑膜成纖維細胞生成有關。研究顯示,激活AKT1/STAT3能促進B細胞的增殖與分化,進而加重關節炎[19]。AKT及其上游基因PI3K共同組成的PI3K/AKT信號通路在類風濕關節炎的發生與發展中起到了重要作用。研究顯示,通過抑制PI3K/AKT信號的活性,使其下游VEGF的產生及表達水平降低,抑制滑膜組織血管的生成,進而對類風濕關節炎起到治療作用[20]。
綜上所述,藤枝愈痹顆粒通過木犀草素、山柰酚、甘草查耳酮A等成分作用于IL-6,STAT3,AKT1等靶點,從而發揮治療類風濕關節炎的作用,涉及TNF,IL-17,PI3K/AKT等信號通路。

