全球重組蛋白疫苗研發(fā)態(tài)勢(shì)簡(jiǎn)析*
楊瀟逸,陳 娟,嚴(yán) 舒,盧 巖,歐陽昭連
(中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)信息研究所,北京 100020)
重組蛋白疫苗是一類不包含任何完整病原體,主要由可在異源表達(dá)系統(tǒng)中生產(chǎn)的特定蛋白質(zhì)抗原配制而成的疫苗[1]。根據(jù)所需生產(chǎn)抗原的不同,可采用細(xì)菌、酵母菌、昆蟲細(xì)胞、植物細(xì)胞、哺乳動(dòng)物細(xì)胞系等不同的異源表達(dá)系統(tǒng)[2-3]。從目標(biāo)病毒或細(xì)菌中提取特定抗原的DNA片段并插入細(xì)胞的基因組或質(zhì)粒中,這些表達(dá)系統(tǒng)便能產(chǎn)生對(duì)應(yīng)的蛋白質(zhì)抗原,隨后將蛋白質(zhì)提純作為疫苗的活性成分。此外,重組蛋白疫苗中通常會(huì)添加佐劑,以加強(qiáng)和延長(zhǎng)接種者對(duì)疫苗的免疫反應(yīng)[4]。與使用完整病原體配制而成的疫苗相比,重組蛋白疫苗能使免疫反應(yīng)集中在識(shí)別少量目標(biāo)抗原上,且對(duì)免疫功能低下者更安全。由于重組蛋白疫苗具有安全性高、穩(wěn)定性強(qiáng)、成本較低等優(yōu)點(diǎn),已被廣泛用于預(yù)防乙型病毒性肝炎(簡(jiǎn)稱乙肝),百日咳、白喉、破傷風(fēng)(簡(jiǎn)稱百白破),流行性感冒(簡(jiǎn)稱流感)等多種傳染病。自新型冠狀病毒肺炎(簡(jiǎn)稱新冠肺炎)疫情暴發(fā)以來,全球已有多款針對(duì)新型冠狀病毒的重組蛋白疫苗進(jìn)入臨床研究階段[5]。為此,本研究中探討了全球重組蛋白疫苗的研發(fā)態(tài)勢(shì)。現(xiàn)報(bào)道如下。
1 資料與方法
采用計(jì)算機(jī)檢索Cortellis數(shù)據(jù)庫中全球已上市、處于注冊(cè)或預(yù)注冊(cè)狀態(tài)、已啟動(dòng)Ⅲ期臨床試驗(yàn)的重組蛋白疫苗的相關(guān)信息,檢索時(shí)間為自建庫起至2021年9月1日,形成數(shù)據(jù)集。分別從原研單位國家分布、首次上市/Ⅲ期臨床試驗(yàn)啟動(dòng)時(shí)間、適應(yīng)證等方面分析其全球研發(fā)概況,并基于原研單位國家分析各國在重組蛋白疫苗領(lǐng)域的研發(fā)進(jìn)展。對(duì)于有多個(gè)適應(yīng)證的產(chǎn)品,按其上市進(jìn)展處于最高狀態(tài)的適應(yīng)證劃分。由于樣本量較小,本研究中僅作描述性分析,未進(jìn)行統(tǒng)計(jì)學(xué)檢驗(yàn)。
2 結(jié)果
2.1 全球研發(fā)概況
原研單位國家分布:截至檢索時(shí)間,全球已有74個(gè)重組蛋白疫苗上市銷售,或處于預(yù)注冊(cè)或注冊(cè)狀態(tài)。從原研單位國家分布來看,中國原研產(chǎn)品數(shù)量最多(21個(gè)),美國位居第二(15個(gè)),其次為英國(11個(gè))、古巴(5個(gè))和法國(4個(gè))。其中,36個(gè)產(chǎn)品在多個(gè)國家或地區(qū)上市或處于注冊(cè)、預(yù)注冊(cè)狀態(tài),39個(gè)產(chǎn)品僅在1個(gè)國家上市或處于注冊(cè)、預(yù)注冊(cè)狀態(tài)。此外,全球范圍內(nèi)還有29個(gè)產(chǎn)品已進(jìn)入Ⅲ期臨床試驗(yàn)階段,同樣以中國原研產(chǎn)品數(shù)量最多(12個(gè)),其次為美國(7個(gè))和日本(3個(gè))。詳見圖1。
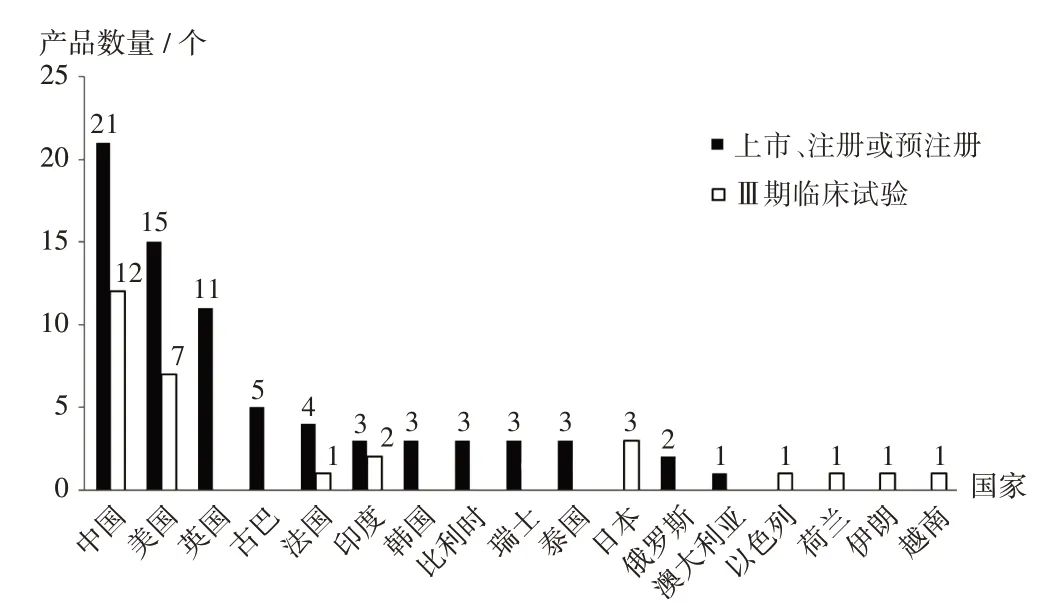
圖1 全球重組蛋白疫苗原研單位國家分布Fig.1 Distribution of countries where institutions researching the recombinant protein vaccine located in the world
首次上市/Ⅲ期臨床試驗(yàn)啟動(dòng)時(shí)間:由圖2可知,23個(gè)產(chǎn)品于2016年至2021年首次啟動(dòng)Ⅲ期臨床試驗(yàn),超過該時(shí)間段內(nèi)上市、注冊(cè)或預(yù)注冊(cè)的重組蛋白疫苗數(shù)量21個(gè)。
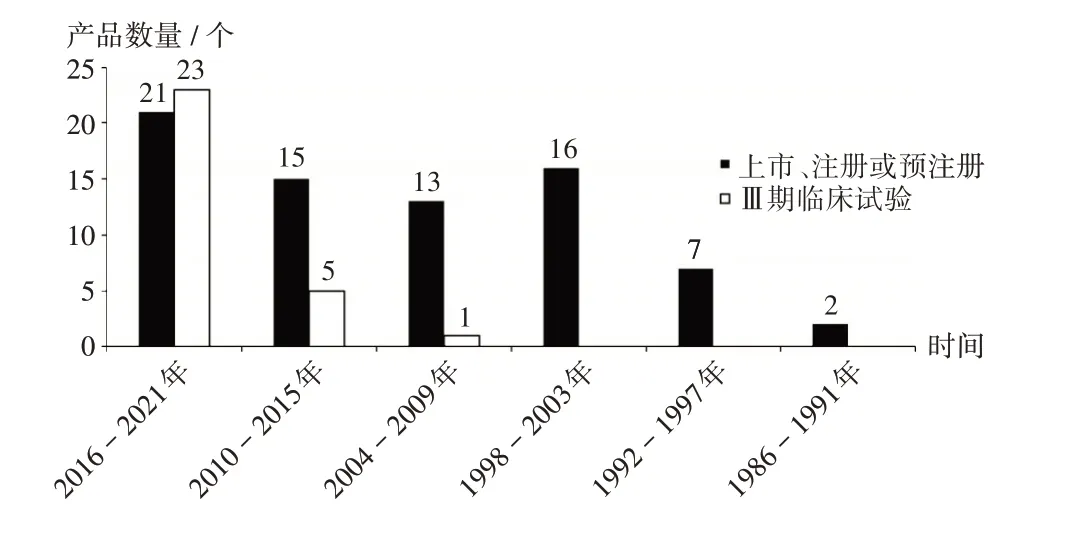
圖2 全球重組蛋白疫苗首次上市或Ⅲ期臨床試驗(yàn)啟動(dòng)時(shí)間分布Fig.2 Distribution of time to market for the first time or time to start the phaseⅢclinical trial of recombinant protein vaccine in the world
適應(yīng)證分布:74個(gè)已上市、注冊(cè)或預(yù)注冊(cè)產(chǎn)品中,適應(yīng)證涵蓋乙肝病毒感染的產(chǎn)品數(shù)量最多(30個(gè)),其次為百白破(18個(gè))、流感嗜血桿菌感染(12個(gè))、流感病毒感染(11個(gè))、腦膜炎奈瑟球菌感染(6個(gè))、脊髓灰質(zhì)炎病毒感染(6個(gè))。其中,14個(gè)產(chǎn)品同時(shí)涵蓋百白破和其他1種以上適應(yīng)證。29個(gè)進(jìn)入Ⅲ期臨床試驗(yàn)階段的產(chǎn)品中,適應(yīng)證為流感病毒感染的產(chǎn)品數(shù)量最多(6個(gè));其次為人乳頭狀瘤病毒(HPV)感染(5個(gè))、非HPV感染引起的腫瘤(4個(gè))、肺炎鏈球菌感染(3個(gè)),上述3類適應(yīng)證的產(chǎn)品數(shù)量均超過對(duì)應(yīng)的已上市產(chǎn)品數(shù)。對(duì)于有多個(gè)適應(yīng)證的產(chǎn)品,僅統(tǒng)計(jì)已獲批上市或已進(jìn)入Ⅲ期臨床試驗(yàn)階段的適應(yīng)證。
2.2 代表性國家研發(fā)進(jìn)展
中國:有21個(gè)產(chǎn)品處于上市、預(yù)注冊(cè)或注冊(cè)狀態(tài),其中最早上市的產(chǎn)品為1997年由北京天壇生物制品股份有限公司、武漢生物制品研究所有限責(zé)任公司和蘭州生物制品研究所共同研制的吸附無細(xì)胞百白破聯(lián)合疫苗,14個(gè)產(chǎn)品于2014年及以前上市或預(yù)注冊(cè),11個(gè)產(chǎn)品的適應(yīng)證為百白破、乙肝或流感嗜血桿菌感染;僅4個(gè)產(chǎn)品在中國以外的國家上市或注冊(cè),分別為中國疾病預(yù)防控制中心研制的重組乙型肝炎疫苗(CHO細(xì)胞)、國家傳染病診斷試劑與疫苗工程技術(shù)研究中心研制的重組戊型肝炎疫苗(商品名益可寧,大腸埃希菌)、中國科學(xué)院微生物研究所和重慶智飛生物制品股份有限公司研制的重組新型冠狀病毒疫苗(商品名智克威得,CHO細(xì)胞)[6]和中國醫(yī)藥集團(tuán)有限公司研制的重組新型冠狀病毒疫苗(CHO細(xì)胞)。12個(gè)處于Ⅲ期臨床試驗(yàn)階段的疫苗中,8個(gè)產(chǎn)品在2020年及以后啟動(dòng),其中5個(gè)產(chǎn)品為全球僅有的處于Ⅲ期臨床試驗(yàn)階段的HPV疫苗,原研單位分別為成都生物制品研究所有限責(zé)任公司、上海博唯生物科技有限公司(2個(gè)產(chǎn)品)、北京康樂衛(wèi)士生物技術(shù)股份有限公司和江蘇睿捷生物科技有限公司;其他產(chǎn)品適應(yīng)證涵蓋腦膜炎奈瑟球菌感染、流感病毒感染、傷寒沙門菌感染、肺炎鏈球菌感染和新型冠狀病毒感染。

圖3 全球重組蛋白疫苗適應(yīng)證分布Fig.3 Distribution of indications of recombinant protein vaccine in the world
美國:有15個(gè)產(chǎn)品處于上市、預(yù)注冊(cè)或注冊(cè)狀態(tài),其中最早上市的產(chǎn)品為1986年于原德意志聯(lián)邦共和國上市的由Merck&CO.,Inc.研發(fā)的乙肝疫苗Recombivax HB,同時(shí)也是全球最早上市的重組蛋白疫苗[7],8個(gè)產(chǎn)品于2014年及以前上市;除美國Chiron公司(已被瑞士諾華公司收購)開發(fā)的B型腦膜炎疫苗(新西蘭菌株)僅在新西蘭上市外,其他14個(gè)產(chǎn)品均在全球多個(gè)國家和地區(qū)上市。7個(gè)處于Ⅲ期臨床試驗(yàn)的疫苗中,適應(yīng)證涵蓋流感病毒感染、呼吸道合胞病毒感染、艱難梭狀芽孢桿菌感染、非小細(xì)胞肺癌和獲得性免疫缺陷綜合征;除美國Protein Sciences公司的流感疫苗FluNhance和美國諾瓦瓦克斯醫(yī)藥公司的流感疫苗NanoFlu外,其他5個(gè)產(chǎn)品均在美國及以外的多個(gè)國家開展臨床試驗(yàn)。
英國:有11個(gè)產(chǎn)品處于上市或注冊(cè)狀態(tài),且原研單位均為英國葛蘭素史克公司,最早上市的產(chǎn)品為1997年于德國上市的甲型病毒性肝炎和乙肝疫苗Twinrix,除1款預(yù)防惡性瘧原蟲感染的瘧疾疫苗于2019年上市外,其余產(chǎn)品均在2005年及以前上市;除百白破和乙肝四聯(lián)疫苗Infanrix Hep B僅在新西蘭與百白破、乙肝和脊髓灰質(zhì)炎五聯(lián)疫苗Pediarix僅在美國上市外,其余產(chǎn)品均在包括英國在內(nèi)的多個(gè)國家和地區(qū)上市。截至檢索時(shí)間,英國尚無處于Ⅲ期臨床試驗(yàn)階段的重組蛋白疫苗。
古巴:有5個(gè)產(chǎn)品上市,適應(yīng)證涵蓋乙肝、丁型病毒性肝炎、流感、百白破和腦膜炎,除1991年于古巴上市的B型腦膜炎疫苗由古巴芬萊研究院研制外,其余4個(gè)產(chǎn)品均由古巴遺傳工程與生物技術(shù)中心研制;4款疫苗僅在古巴上市,最新產(chǎn)品為2018年上市的乙肝疫苗ABX-203。截至檢索時(shí)間,古巴尚無處于Ⅲ期臨床試驗(yàn)階段的重組蛋白疫苗。
日本:尚無已上市產(chǎn)品,僅3個(gè)產(chǎn)品進(jìn)入Ⅲ期臨床試驗(yàn)階段,啟動(dòng)時(shí)間均在2017年及以前,且適應(yīng)證全部與腫瘤相關(guān),分別為久留米大學(xué)研制的用于治療激素抵抗性前列腺癌肽疫苗、Onco Therapy Science,Inc.研制的用于治療食道腫瘤的疫苗S-588410、Tella公司研制的用于治療胰腺腫瘤的疫苗Vaccell[8]。
3 討論
3.1 研發(fā)和上市時(shí)間趨勢(shì)
全球首次上市或進(jìn)入Ⅲ期臨床試驗(yàn)階段的產(chǎn)品數(shù)量隨時(shí)間的推移,均呈現(xiàn)穩(wěn)步上升趨勢(shì)。自乙肝疫苗Recombivax HB于1986年上市以來,蛋白質(zhì)重組技術(shù)在疫苗中的應(yīng)用得到飛速發(fā)展[7],有6個(gè)產(chǎn)品于1997年獲批上市,為截至檢索時(shí)間重組蛋白疫苗上市數(shù)量最多的年份。2017年至2021年,上市、注冊(cè)或預(yù)注冊(cè)的重組蛋白疫苗數(shù)量達(dá)19個(gè)(25.68%),處于Ⅲ期臨床試驗(yàn)階段的達(dá)20個(gè),超過同期已上市產(chǎn)品數(shù)量的總和,預(yù)計(jì)在未來5~10年內(nèi)有更多產(chǎn)品上市。
3.2 適應(yīng)證分布
早期獲批上市產(chǎn)品的適應(yīng)證以全球患病人口基數(shù)較大、通過公共衛(wèi)生防治措施較難根除的流行病為主,如乙肝、脊髓灰質(zhì)炎、流感等,全球有多家研究機(jī)構(gòu)和企業(yè)進(jìn)行研制,產(chǎn)品同質(zhì)性較高。隨著新生兒需要接種疫苗數(shù)量的逐漸增加及技術(shù)的逐漸成熟,同時(shí)涵蓋多種適應(yīng)證的聯(lián)合疫苗開始獲批上市。最常見的聯(lián)合疫苗為以百白破三聯(lián)疫苗為基礎(chǔ)的百白破+乙肝疫苗(如英國葛蘭素史克公司研制的Infanrix Hep B)、百白破+流血嗜血桿菌疫苗(如法國賽諾菲巴斯德公司研制的Actacel)、百白破+脊髓灰質(zhì)炎病毒(如英國葛蘭素史克公司研制的Kinrix)等四聯(lián)疫苗,以及上述適應(yīng)證間進(jìn)一步組合形成的五聯(lián)甚至六聯(lián)疫苗,能減少接種次數(shù)。目前,中國僅有1款國產(chǎn)四聯(lián)疫苗上市,即由北京民海生物科技有限公司研制的無細(xì)胞百白破b型流感嗜血桿菌聯(lián)合疫苗,但五聯(lián)和六聯(lián)疫苗尚未有成熟產(chǎn)品。
近年來,全球重組蛋白疫苗的適應(yīng)證逐漸多元化,出現(xiàn)一批適應(yīng)證為HPV感染、腦膜炎奈瑟球菌感染、肺炎鏈球菌感染、惡性瘧原蟲感染、呼吸道合胞病毒感染等的產(chǎn)品,但目前多數(shù)仍處于臨床研究階段。自新冠肺炎疫情暴發(fā)以來,已有4款預(yù)防新型冠狀病毒感染的重組蛋白疫苗上市,分別為美國諾瓦瓦克斯醫(yī)藥公司研制的NVX-CoV2373[9]、中國科學(xué)院微生物研究所和重慶智飛生物制品股份有限公司研制的重組新型冠狀病毒疫苗(CHO細(xì)胞)[6]、中國醫(yī)藥集團(tuán)有限公司研制的重組新型冠狀病毒疫苗(CHO細(xì)胞)和俄羅斯“矢量”國家病毒學(xué)與生物技術(shù)國家科學(xué)中心研制的肽疫苗;3款預(yù)防新型冠狀病毒感染的疫苗處于Ⅲ期臨床試驗(yàn)階段,分別為三葉草生物制藥有限公司研制的SCB-2019[10]、法國賽諾菲巴斯德公司研制的Vidprevtyn[11]和越南Nanogen Biopharmaceutical公司研制的Nanocovax[12]。
除傳染病外,部分重組蛋白疫苗圍繞腫瘤等適應(yīng)證進(jìn)行開發(fā),如日本有3個(gè)產(chǎn)品分別針對(duì)激素抵抗性前列腺癌、食道腫瘤和胰腺腫瘤[8],以及法國OSE Immunotherapeutics公司研制的治療非小細(xì)胞肺癌的OSE-2101[13]。然而,這些產(chǎn)品仍處于Ⅲ期臨床試驗(yàn)研究階段,且首次啟動(dòng)日期均在2017年及之前,至2021年以來再無新產(chǎn)品進(jìn)入Ⅲ期臨床試驗(yàn)階段。因此,重組蛋白疫苗應(yīng)用于癌癥治療的前景尚不明朗,可能需要在技術(shù)層面取得進(jìn)一步突破后才能迎來大規(guī)模應(yīng)用。
3.3 上市地點(diǎn)
研制這類產(chǎn)品的主要目的是滿足本國群眾對(duì)相應(yīng)傳染病預(yù)防的基本需求,故大部分產(chǎn)品的首次上市地點(diǎn)均為原研單位所在國家,如1992年由韓國株式會(huì)式LG生命科學(xué)研制的韓國首個(gè)乙肝疫苗,1997年由印度Shantha Biotechnics公司研制的印度首個(gè)乙肝疫苗Shanvac-B,1997年由北京天壇生物制品股份有限公司、武漢生物制品研究所有限責(zé)任公司和蘭州生物制品研究所研制的中國首個(gè)吸附無細(xì)胞百白破聯(lián)合疫苗等。總體而言,大部分發(fā)達(dá)國家原研單位研制的產(chǎn)品上市地點(diǎn)遍布全球多個(gè)國家和地區(qū),而中國、印度、古巴和俄羅斯等國研制的產(chǎn)品大多僅在本國上市。究其原因:1)國外產(chǎn)品研發(fā)和上市起步較早,可在沒有同類產(chǎn)品競(jìng)爭(zhēng)的情況下優(yōu)先搶占大部分市場(chǎng),如Merck&Co.,Inc.于1986年便已上市首款乙肝病毒疫苗;2)國外產(chǎn)品更新迭代和技術(shù)積累較快,后發(fā)國家的產(chǎn)品與之相比無優(yōu)勢(shì),如英國葛蘭素史克公司在2001年上市的百白破、流感嗜血桿菌、脊髓灰質(zhì)炎和乙肝六聯(lián)疫苗Infanrix hexa[14],涵蓋適應(yīng)證數(shù)量超過其他所有同類疫苗;3)早年中國制藥企業(yè)國際化能力普遍較弱,不熟悉國外藥品的監(jiān)管法規(guī),取得上市許可的難度較大,但隨著產(chǎn)業(yè)成熟度的提升,這一現(xiàn)象將逐漸改善,如中國科學(xué)院微生物研究所和重慶智飛生物制品股份有限公司聯(lián)合開發(fā)的重組蛋白新型冠狀病毒疫苗(CHO細(xì)胞)已在烏茲別克斯坦和哥倫比亞等國獲得緊急使用授權(quán),為全球抗疫貢獻(xiàn)中國力量。
3.4 原研單位及所在國家
國外產(chǎn)品的原研單位以大型制藥企業(yè)為主,如英國葛蘭素史克公司上市產(chǎn)品數(shù)量全球最多(11個(gè)),其次為美國Chiron公司(6個(gè))和法國賽諾菲巴斯德公司(4個(gè))。中國和古巴的原研單位以研究機(jī)構(gòu)為主,如古巴遺傳工程與生物技術(shù)中心和蘭州生物制品研究所均擁有4個(gè)上市產(chǎn)品。近年來,越來越多的產(chǎn)品由新興小型企業(yè)率先進(jìn)行研發(fā),如上海博唯生物科技股份有限公司研制的目前處于Ⅲ期臨床試驗(yàn)階段的四價(jià)和九價(jià)HPV疫苗,以及廈門萬泰滄海生物技術(shù)有限公司研制的已上市的雙價(jià)人乳頭瘤病毒疫苗(大腸桿菌)等。
全球重組蛋白疫苗商業(yè)化起步較早,上市產(chǎn)品數(shù)量逐漸增加,獲批適應(yīng)證以傳染性疾病為主,自新冠肺炎疫情暴發(fā)以來也有多款針對(duì)新型冠狀病毒的預(yù)防性疫苗獲批上市或進(jìn)入臨床試驗(yàn)階段,但在腫瘤治療領(lǐng)域的產(chǎn)品開發(fā)程度還較有限。中國重組蛋白疫苗產(chǎn)品的上市和處于Ⅲ期臨床試驗(yàn)階段的數(shù)量均全球領(lǐng)先,但許多早期產(chǎn)品的同質(zhì)化程度較高,在海外成功上市的產(chǎn)品數(shù)量較少,未來有待進(jìn)一步提升。

