基于數據庫數據分析腦膠質瘤組織中FN1基因的表達變化及其預后預測效能
王計虎,王政,范文勇,鄭佳,陳偉強,許加軍
山東第一醫科大學附屬省立醫院神經外科,濟南 250021
膠質瘤是中樞神經系統最常見的惡性腫瘤,起源于神經膠質細胞或前體細胞,包括星形細胞瘤、少突膠質細胞瘤、室管膜瘤或少突星形細胞瘤[1]。膠質瘤具有侵襲性強、易復發、預后差等特點。按照膠質瘤惡性程度分級,WHO把膠質瘤分為I~IV級。I、II級屬于低級別膠質瘤(LGG),III、IV級屬于高級別膠質瘤(HGG),膠質瘤的惡性級別越高預后越差。膠質瘤的常規治療包括手術切除、化療和放射治療,由于腫瘤的異質性、侵襲性和血腦屏障的存在,治療效果較差,高級別膠質瘤患者的生存期一般不足兩年[2]。因此,探索膠質瘤潛在的生物標志物和治療靶點具有重要意義。研究[3]發現,在肺癌中,纖維連接蛋白1(FN1)可以通過激活FAK信號來促進肺癌細胞的遷移。FN1先前被證明可以激活特定的基質金屬蛋白酶(MMPs),促進乳腺癌的侵襲和轉移[4]。在黑色素瘤中,FN1基因表達的上調通過降低Bax/Bcl2而抑制細胞凋亡,促進腫瘤細胞的增殖[5]。FN1基因在宮頸癌中有明顯表達,miR-432抑制FN1基因的表達可抑制宮頸癌細胞的增殖和侵襲[6]。由此可見,FN1基因是一種體內廣泛表達的癌基因。然而,FN1基因在膠質瘤中作用的研究尚少見報道。隨著基因測序技術的迅速發展,癌癥基因組圖譜計劃(TCGA)、腫瘤免疫評估數據庫(TIMER)等數據庫為膠質瘤生物學研究提供了可能。本研究利用生信分析技術,觀察了FN1基因在膠質瘤組織中的表達變化,并探討了其意義。
1 資料與方法
1.1 數據獲取與預處理從TCGA(https://portal.gdc.cancer.gov/)數據庫下載膠質瘤(LGG 278例,HGG 411例)FN1基因相關測序及臨床數據。使用R軟件3.6.3對TCGA GBMLGG(膠質瘤)項目中level 3 HTSeq-FPKM格式的RNAseq數據進行統計分析與可視化,將FPKM(Fregments per Kilobase per Million)格式的RNAseq數據進行log2轉化,數據過濾時剔除臨床信息不完整的數據。此外,從GTEx數據庫中獲取正常腦組織數據(1 157例份)作為對照。
1.2 膠質瘤組織FN1基因與患者臨床病理特征的關系分析及診斷效能評估通過R軟件中的“ggplot2”軟件包對TCGA數據庫中的膠質瘤和GTEx數據庫中的正常腦組織的FN1基因表達數據進行分析,并繪制基因差異表達圖。將TCGA數據庫中膠質瘤患者的臨床病理特征數據導入到R軟件中,利用“ggplot2”軟件包進行Kruskal或Dunn’s檢驗,分析FN1基因表達與膠質瘤患者臨床病理特征的相關性。
基于TCGA數據庫內膠質瘤標本中FN1基因表達數據與患者臨床病理特征的信息,用R軟件中的“Survival”和“Survminer”軟件包繪制不同FN1基因表達水平(以基因表達中位數為分界分為高表達與低表達)的生存曲線以及在不同WHO級別膠質瘤中的FN1基因的生存曲線。然后將GTEx數據庫中的正常腦組織的FN1基因表達數據導入R軟件,用“pROC”和“ggplot2”軟件包繪制FN1基因和膠質瘤的受試者工作特征曲線(ROC)。
1.3 FN1基因與膠質瘤免疫細胞浸潤相關性TCGA數據庫膠質瘤的測序數據中提取免疫細胞相關項數據,采用R語言GSVA包ssGSEA算法分析FN1基因與24種不同亞型的免疫細胞浸潤的相關性,并做可視化分析。將6種常見免疫細胞,如B細胞、CD8+T細胞、CD4+T細胞、巨噬細胞、中性粒細胞、樹突狀細胞與FN1基因在TIMER2.0數據庫中進行聯合分析,得出FN1基因與6種免疫細胞免疫浸潤的相關性。
1.4 FN1基因表達與膠質瘤細胞功能狀態的相關性分析在cancerSEA(調查細胞功能狀態的數據庫,其內包含多種癌癥及多種細胞功能狀態數據)的Search功能區,輸入基因名稱FN1,選擇膠質瘤進行基因與癌癥相關性分析。與輸入基因有顯著相關性的細胞功能狀態被篩選出來,自動繪制散點圖。
1.5 FN1基因的生物學功能分析利用R語言“clusterProfiler”和“ggplot2”軟件包對FN1基因進行GO功能注釋和KEGG通路富集。在R語言相關分析包中調整富集分析參數設置后,以P<0.1且Q<0.2為顯著富集。
使用STRING在線數據庫進行FN1檢索,并下載檢索后原始數據,利用Cytoscape進行數據分析并進行可視化處理,構建FN1的蛋白互作網絡,找出FN1在體內的分子信號通路及FN1的互作蛋白。
2 結果
2.1 FN1基因在膠質瘤和正常腦組織中的表達比較,與患者臨床病理特征的相關性,對膠質瘤的診斷效能TCGA數據庫及GTEx數據庫聯合分析結果顯示,FN1基因在正常腦組織中表達量中位數為5.010,在膠質瘤中為7.234,與正常腦組織相比,膠質瘤組織中FN1基因表達明顯上調(P<0.01)。
WHO II、III及IV級膠質瘤中FN1基因表達量中位數分別為3.612、4.193、6.135,各級別之間兩兩比較,P均<0.01。膠質瘤組織中FN1基因表達量低的樣本IDH突變率(88%)高于FN1基因表達量高的樣本(40%)。FN1基因表達量低的樣本1p19q共缺失概率(37%)高于FN1基因表達量高的樣本(12%)。年齡>60歲的患者FN1基因高表達比例(77%)比≤60歲的患者(43%)高(P<0.01)。膠質母細胞瘤患者FN1基因表達量中位數(6.343)高于其他病理類型[星形細胞瘤(4.211),少突星型細胞瘤(3.987),少突膠質細胞瘤(3.741)],差異有統計學意義(P均<0.01)。
FN1基因表達與膠質瘤患者總生存期(OS)、疾病特異性生存率(DSS)、無進展生存期(PFI)呈負相關(P均<0.001);在WHOⅢ級膠質瘤中,FN1基因表達與患者總生存期呈負相關(P<0.05),在WHOⅡ/Ⅳ級膠質瘤中,FN1基因表達與患者總生存期無相關性(P分別為0.277、0.207);FN1基因的ROC分析 結 果 表 明,ROC下 面 積 為0.926,(95%CI=0.914~0.937)。
2.2 FN1基因表達與膠質瘤微環境中免疫細胞浸潤的相關性TIMER數據庫結果顯示,FN1基因表達與活化樹突狀細胞、細胞毒性細胞、嗜酸性粒細胞、未成熟樹突狀細胞、巨噬細胞、中性粒細胞、NK CD56dim細胞、自然殺傷細胞、T cells、輔助性T細胞、Th1細胞、Th17細胞、Th2細胞呈正相關關系(Rs分別為0.490、0.337、0.533、0.434、0.668、0.590、0.398、0.242、0.399、0.329、0.245、0.209、0.611,P均<0.001)。與NK CD56bright cells、漿細胞樣樹突狀細胞、濾泡輔助性T細胞、Tgd細胞、調節性T細胞五種免疫細胞呈負相關關系(Rs分別為-0.329、-0.401、-0.183、-0.146、-0.195,P均<0.01)。
TIMER數據庫分析提示,在LGG中,FN1基因表達與B Cell、CD8+T Cell、CD4+T Cell、巨噬細胞、中性粒細胞、樹突狀細胞呈正相關(偏相關分析系數r分別為0.274、0.311、0.336、0.417、0.381、0.398,P均<0.001),與腫瘤純度無關(P>0.05);在GBM中,FN1基因表達與腫瘤純度、CD8+T細胞呈負相關(r分別為-0.319、-0.109,P均<0.05),與樹突狀細胞呈正相關(r=0.408,P<0.001),與B細胞、CD4+T細胞、巨噬細胞、中性粒細胞無關(P>0.05)。
2.3 FN1基因表達與膠質瘤細胞功能狀態的相關性FN1基因的表達與腫瘤血管內皮細胞再生、腫瘤細胞分化呈正相關(r分別為0.58、0.47,P均<0.01);與腫瘤細胞DNA損傷、細胞周期呈負相關(r分別為=-0.52、-0.45,P均<0.01)。
2.4 FN1基因的生物學功能FN1基因有關的生物過程(BP)共有351條,細胞組分(CC)共有28條,分子功能(MF)共有94條;KEGG分子信號通路29條。以P<0.001為篩選條件,其中生物過程是補體激活、循環免疫球蛋白介導的體液免疫應答、體液免疫反應;細胞組分是免疫球蛋白復合物、循環免疫球蛋白復合物、質膜外側;分子功能是抗原結合、免疫球蛋白受體結合、細胞外基質結構成分。分子信號通路主要與細胞因子—細胞因子受體相互作用、病毒蛋白與細胞因子及其受體的相互作用、細胞外基質—受體相互作用有關。
FN1蛋白互作網路提示FN1與ITGB1、ITGB3、ITGA3、ITGA4、ATGA5、ITGAV、CD44和THBS1蛋白關系密切,見圖1。
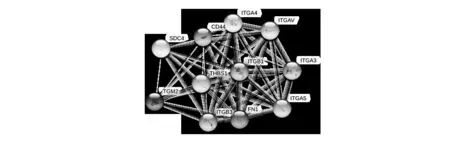
圖1 膠質瘤中FN1的蛋白互作網絡
3 討論
FN1基因位于2號染色體上[7],編碼由2 477個氨基酸組成的細胞外基質糖蛋白—纖維連接蛋白1[8]。FN1在多種細胞類型中廣泛表達,同時存在于血漿和細胞表面,介導細胞和細胞外基質之間的廣泛相互作用,在細胞黏附、遷移、生長和分化中發揮重要作用。FN1同時參與傷口愈合、胚胎發育、防御機制和腫瘤發生等生命過程[9]。
2021 年相關文獻[10]報道在膠質瘤中,通過分析GEPIA(基因表達譜交互分析)數據庫,驗證了FN1基因在膠質瘤中高表達并且與膠質瘤分級相關,且是膠質瘤的不良預后因素。本研究利用TCGA和GTEx數據庫聯合分析發現,FN1基因在膠質瘤中表達高于正常腦組織,并且與腫瘤WHO分級、IDH分型、1p19q狀態、患者年齡及膠質瘤的組織病理學分型有關。K-M生存分析表明FN1基因表達與膠質瘤患者的總生存期、無進展生存期呈負相關。因此認為FN1基因在膠質瘤中高表達并且與預后相關,可以作為臨床膠質瘤的診斷和預后判斷指標應用于臨床。
目前,腫瘤的免疫微環境受到越來越多的關注,尤其是浸潤性免疫細胞。文獻報道,膠質瘤相關巨噬細胞/單核細胞作為腫瘤支持細胞,可以從血液循環侵襲到膠質瘤,已被證明可促進膠質瘤的生長和侵襲[11]。調節性T細胞(Treg)通過依賴CTLA-4和CD28的反饋環進行自我調節,可促進腫瘤免疫耐受,達到免疫逃避[12]。腫瘤浸潤性T細胞中CD4+和CD8+的百分比與腫瘤分級和預后相關。最近一項針對ErbB2的CAR NK細胞靶向治療膠質瘤的可行性研究已經完成,為NK細胞治療膠質瘤的臨床應用奠定了基礎[13]。這些研究提示腫瘤浸潤性免疫細胞對膠質瘤的進展起著重要作用。有研究[14]利用CiberSort在線分析,得出在甲狀腺癌中,FN1表達與免疫滲透的巨噬細胞、CD4+T細胞及輔助性T細胞等密切相關。本研究利用TCGA及TIMER數據庫數據分析,發現FN1的表達與樹突狀細胞、細胞毒性細胞、嗜酸性粒細胞、巨噬細胞、中性粒細胞及自然殺傷細胞等密切相關。因此認為,FN1表達可能通過促進膠質瘤免疫微環境中的免疫細胞浸潤來介導膠質瘤的發生與發展。目前,免疫細胞靶向治療已逐漸成為惡性腫瘤的常規治療手段,聯合FN1的靶向治療可以成為一個新的方向。
據報道,FN1基因表達與血管內皮生長因子(VEGF)有關,VEGF在腫瘤微環境中高度表達,并誘導腫瘤血管生成,在不同類型癌癥中發揮重要作用[6]。已有研究[15]表明,纖維連接蛋白的缺失顯著降低了膠質母細胞瘤的生長和血管生成。本研究結果顯示,FN1基因表達與腫瘤血管內皮細胞再生呈顯著正相關,因此認為,FN1基因可能通過促進腫瘤微環境中的血管增生,從而促進膠質瘤生長。通過抑制FN1基因的表達影響腫瘤血管增生,從而抑制膠質瘤的生長也許膠質瘤治療的另一個研究方向。研究[16]發現,FN1基因在膠質瘤的細胞外基質中高水平表達。本研究中KEGG和GO富集分析提示,FN1主要定位在腫瘤微環境細胞外基質中,并且與細胞因子建立多種信號通路。膠質瘤微環境中豐富的細胞外基質非常重要,是維持膠質瘤形態、細胞分化和增殖的關鍵,以上信息表明FN1基因通過在細胞外基質中高水平表達,來豐富細胞外基質,從而維持腫瘤的分化和增殖。由此可見,FN1在膠質瘤組織中的定位是細胞外基質中,明確FN1的作用場所,進而更深地理解該蛋白的分子作用機制。
蛋白互作網絡提示FN1與ITGB1、ITGB3及CD44等蛋白密切相關。ITG相關蛋白屬于整合素家族,它們與細胞外基質和細胞骨架相互作用,與細胞增殖、癌變和免疫反應等有關[17]。有研究[18]發現,FN1與腫瘤細胞上的整合素受體結合后,通過激活Src激酶來促進Survivin的表達和免疫細胞的浸潤,促進膠質瘤的進展。CD44蛋白是一種非激酶跨膜糖蛋白,可以激活細胞信號通路,誘導細胞增殖,在癌癥發生和發展中發揮作用[19]。本研究利用生信分析預測的FN1的互作蛋白包括ITG相關蛋白、CD44、SDC4等。說明FN1可能與ITG相關蛋白之間相互作用從而參與膠質瘤的發生發展。目前FN1與CD44或SDC4之間的相關研究仍未見報道,有待進一步研究。
綜上所述,FN1基因在膠質瘤中高表達,并且是膠質瘤患者不良預后的影響因素。在促進膠質瘤發生發展中,FN1基因和腫瘤微環境免疫細胞浸潤、腫瘤血管增生和與多種蛋白建立信號通路有關。本研究為純生物信息學分析,有待體內外實驗進一步驗證。

