柱前衍生化高效液相色譜法測定生物樣本中短鏈脂肪酸及乳酸含量
王國盼,黃偉健,霍金洪,顏毛毛,吳少輝,郝占西,魏遠安
(量子高科(廣東)生物有限公司,廣東 江門 529081)
腸道菌群與多種疾病的發生發展密切相關,包括慢性胃腸疾病、神經系統疾病及全身性疾病。在代謝綜合癥發生及發展過程中,腸道菌群組成發生特征性的改變,這可以通過益生元、膳食纖維等營養調節從而維持并改善腸道菌群的結構與功能,以促進健康、減少發病率。腸道菌群影響宿主生理的途徑之一是由其代謝產物短鏈脂肪酸(short-chain fatty acids,SCFAs)介導的。SCFAs是指碳原子數為1~6的有機脂肪酸,主要包括乙酸、丙酸、丁酸、異丁酸、戊酸、異戊酸和己酸,其中乙酸、丙酸和丁酸的含量之和占腸道SCFAs總量的90%~95%。SCFAs在調節宿主健康方面起重要作用。SCFAs可作為腸道上皮細胞的能源物質,維護腸道形態及功能,并對結腸炎等腸道疾病具有一定的治療作用;部分SCFAs從腸腔轉移至遠端器官(如肝臟),作為底物或信號分子調節脂肪積累與食欲,參與糖異生代謝,維持宿主葡萄糖穩態。越來越多的證據顯示SCFAs與多種疾病的發生發展密切相關。
在腸道菌群以膳食纖維為來源合成乙酸、丙酸和丁酸的代謝途徑中,乳酸是生成丙酸的底物之一,也可經糖酵解生成丙酮酸后,合成其他代謝產物。乳酸在有機體中參與生理功能的角色主要有3 個:能量來源、糖異生作用的前體、代謝信號分子。因此,對腸內容物及血清樣本中乳酸和SCFAs同時進行定性和定量測定,可極大地增進我們對飲食、腸道菌群和宿主代謝穩態之間復雜相互作用關系的理解。
目前,生物樣品中的SCFAs的定量方法包括氣相色譜(gas chromatography,GC)法、氣相色譜-質譜(GC-mass spectrometry,GC-MS)聯用法、液相色譜(liquid chromatography,LC)法、液相色譜-質譜(LC-MS)聯用等方法,其中GC及GC-MS是最常用的測定方法。然而,目前很少有研究同時關注腸道及血清中乳酸及SCFAs含量的變化。本研究使用GC、高效LC(high performance LC,HPLC)、柱前衍生化HPLC(pre-column derivatization HPLC,PCD-HPLC)檢測小鼠糞便中SCFAs及乳酸含量并其進行對比,對建立的PCD-HPLC進行方法學驗證;本研究旨在建立一種適用于生物腸內容物與血清樣品的,且能同時、精準測定其SCFAs及乳酸含量的方法,為更好地開展益生元與膳食纖維等新型營養素調節腸道菌群進而影響機體代謝生理的關聯研究奠定基礎。
1 材料與方法
1.1 材料與試劑
實驗小鼠為BALB/c雌性小鼠,SPF級,小鼠體質量18~22 g,購自廣東省醫學實驗動物中心。
糞便、盲腸及血清樣本來源于實驗小鼠。
乙酸、丙酸、丁酸、異丁酸、戊酸、乳酸標準品(均為色譜級)、EDC·HCl、NPH·HCl 西格瑪奧德里奇(上海)貿易有限公司;濃鹽酸、乙醚、乙酸乙酯、氫氧化鈉、氫氧化鉀,濃硫酸(均為分析純) 廣州化學試劑廠;吡啶(分析純) 阿拉丁試劑(上海)有限公司;甲醇(色譜純) 美國Labscience公司。
1.2 儀器與設備
U3000 HPLC儀(紫外檢測器) 賽默飛世爾科技(中國)有限公司;GC-2014C GC儀 日本島津公司;數顯恒溫水浴鍋 上海博訊實業有限公司醫療設備廠;TGL-16MS臺式高速冷凍離心機 上海盧湘儀離心機儀器有限公司;通風櫥 廣州市半宙實驗室設備有限公司;QIMO-DCY-24Y水浴氮吹儀 琪摩(上海)電子科技有限公司。
1.3 方法
1.3.1 GC分析糞便樣品
稱取約0.1 g糞便樣品,加入0.2 mL質量分數50%的硫酸溶液酸化,再加入2 mL乙醚萃取20 min,12 000 r/min離心10 min后取上層有機相進樣分析。
GC條件:DB-FFAP毛細柱(30 m×0.25mm,0.25 μm);進樣口、氫火焰離子化檢測器溫度為240 ℃;載氣為氮氣,載氣流速24 mL/min;柱流量2 mL/min;分流比10∶1;尾吹30 mL/min;氫氣流速40 mL/min;空氣流速400 mL/min;升溫程序:100 ℃保持1 min,以5 ℃/min升溫至150 ℃,隨后150 ℃保持5 min;進樣量2.0 μL。
1.3.2 HPLC分析糞便樣品
稱取約0.3 g糞便樣品,加入1 mL去離子水后振蕩混勻,12 000×離心10 min收集糞便上清液。加入100 μL 12.1 mol/L濃鹽酸酸化,混勻后加入5 mL乙醚萃取20 min,3 500 r/min離心10 min后取上層有機相轉移至另一管中。加入500 μL 1 mol/L NaOH溶液反萃取20 min,3 500 r/min離心10 min,收集下層水相。加入100 μL 12.1 mol/L濃鹽酸再酸化,所得樣品用0.22 μm濾膜過濾后進樣分析。
HPLC色譜條件:YMC-Pack Pro C色譜柱(250 mm×4.6 mm,0.5 μm);柱溫30 ℃;流動相:A為水,用質量分數為8.5%的磷酸溶液調節pH值至2.8;B為乙腈;A∶B=95∶5(/);采用等度洗脫;流速1.0 mL/min;檢測波長210 nm;進樣量20 μL。
1.3.3 PCD-HPLC分析糞便及血清樣品
1.3.3.1 糞便樣品前處理
稱取不小于50 mg糞便樣品,加入4~5 倍體積的水振蕩混勻,12 000×離心10 min后收集上清液。
1.3.3.2 柱前衍生化
取100 μL糞便上清液或100 μL血清樣品,按順序加入200 μL 200 mmol/L NPH·HCl溶液,200 μL 120 mmol/L EDC·HCl溶液,200 μL 6%吡啶溶液(/)。混合均勻后于60 ℃恒溫水浴鍋中衍生化反應20 min,加入100 μL 15% KOH溶液(g/mL)-甲醇溶液(80∶20,/),混合均勻后于60 ℃恒溫水浴鍋20 min終止衍生化反應。
衍生化反應結束后,加入2 mL質量分數為42.5%磷酸溶液酸化,再加入4 mL乙醚萃取兩次,每次10 min,收集上層有機相。合并兩次萃取的有機相,水洗一遍后氮吹干燥。最終固體殘留物用200 μL甲醇溶解,所得溶液用0.22 μm濾膜過濾后進樣分析。
1.3.3.3 色譜條件
Hypersil GOLD HPLC C色譜柱(250 mm×4.6 mm,0.5 μm);柱溫40 ℃;流動相:A為乙腈;B為超純水,用質量分數為8.5%磷酸溶液調節pH值為2.8~3.0;采用梯度洗脫程序洗脫5 種SCFAs組分及乳酸(表1)。在230 nm波長處進行紫外檢測,采用混合標準品溶液進行外標法定量。

表1 5 種SCFAs及乳酸衍生產物梯度洗脫條件Table 1 Gradient elution conditions for separation of five SCFAs and lactate derivatives
1.3.4 PCD-HPLC的方法學評價
1.3.4.1 線性關系分析
根據小鼠糞便及血清樣品中乳酸及各SCFAs組分的濃度范圍,配制含各組分的不同混合標準溶液母液。按照2 倍梯度稀釋的方法分別得到7 個梯度標準溶液。各質量濃度的梯度標準溶液經過1.3.3.2節柱前衍生化和1.3.3.3節HPLC分析后,用目標化合物峰面積()與相對應的質量濃度()繪制標準曲線。繼續稀釋低濃度的標準溶液,直到目標化合物的峰面積比不再呈線性降低(標準曲線的相關系數()小于0.99),此時的質量濃度為線性范圍的最小值。
1.3.4.2 準確度和精密度分析
通過計算在糞便上清液中目標化合物的加標回收率評價方法準確度。選用一個已測定SCFAs及乳酸含量的樣品,加入其質量分數80%、100%的標準品,加標后樣品按照1.3.3.2節處理和1.3.3.3節HPLC檢測含量,重復6 次,計算回收率。
采用100%加標樣品,考察日內、日間檢測的變異系數(coefficient of variation,CV)以評價方法的精密度。同一日內不同時間檢測5 次,計算日內CV,評價日內精密度;連續5 d對樣品進行檢測,計算日間CV,評價日間精密度。
1.3.5 小鼠實驗
將BALB/c雌性小鼠隨機分為5 組,每組10 只,體質量為(20±2) g。纖維素及各益生元均按30%添加量(/)預加入低纖飼料中。對照組小鼠攝食含纖維素的飼料,4 組實驗組小鼠分別含攝食菊粉、低聚果糖(fructooligosaccharide ,FOS)、低聚半乳糖(galactooligosaccharide,GOS)、低聚甘露糖(mannooligosaccharides,MOS)的飼料。小鼠自由采食、飲水,每周計算其攝食量。連續喂養6 周后,收集兩份每只小鼠的糞便樣品,處死小鼠后收集兩份盲腸內容物,這些樣品用于檢測腸道菌群、腸菌代謝產物SCFAs及乳酸;同時以斷尾取血方式采集血液,靜置后3 000 r/min離心10 min收集上清液,用于檢測血清中SCFAs及乳酸含量。
1.3.6 PCD-HPLC測定糞便、盲腸內容物、血清中SCFAs及乳酸含量
按照1.3.3節處理對應樣品并檢測待測樣品中SCFAs及乳酸含量。
1.4 數據處理
采用GraphPad Prism 6軟件進行數據分析,采用檢驗比較組間差異。
2 結果與分析
2.1 3 種檢測方法的比較

圖1 GC(A)、HPLC(B)、PCD-HPLC(C)得到的標準品與糞便樣品色譜圖比較Fig. 1 Chromatograms of standards and fecal sample in GC (A) ,HPLC (B) and PCD-HPLC (C)
如圖1所示,GC和PCD-HPLC能很好地分離樣品中乙酸、丙酸、丁酸、戊酸。HPLC雖能較好分離標準樣品中乙酸、丙酸、丁酸,但不能較好分離丁酸與異丁酸(圖中未顯示);且樣品雜峰多、目標峰值響應度低。在糞便樣品SCFAs含量的檢測中,空白樣品(水)經1.3.2節HPLC法檢測后在乙酸出峰處仍有吸收峰(圖中未顯示),所以HPLC法檢測乙酸含量誤差大、準確度低。此外,GC法雖能快速分析幾種SCFAs的含量,但不能同時測定乳酸含量。乳酸揮發性低,直接進樣GC分析無目標峰出現,須經柱前衍生化生成乳酸甲酯后進行檢測。由于羧基極性強,在GC柱中容易產生吸附作用會導致峰形拖尾,酸在柱上的保留會降低連續進樣分析過程中填充柱的精確度和準確度。相反地,PCD-HPLC法同時可很好分離檢測樣品中乳酸、戊酸、異丁酸的含量。因此,PCD-HPLC法更適用于檢測腸內容物及血清中乳酸及SCFAs含量,后續研究集中在PCD-HPLC的方法學評價及其應用。
2.2 PCD-HPLC的方法學評價
2.2.1 乳酸及SCFAs各組分的線性范圍
如表2、圖2所示,在SCFAs各組分及乳酸標準品濃度的線性范圍內,標準曲線的高,均在0.999 4以上。

表2 5 種SCFAs及乳酸的線性范圍和相關系數Table 2 Linear ranges of and correlation coefficients for five SCFAs and lactic acid

圖2 乳酸、乙酸、丙酸標準品線性擬合曲線Fig. 2 Linear fitting curves for lactic acid, acetic acid and propionic acid
2.2.2 準確度與精密度評價
由表3可知,采用PCD-HPLC測定糞便樣品中5 種SCFAs及乳酸含量,各組分的加標回收率均在80%~120%范圍內,方法準確度較高。在該方法下,SCFAs各組分及乳酸含量測定的日內CV不高于5.21%,日間CV不高于8.87%,表明該方法重復性及重復性良好。

表3 乳酸及SCFAs檢測穩定性及回收率Table 3 Stability and recoveries of PCD-HPLC for determination of lactatic and SCFAs%
2.3 PCD-HPLC測定飼養小鼠的糞便、盲腸內容物、血清中SCFAs各組分及乳酸含量分析
2.3.1 SCFAs各組分及乳酸在小鼠不同部位的含量變化
如圖3所示,在糞便及盲腸內容物SCFAs中,乙酸含量最高,約占總SCFAs的70%~85.5%;其次是丁酸和丙酸;這3 種SCFAs含量占總SCFAs比例超過90%,與眾多研究結果一致。糞便和盲腸內容物中乳酸的含量約為10 μmol/g。對比糞便和盲腸內容物(分別對應于遠端結腸和近端結腸)發現,盲腸內容物中的乙酸、丙酸、丁酸含量均比糞便中含量高,結果與Cummings和Hernández等的報道一致。此外,觀察到小鼠血清樣品中乳酸含量最高,SCFAs中乙酸含量最高,其余SCFAs組分含量較少。值得注意的是,血清中丁酸含量極低。
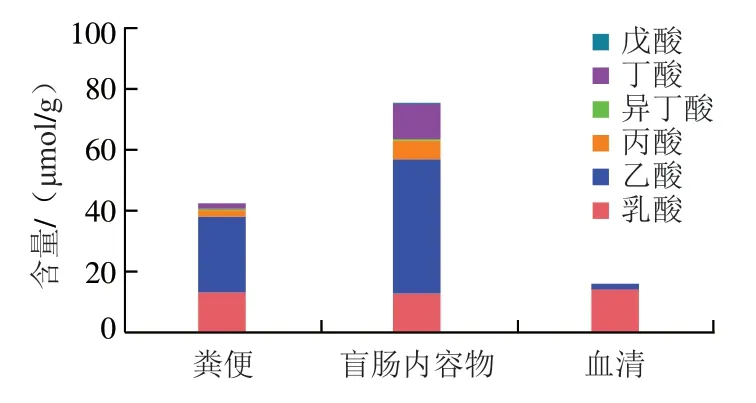
圖3 飼養小鼠的糞便、盲腸內容物、血清中5 種SCFAs及乳酸含量比較Fig. 3 Comparison of contents of five SCFAs and lactic acid in feces,cecum contents and serum of mice
2.3.2 小鼠腸道中乳酸與丙酸的含量變化

圖4 飼養小鼠糞便(A)、盲腸內容物(B)中乳酸與丙酸的含量變化Fig. 4 Changes in lactic acid and propionic acid contents in feces (A) and cecum contents (B) of mice
由圖4可知,在糞便、盲腸內容物中,乳酸含量與丙酸含量變化趨勢相反,乳酸含量相對較高的益生元組的丙酸含量相對較低。然而有趣的是,在血清中乳酸含量相對于SCFAs含量更高(圖3),未見乳酸與丙酸之間的含量變化相反趨勢。此外,圖4也顯示不同益生元對腸道代謝產物的影響存在差異,FOS、GOS對乳酸及丙酸含量的影響相似,兩組小鼠腸道中的乳酸、丙酸含量沒有顯著差異(>0.05)。與FOS和GOS組相比,MOS和菊粉明顯增加了小鼠腸道(糞便、盲腸內容物)中乳酸含量,降低了丙酸含量;其中MOS組的差異更大,小鼠攝入MOS后,腸道(糞便、盲腸內容物)中丙酸含量極顯著低于其他3 個實驗組(<0.01)。
3 討論與結論
腸道菌群利用膳食纖維合成SCFAs分為多種途徑(圖5)。然而當腸道中可發酵膳食纖維供應不足時,菌群轉向利用其他能源物質,如膳食來源氨基酸、內源蛋白質或膳食脂肪,進而代謝生成支鏈脂肪酸如異丁酸、2-甲基丁酸、異戊酸。乳酸在腸道中的合成代謝途徑研究較少,更多關注在血液中的代謝。圖5顯示,乳酸是腸道菌群利用膳食纖維或益生元合成SCFAs的重要中間代謝產物,可以作為底物經丙烯酸鹽途徑直接生成丙酸,這可能是本研究發現腸道中乳酸與丙酸含量變化趨勢相反的原因之一,機體隨著腸道環境的變化或功能需求產生不同含量的乳酸及丙酸。目前的結果未發現腸道中乳酸與其他SCFAs含量之間存在顯著關聯。此外,本研究未發現血清中乳酸含量與丙酸或其他SCFAs之間存在相互聯系;血清中乳酸含量最高,分析可能乳酸的代謝途徑在血液中與腸道中存在差異,在血液中乳酸的來源主要為葡萄糖和丙氨酸,通過乳酸脫氫酶催化氧化還原反應生成或消除乳酸。

圖5 腸道菌群以膳食纖維為來源合成乙酸、丙酸、丁酸的途徑Fig. 5 The synthesis pathway of acetic acid, propionic acid and butyric acid by intestinal bacteria from dietary fiber
嬰兒在出生0~6 個月期間,食物來源主要是母乳。母乳中第3大營養物質——母乳低聚糖,為嬰兒腸道菌群提供生長所需的營養。腸菌代謝產生的SCFAs及乳酸使腸道環境酸化,進一步產生對嬰兒生長發育有益的功能。在本課題組的另一項探究母乳低聚糖與嬰幼兒腸道菌群之間聯系的研究中發現,在0~6 個月齡的嬰幼兒腸道中,乳酸及乙酸的含量最高,腸菌組成多為雙歧桿菌及乳酸桿菌。結果顯示了腸道產生乳酸對機體健康的有益影響,可能是作為能源物質為機體細胞提供能量,也可能是與SCFAs類似,作為信號分子參與一系列代謝反應。
此外,小鼠攝入同樣劑量不同益生元或不同劑量同一益生元后,腸道中乳酸與SCFAs含量變化程度不同。例如:圖4B顯示,攝入MOS后,盲腸內容物中乳酸含量在所有益生元組中最高,對應丙酸含量最低;圖4顯示,攝入FOS與GOS的兩組小鼠腸道中的乳酸、丙酸含量沒有顯著差異(>0.05)。此結果表明不同結構、不同鏈長的益生元對腸道菌群組成及其代謝產物的影響存在差異。腸腔中丁酸濃度在盲腸中最大,由于被腸黏膜吸收,可發酵底物的減少,使越到遠端腸道丁酸濃度越低。丁酸作為結腸上皮細胞的能量來源,且結腸上皮細胞代謝丁酸速率快,因此在門靜脈及外周血中丁酸含量極低,門靜脈丁酸濃度比結腸腸腔中濃度低1 000 倍,外周循環血中丁酸濃度為幾μmol/mL。這些研究結果與本實驗結果相似。腸道炎癥性疾病更大概率發生在遠端結腸,原因可能是遠端結腸可發酵碳水化合物含量少,產生的SCFAs含量少,不能很好地保護腸道上皮。
綜上,在研究微生態營養干預對機體健康調節作用時,除了監測腸道菌群組成變化外,建立準確、有效的方法同時檢測腸道及外周血中乳酸及SCFAs含量很有必要。在同一個樣本中同時快速、準確地分析乳酸及SCFAs含量變化,可作為觀察腸道菌群組成與機體健康生理變化之間聯系的紐帶和有效指標,用于評估腸道炎癥性疾病發展的可能,此外也可指導飲食精準營養干預方案,例如,增加攝入不易被消化的可發酵碳水化物提高遠端結腸SCFAs含量,尤其是丁酸。
本研究使用GC、HPLC、PCD-HPLC這3 種方法檢測糞便中乳酸及SCFAs含量并對其進行對比。結果顯示:GC可快速分析具有揮發特性的SCFAs含量,但不能同時分析無揮發特性的乳酸;由于脂肪酸分子結構中缺乏具有紫外吸收的熒光的基團,HPLC檢測的準確度低;PCD-HPLC填補了前兩種檢測方法的不足,可同時精確測定糞便中乳酸及5 種SCFAs含量,且此方法同樣適用于盲腸內容物及血清樣本的檢測。目前已報道的SCFAs測定方法中,稱取糞便質量均不小于100 mg,然而在實際小鼠實驗中,收集不小于100 mg的糞便用于測定乳酸及SCFAs較困難(兩粒小鼠糞便質量約為60 mg)。本研究建立的PCD-HPLC所需樣本量小,其中腸內容物樣品不小于50 mg,血清樣品量不小于100 μL。因此,為更好地開展益生元與膳食纖維等新型營養素調節腸道菌群進而影響機體代謝生理的關聯研究,PCD-HPLC測定方法是一個很好的選擇,具有適用范圍廣、重復性良好、準確度高等特點。

