群體感應系統對單增李斯特菌生物被膜形成的影響
張心怡,陸兆新,鄭麗平,呂紫巖,周立邦,孟凡強,別小妹
(南京農業大學食品科學與技術學院,江蘇 南京 210095)
單增李斯特菌()是一種食源性致病菌,在許多食品供應鏈中普遍存在,能夠在低水分活度、高滲透環境和低溫等條件下生存。單增李斯特菌能夠引起腦膜炎、敗血癥等嚴重的李斯特菌病,給食品工業造成經濟損失,對人類健康造成嚴重威脅。細菌生長過程中形成的生物被膜是病原體的持久來源,它使細菌對消毒劑等耐受性變強,能夠耐受高滲環境和冷凍環境等,對食品安全造成嚴重威脅。在食品工業中,控制單增李斯特菌生物被膜的形成是防止其污染的重要環節。
生物被膜的形成過程包含多種復雜的調控機制,其中群體感應系統對細菌生物被膜形成的調控研究是當前微生物學研究的熱點。在革蘭氏陽性菌中廣泛存在著兩種群體感應系統,即依賴于的群體感應系統和LuxS/AI-2系統,這兩個系統在單增李斯特菌的生物被膜形成中發揮重要作用。其中,Agr系統由編碼蛋白質的4 種基因組成:膜蛋白AgrB負責將信號前體AgrD轉化為自誘導肽AIP并將其轉運至胞外,AgrCA是一個雙組分系統,其中AgrC為組氨酸蛋白激酶,它能夠識別AIP,然后信號被轉錄調節因子AgrA轉導到下游基因,包括生物被膜形成的基因和毒力因子。基因編碼的LuxS酶是一種甲基循環必需的酶,AI-2是LuxS酶在活化甲基環中合成的4,5-二羥基-2,3-戊二酮自發環化形成的一組互相轉化的信號分子。當AI-2積累到一定濃度后便與受體結合從而激活群體感應系統,調控生物被膜、抗生素耐藥性等相關基因的表達。
當環境中細菌濃度達到一定閾值時,群體感應系統能夠調控菌體中相關基因的表達,從而調控多種生物行為,包括細菌生物被膜的形成、耐藥性等,增強了細菌對不利環境的耐受性,使其在食品加工環境中變得難以清除,所以干擾群體感應系統是控制生物被膜形成的一個新方向。因此,本研究通過探索單增李斯特菌群體感應系統對其生物被膜形成的調控機制,旨在為控制單增李斯特菌的污染提供理論基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒
大腸桿菌JM109、穿梭載體pKSV7(Amp)質粒均由本實驗室保存;單增李斯特菌LMB33426、FSIS57034菌株由合作單位贈送,本實驗室保藏;ATCC19116菌株美國菌種保藏中心;CICC21662菌株 中國工業微生物菌種保藏管理中心;JM110 Chemically Competent Cell上海唯地生物技術有限公司;pMD18-T 寶日醫生物技術(北京)有限公司。
1.1.2 培養基與試劑
Luria-Bertani(LB)培養基:10 g/L蛋白胨、5 g/L酵母粉、10 g/L NaCl;腦心浸出液(brain heart infusion,BHI)培養基、肉湯培養基(Mueller-Hinton broth,MHB)北京索萊寶科技有限公司。
Zol UpRNA Kit 提取試劑盒 北京全式金生物技術有限公司;HiScriptII Q RT SuperMix for qPCR(+gDNA wiper)逆轉錄試劑盒、AceQ qPCR SYBR Green Master Mix(High ROX Premixed)熒光聚合酶鏈式反應(polymerase chain reaction,PCR)試劑盒南京諾唯贊生物科技有限公司;細菌基因組DNA提取試劑盒 南京丁貝生物科技有限公司;限制性核酸內切酶I、I 美國賽默飛公司。
1.1.3 引物
本研究引物見表1。

表1 本研究所用的引物Table 1 Primers used in this study
1.2 儀器與設備
T1300II級生物安全柜 美國賽默飛公司;Step One Plus熒光定量PCR儀 美國ABI公司;MicroPulser電穿孔儀 美國Bio-Rad公司;JS-380c全自動數碼凝膠成像分析儀 上海培清科技有限公司。
1.3 方法
1.3.1 real-time PCR測定群體感應系統基因在生物被膜形成各時期的表達量
37 ℃在LB培養基中分別靜置和180 r/min振蕩培養生物被膜態和游離態的4 株單增李斯特菌細胞,在培養時間為12、24、36、48 h時分別收集細胞,提取總RNA后使用反轉錄試劑盒合成cDNA。以16S rRNA為內參基因,選擇群體感應基因///及基因進行realtime PCR驗證,每個基因做3 個平行,采用2的方法計算基因的相對表達量,比較目的基因在單增李斯特菌生物被膜態和浮游態中的表達差異。
1.3.2 Δ突變株和Δ突變株的構建
用細菌總DNA提取試劑盒提取LMB33426菌株的基因組,然后分別使用基因和基因的引物對F/R和F/R擴增上、下游同源臂片段。PCR產物經1%瓊脂糖凝膠電泳檢測正確后進行凝膠回收。以F/R為引物,通過重疊延伸PCR構建上下游同源臂的融合片段。將融合片段與pMD19-T載體連接并轉化至大腸桿菌JM109中。將PCR驗證后的陽性轉化子與pKSV7質粒同步雙酶切,純化后相連接并轉化至JM109中。對驗證為陽性的轉化子進行抽提質粒,轉化至JM110中以去甲基化。將通過PCR驗證以及測序正確的重組穿梭質粒命名為pKSV7-Δ、pKSV7-Δ,用電轉化的方法將重組穿梭質粒導入LMB33426感受態細胞中。通過41 ℃氯霉素的雙重壓力誘導其發生同源重組,然后在30 ℃無抗條件下連續傳代以丟失質粒。通過影印平板法篩選得到對抗生素敏感的菌株,進行PCR以及測序驗證得到Δ突變株和Δ突變株。
1.3.3 野生株和突變株生物被膜形成能力的測定
通過96 孔板結晶紫染色法對生物被膜進行定量分析,具體如下:將LMB33426野生株和突變株接種于BHI培養基中,37 ℃、180 r/min振蕩培養至對數生長期并調節菌液的OD為0.5(10CFU/mL)。按1%接種量接種至BHI培養基后,每孔200 μL加入到96 孔板中。培養12、24、36、48、60、72 h后,棄去培養基并加入200 μL的磷酸鹽緩沖液洗滌3 次。干燥后每孔加入200 μL的0.1%結晶紫染液染色30 min,然后用磷酸鹽緩沖液(phosphate buffered saline,PBS)洗去浮色。風干后每孔加入200 μL 95%乙醇溶液溶解結晶紫,室溫放置15 min后,用酶標儀在595 nm波長處測定樣品OD值。生物被膜生成量由樣品和空白對照OD值之間的差值表示。
1.3.4 激光共聚焦顯微鏡觀察野生株和突變株的生物被膜
調節培養至對數生長期的LMB33426野生株和突變株的菌液OD為0.5(10CFU/mL)。在NEST玻底培養皿中加入2 mL新鮮的BHI培養液,再加細菌懸液100 μL。37 ℃培養36 h后,使用PBS沖洗2 次,室溫下在黑暗中用SYTO 9(染色活細胞)20 μmol/L和碘化丙啶(propidium iodide,PI,染色死細胞)30 μmol/L溶液的混合物200 μL對生物被膜染色30 min。然后使用具有488 nm和560 nm激發波長的激光共聚焦顯微鏡掃描染色的生物被膜。
1.3.5 野生株和突變株運動能力的測定
運動能力由試管穿刺實驗以及細菌泳動性、爬動性結果評估,泳動性和爬動性的測定參照已有研究方法。
1.3.5.1 試管穿刺實驗
用接種針蘸取培養至對數期的LMB33426野生株和突變株的菌液,穿刺接種于含0.3%瓊脂的半固體試管中,分別在37 ℃和30 ℃下培養36 h觀察穿刺線周圍細菌擴散情況。
1.3.5.2 野生株和突變株的泳動性和爬動性
用接種針蘸取培養至對數期的LMB33426野生株和突變株的菌液,刺入瓊脂含量0.3%的泳動平板和0.5%的爬動平板,分別在37 ℃和30 ℃恒溫培養箱中正置培養36 h觀察運動情況;用游標卡尺測量每株菌的擴散圈直徑。
1.3.6 野生株和突變株疏水性的測定
用BATH法測定單增李斯特菌細胞表面疏水性:將LMB33426野生株和突變株分別接種于20 mL LB液體培養基中,37 ℃恒溫靜置培養36 h。將菌液以10 000×離心5 min并棄去上清液。用0.1 mol/L PBS重懸后再10 000×離心5 min,反復洗滌2 次。然后將沉淀重懸于0.1 mol/L PBS,調節其OD值為0.9±0.05,記為OD;每取4 mL樣品,向其中加入1 mL二甲苯,劇烈振蕩120 s后37 ℃靜置30 min。待體系分層后,測得下層水相在540 nm波長處的OD值并記為OD;由此,細胞疏水性可由下式計算:

1.3.7 野生株和突變株耐藥性的測定
1.3.7.1 野生株和突變株浮游態下耐藥性的測定

表2 本研究中使用的抗生素Table 2 Antibiotics used in this study
本實驗測定單增李斯特菌對10 種抗生素(表2)的敏感性,采用二倍稀釋法制備藥敏培養孔板,將培養至對數期的LMB33426野生株和突變株的菌液用MHB培養基稀釋100 倍,每孔50 μL接種于藥敏平板中,37 ℃靜置培養24 h。測定每孔的OD值,以OD<0.1且抗生素濃度最低孔中對應的抗生素濃度作為此抗生素的最小抑菌濃度(minimal inhibitory concentration,MIC)。選取抗生素濃度大于MIC且澄清透明的孔,吸取50 μL涂布在LB瓊脂平板上,37 ℃靜置培養24 h后進行菌落計數,以單菌落數小于3 個對應的最低抗生素濃度,作為此抗生素的最小殺菌濃度(minimal bactericidal concentration,MBC)。
1.3.7.2 野生株和突變株被膜態下耐藥性的測定
將培養至對數期的LMB33426野生株和突變株菌液用MHB培養基稀釋1 000 倍,每孔200 μL接種于96 孔板中,37 ℃恒溫靜置培養36 h。培養完成后棄去培養基并用無菌水清洗3 次,在超凈工作臺中晾干代用。同時制備藥敏平板,將培養基和抗菌藥物的混合液對應加入已經清洗和晾干的96 孔細胞培養板中,37 ℃恒溫靜置培養24 h,并按上述方法判定MIC和MBC。
1.4 數據處理
采用Microsoft Excel軟件進行數據處理,采用GraphPad Prism 8軟件作圖,采用IBM SPSS Statistics 19軟件進行方差分析。
2 結果與分析
2.1 單增李斯特菌群體感應系統基因在生物被膜形成各時期的表達量
4 株菌在不同生長時期群體感應各基因的表達量見圖1。在前期研究的基礎上,獲得了4 株生物被膜形成能力不同的單增李斯特菌,其強弱順序分別是LMB33426、FSIS57034、ATCC19116、CICC21662。通過分析發現,在強生物被膜形成能力菌株LMB33426中,被膜態的、基因表達量顯著高于浮游態。培養24 h,在被膜態細胞中的表達量比浮游態提高了36 倍,在第36小時,基因在被膜態細胞中的表達量比浮游態提高31 倍,這表明它們可能在生物被膜形成的過程中起到了正向調控的作用。另外,基因和基因在不同生長階段的表達量相對浮游態無明顯提高,而基因在生長過程中的相對表達量均低于浮游態(圖1A)。在FSIS57034菌株中,培養時間為24 h,基因的相對表達水平比浮游態高21 倍;培養時間為36 h和48 h,基因的相對表達水平分別比浮游態高2.6 倍和5.8 倍;總體來看,//的相對表達水平低于浮游菌(圖1B)。在2 株生物被膜形成能力弱的菌株中,ATCC19116菌株的基因在36 h相對表達水平最低,是浮游態的2%(圖1C)。在CICC21662菌株中,從總體來看基因的相對表達量最低,其次是基因和基因(圖1D)。綜上,可以看出,在強生物被膜形成能力的菌株當中,和基因相對表達量較高。在生物被膜形成的過程中,和基因可能發揮著主要的正向調控作用,通過構建基因缺失株來進一步研究群體感應系統在單增李斯特菌生物被膜形成過程中的調控作用。

圖1 不同培養時間下4 株單增李斯特菌的群體感應基因表達情況Fig. 1 Expression of quorum sensing genes in four L. monocytogenes strains at different culture times
2.2 單增李斯特菌ΔagrD突變株和ΔluxS突變株的構建
通過PCR鑒定突變株的構建是否成功,使用引物-F/R擴增野生株時,目的條帶為1 531 bp(圖2泳道1),擴增Δ缺失株基因組獲得片段為1 122 bp(圖2泳道2);使用-F/R引物擴增野生株的基因組時,目的片段為1 348 bp(圖2泳道3),擴增Δ缺失株基因組獲得片段為1 186 bp(圖2泳道4)。對所獲得的PCR產物進行測序,結果表明單增李斯特菌-Δ和-Δ構建成功。
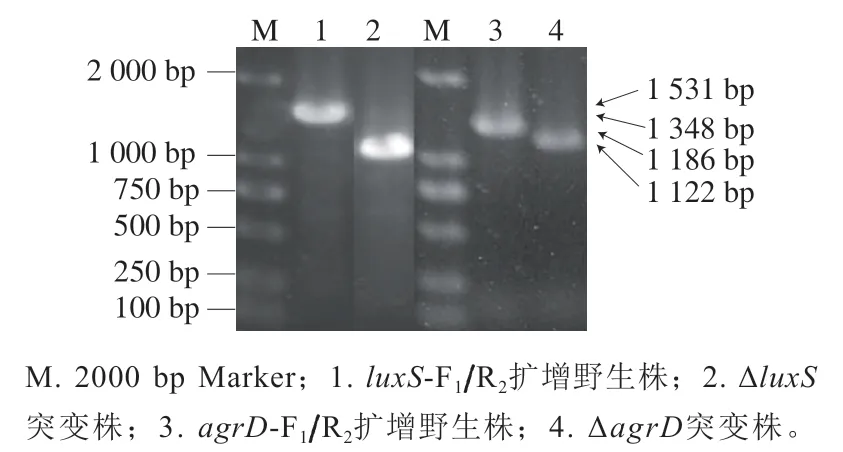
圖2 單增李斯特菌突變株ΔluxS和ΔagrD的PCR鑒定Fig. 2 PCR identification of L. monocytogenes mutant strains ΔluxS and ΔagrD
2.3 單增李斯特菌野生株和突變株生物被膜形成能力
圖3表明,與野生株LMB33426相比,Δ基因突變株的生物被膜形成能力減弱,Δ基因突變株的生物被膜形成能力顯著下降。這3 株菌的生物被膜形成能力在前36 h的培養過程中均表現為上升的趨勢,在培養至36 h生物被膜形成能力最強,36 h后生物被膜形成能力開始下降。培養時間為24 h,Δ和Δ突變菌株的生物被膜形成能力下降顯著,與野生株存在極顯著差異(<0.01);培養時間為48 h和60 h,Δ基因突變株的生物被膜形成能力均顯著低于野生株。在培養時間為24~60 h區間內,Δ基因突變株的生物被膜形成能力也顯著低于野生株。在培養時間達到72 h,不同菌株生物被膜形成能力之間的差異消失,且生物被膜生成量較低,這可能是此時已到達生物被膜的脫落階段。

圖3 野生株和基因突變株生物被膜形成能力Fig. 3 Biofilm formation ability of wild-type and mutant strains
2.4 激光共聚焦顯微鏡觀察野生株和突變株的生物被膜
通過SYTO 9和PI熒光染料染色,可使生物被膜中的活菌呈綠色熒光,而受損或死亡細胞呈紅色熒光。對生物被膜進行熒光染色后發現LMB33426野生株形成的生物被膜厚度較厚,結構緊密,部分連成片(圖4)。與野生株相比,Δ菌株綠色熒光的數量及密集程度比野生株低,形成的生物被膜厚度均勻且較野生型薄;Δ菌株綠色熒光的數量及密集程度明顯降低,形成的生物被膜分散,且顯著少于野生株。

圖4 激光共聚焦顯微鏡觀察野生株和基因突變株的生物被膜Fig. 4 CLSM Observation of biofilms formed by wild-type and mutant strains
2.5 單增李斯特菌野生株和突變株運動能力
試管穿刺實驗中(圖5A),在37 ℃下Δ和Δ突變株的穿刺線周圍都有明顯的白色擴散圈,且Δ突變株的擴散范圍明顯寬于野生株,說明基因的缺失導致LMB33426菌株在37 ℃下的運動性增強;在30 ℃下,野生株和突變株的穿刺線周圍有白色擴散圈,且3 株菌的擴散范圍接近,說明該溫度下群體感應系統對LMB33426的運動性未產生顯著影響。
泳動及爬動實驗中,在37 ℃下,Δ和Δ基因突變株在0.3%的半固體培養基上都能夠形成泳動圈,且擴散范圍寬于野生株LMB33426(圖5B)。Δ基因突變株在37 ℃下形成的泳動圈直徑顯著寬于野生株,表現出比野生株更強的泳動能力(圖5C),這表明在37 ℃時、基因的缺失使得LMB33426菌株的運動性增強。在30 ℃時,Δ和Δ突變株穿刺線周圍的擴散范圍與野生株無顯著差異,這表明在30 ℃時野生株及基因缺失株的運動性無明顯差異(圖5B、C)。另外,野生株和基因缺失株在37 ℃和30 ℃下都不能形成爬動圈(圖5B、B)。

圖5 野生株和基因突變株運動能力Fig. 5 Swimming motility of wild-type and mutant strains
2.6 單增李斯特菌野生株和突變株疏水性的測定
2 個基因突變菌株的疏水性均低于野生株,其中Δ基因突變株的疏水性與野生株無顯著差異,而Δ基因突變株的疏水性極顯著低于野生株(<0.01)(圖6),這與3 株菌生物被膜形成能力的趨勢一致。以上結果表明,群體感應系統可能通過改變菌株的疏水性調節其生物被膜的形成能力。
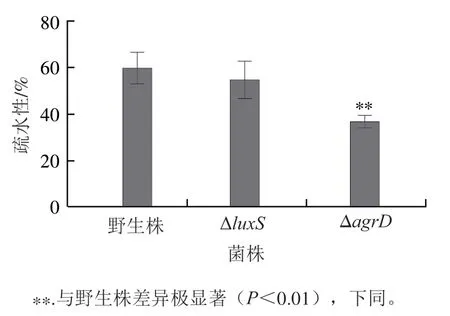
圖6 野生株和基因突變株疏水性的測定Fig. 6 Hydrophobicity of wild-type and mutant strains
2.7 單增李斯特菌野生株和突變株耐藥性的測定
野生株和突變株對各抗生素的MIC及MBC值見圖7。單增李斯特菌對喹諾酮類和氨基糖苷類、四環素類抗生素比較敏感,如CIP和GEN、OT比較敏感,對-內酰胺類抗生素、磺胺類抗生素比較耐受,如CRO、CFP、SF。、基因的缺失使得菌株在浮游態和生物被膜態下對SF的MIC值顯著降低。另外,基因的缺失使得菌株對頭孢曲松鈉的MIC及MBC值降低。但是整體來看,和基因的缺失并沒有對菌體的耐藥性產生顯著的影響。


圖7 野生株和基因突變株MIC值及MBC值Fig. 7 MIC and MBC values of antibiotics against wild-type and mutant strains
3 討 論
單增李斯特菌可引起人畜共患病,給人類社會帶來嚴重的威脅。細菌的群體感應系統可以通過控制下游基因表達調控生物被膜的形成,病原菌由此可以依靠生物被膜防御各種環境壓力。本研究通過real-time PCR發現,在強生物被膜形成能力菌株LMB33426的被膜態細胞中,和基因的表達量處于較高水平。故選其為研究對象,通過同源重組的方法構建群體感應系統基因突變株,分析和基因在單增李斯特菌生物被膜形成過程中的調控作用。
本實驗通過結晶紫染色法和激光共聚焦顯微鏡對LMB33426野生株和Δ突變株、Δ突變株的生物被膜形成能力進行測定和觀察。結果顯示,基因的缺失會使LMB33426菌株在培養12~60 h內生物被膜形成能力顯著降低。通過激光共聚焦顯微鏡觀察發現,Δ突變株形成的生物被膜比野生株疏松且厚度降低。有研究表明,基因缺失會導致細胞在玻璃表面的黏附能力受損,且生物被膜形成能力降低,這表明Agr系統可能參與單增李斯特菌的初期黏附過程調控生物被膜的形成。另外,通過構建缺失株發現,在培養24、48、60 h突變株生物被膜形成能力均減弱。而有研究表明,單增李斯特菌基因缺失后生物被膜形成量顯著增加,通過添加外源AI-2對其生物被膜的形成不產生影響。在Δ突變株培養液的上清液中能夠累積大量AI-2的前體物質S-核糖同型半胱氨酸,這使得單增李斯特菌黏附能力增強,從而調節其生物被膜的形成。本研究缺失基因并沒有導致生物被膜形成量增加,這可能是由于不同菌株的特征導致生物被膜形成能力表現出菌株差異性。此外,單增李斯特菌生物被膜的形成還受到基質組分以及第二信使信號分子等多種調控的影響,單增李斯特菌生物被膜形成過程中的分子調控機制還需要深入研究。
除影響生物被膜的形成,群體感應系統還參與細菌運動能力的調節。目前關于運動性與生物被膜形成能力之間的關系沒有統一定論。此前有研究表明,鞭毛運動在單增李斯特菌的黏附和生物被膜形成中發揮作用,單增李斯特菌運動性的喪失將導致生物被膜形成能力減弱。而在本研究中,Δ突變株在瓊脂含量為0.3%的半固體培養基上表現出比野生株更強的泳動能力。也有研究表明,單增李斯特菌的運動性與生物被膜的形成能力并不呈正相關。相反,單增李斯特菌在不銹鋼上形成生物被膜的能力與其泳動能力之間呈負相關。另外,將LMB33426菌株的基因敲除后發現并未影響菌株的運動能力,這與Belval等的結果相同。
細菌對接觸表面的附著不僅受到鞭毛和運動性的影響,還受到微生物疏水性等的影響。單增李斯特菌在聚苯乙烯表面的生物被膜形成能力與細胞表面疏水性呈正相關關系。本研究基因突變株的疏水性顯著弱于野生株,基因突變株的疏水性與野生株無顯著差異,這與它們的生物被膜形成能力趨勢相同。這可能是由于細胞在接觸面的附著能力隨表面疏水性的增加而增加,生物被膜的形成量從而增加。因此,本研究結果提示缺失基因和基因可能會導致單增李斯特菌黏附能力下降,進而導致生物被膜形成能力發生變化。群體感應系統還對菌體的耐藥性產生影響,但本研究和的缺失沒有對耐藥性產生顯著的影響,其具體機制仍有待進一步的研究。
通過前期研究獲得了生物被膜形成能力不同的4 株單增李斯特菌,real-time PCR表明及基因可能是單增李斯特菌生物被膜形成的關鍵調控基因。通過同源重組成功構建了群體感應系統基因缺失株Δ及Δ。結晶紫染色實驗及激光共聚焦顯微鏡觀察結果表明,群體感應系統基因的缺失會使LMB33426菌株的生物被膜形成能力減弱。另外,LMB33426菌株的生物被膜形成能力與菌株的疏水性有密切關系。近年來,通過抑制群體感應開發新型抗菌療法已經引起研究者的廣泛關注。群體感應抑制劑能夠在不抑制細菌生長的條件下,影響細菌的群體感應系統進而抑制其生物被膜的形成,實現對食源性致病菌的控制。因此可以通過作用于群體感應系統,進而控制生物被膜的形成以減少單增李斯特菌在食品工業中的污染,本研究為在食品工業中更有效防止單增李斯特菌污染、控制生物被膜形成提供新的理論支持。

