納米魚骨在肌球蛋白膠凝過程中鈣賦存形態的變化及分布
高 霞,張夢玲,熊善柏,胡 楊,尹 濤,劉 茹
(華中農業大學食品科學技術學院,國家大宗淡水魚加工技術研發分中心(武漢),長江經濟帶大宗水生生物產業綠色發展教育部工程研究中心,湖北 武漢 430070)
肌球蛋白是魚糜膠凝過程中最重要的功能性蛋白,對形成具有良好質地的魚糜制品至關重要。魚糜熱誘導膠凝過程中,在較低溫度(5~40 ℃)下的凝膠化行為與內源性轉谷氨酰胺酶(fish endogenous transglutaminase,FTGase)密切相關,FTGase通過催化蛋白質分子間或分子內的谷氨酸與賴氨酸殘基之間發生交聯反應,生成ε-(γ-Glu)-Lys異肽鍵,促進蛋白質分子聚集形成三維網絡結構。研究表明,FTGase具有Ca依賴性,生產過程中常需要添加鈣鹽以提高其催化活性進而改善魚糜的凝膠性能。近年來,有學者比較研究了氯化鈣、碳酸鈣、乳酸鈣等化合鈣對魚糜凝膠性能的影響,發現溶解性越好的化合鈣對魚糜凝膠性能的提升作用越大。但是,化合鈣添加量過多會產生苦味,對魚糜制品的風味產生不良影響。
魚骨是魚糜加工過程中產生的主要固體副產物,約占整條魚的10%~15%。魚骨中富含鈣、磷等元素,且鈣磷比利于人體吸收,具有較高的生物利用度,是天然的優質鈣源。目前,工業生產中大都將魚骨加工成飼料或直接當作下腳料丟棄,利用率極低,易造成資源浪費甚至引發環境污染問題,將其開發為新型鈣源,對副產物的高效利用具有重要意義。魚骨中的鈣大都以羥基磷灰石的形式存在,溶解度較低。前期實驗室研究發現,魚骨中鈣的生物利用度隨著魚骨尺寸的減小而升高,納米魚骨(nano fish bone,NFB)中鈣的溶解性較微米魚骨顯著提高。相較于CaCl,NFB中僅有少部分鈣以游離態存在,其對FTGase的激活作用弱于CaCl,但是NFB對魚糜凝膠的提升作用強于CaCl,這可能與NFB中鈣的不同賦存形態有關。然而,關于NFB在肌球蛋白膠凝過程中鈣的賦存形態如何轉化鮮有報道。
本實驗以鰱魚骨為原料制備NFB,將其加入肌球蛋白中,研究肌球蛋白膠凝過程中鈣賦存形態和表面元素的變化,進一步采用激光共聚焦顯微鏡(confocal laser scanning microscopy,CLSM)觀察肌球蛋白凝膠的微觀形貌,結合低場核磁分析肌球蛋白樣品水分分布狀況,探討NFB在肌球蛋白膠凝過程中鈣的賦存形態變化與分布,為探討NFB提升魚糜凝膠性能的作用機理提供數據支撐。
1 材料與方法
1.1 材料與試劑
鰱(Hyophthalmichthys molitrix),每尾質量約1.5 kg,購自華中農業大學菜市場。將鮮活鰱魚置于盛滿水的塑料袋中迅速運往實驗室,去頭、去內臟后分別取背脊部肉和魚骨用于提取肌球蛋白和制備NFB,其他樣品置于4 ℃冰箱存放。
茜素紅染液(分析純) 武漢谷歌生物技術有限公司;考馬斯亮藍R-250(分析純) 美國Amresco公司;氯化鑭及其余試劑均為分析純,購自國藥集團化學試劑有限公司。
1.2 儀器與設備
AA-6300c原子吸收分光光度計 日本Shimadzu公司;Nikon Eclipase CI光學顯微鏡 日本尼康公司;X-Max 50能量光譜儀 英國Oxford公司;Minispec核磁共振分析儀 德國Bruker公司。
1.3 方法
1.3.1 肌球蛋白的提取
參考高霞等的方法提取肌球蛋白,純化的肌球蛋白用含有NaCl的Tris-HCl(pH 7.5)緩沖液溶解,使其鹽離子濃度為0.5 mol/L。采用Lowry法測定肌球蛋白質量濃度。
1.3.2 NFB的制備
參考Yin Tao等的方法,并稍作修改。將魚脊骨切成長約3~5 mm的小段,加水漂洗除去血污和部分脂肪。然后,加入3 倍體積水將魚骨浸沒,在120 ℃(反壓蒸煮)下蒸煮1 h,去掉水煮液以脫除油脂,加清水漂洗數次瀝干。瀝干的魚骨用篩板孔徑為3 mm的絞肉機進行粗破碎,之后加入1 倍體積冰水,用骨泥機細磨進行微粒化處理,條件為:磨盤轉速3 000 r/min,磨盤間隙0.3 mm,研磨次數2 次。進一步將得到的魚骨加去離子水制備成5%的骨液,并用濕法高能球磨機進行球磨。球磨條件為磨盤轉速3 000 r/min,磨球填充率85%,磨球直徑0.5 mm,球磨時間6 h,得到的樣品即為NFB(粒徑~280 nm)。樣品中的總鈣含量參考GB 5009.92—2016《食品中鈣的測定》方法測定。
1.3.3 不同加熱方式肌球蛋白樣品的制備
研究NFB對肌球蛋白膠凝過程中原子吸收光譜的影響時,用0.5 mol/L NaCl-20 mmol/L Tris-HCl緩沖液(pH 7.5)將肌球蛋白質量濃度調整為1.0 mg/mL,將NFB加入肌球蛋白中至總鈣濃度為40 mmol/L,同時控制整體的鹽離子濃度為0.5 mol/L。制備好的肌球蛋白樣品立即進行加熱處理,加熱條件分別為:不加熱、一段式加熱(在40 ℃加熱60 min,記為S)、二段式加熱(先在40 ℃加熱60 min,再迅速轉移至90 ℃加熱30 min,記為S+K)。結束后,將肌球蛋白樣品用流動水冷卻至室溫,轉移至4 ℃冰箱保存待用,30 min內立即進行相關指標的測量。
1.3.4 鈣賦存形態測定
參考邢尚軍等的方法測定。取肌球蛋白凝膠樣品5 g,加入8 倍體積去離子水,均質,37 ℃恒溫水浴振蕩60 min,8 000 r/min離心10 min,保留沉淀,傾出上清液,將其定容至100 mL,用原子吸收法測定提取液中的鈣含量(A)。取30 mL 0.5 mol/L NaCl溶液加入上一步驟保留的沉淀中,均質,37 ℃恒溫水浴振蕩60 min,8 000 r/min離心10 min,保留上清液并將其定容至100 mL,用原子吸收法測定提取液中的鈣含量(B)。樣品中總鈣含量(C)的測定參考GB 5009.92—2016《食品中鈣的測定》。離子鈣的含量=A-B;螯合鈣的含量=B;不溶性鈣的含量=C-A。
1.3.5 表面元素測定
參考Grehn等的方法,使用能量光譜儀測定肌球蛋白凝膠的表面元素。樣品的處理步驟同掃描電鏡樣品。將干燥后的肌球蛋白凝膠粘于樣品臺,設置加速電壓為15 kV進行面掃描,獲得樣品表面元素組成及鈣離子分布圖像。
1.3.6 光學顯微鏡分析
將肌球蛋白凝膠進行冷凍切片處理,使用考馬斯亮藍R-250染色5 min,結束后用蒸餾水沖洗除去多余的染液,晾干。再用茜素紅染液進行復染5 min,結束后用蒸餾水沖洗,并于烘箱中烘干。將切片置于二甲苯溶液中浸泡5 min,取出晾干,并用中性樹脂封片。采用Nikon Eclipse CI光學顯微鏡觀察肌球蛋白凝膠微觀結構,放大倍數為200 倍。
1.3.7 激光共聚焦顯微鏡分析
參考高霞等的方法,采用激光共聚焦顯微鏡觀察NFB添加前后肌球蛋白凝膠的微觀結構,并稍作修改。將肌球蛋白凝膠進行冷凍切片處理,使用羅丹明B染料(濃度為10mol/L)對蛋白質進行標記,待測。
1.3.8 水分分布測定
參考Zhang Huimin等的方法測定肌球蛋白凝膠的低場核磁自旋-自旋弛豫時間。取5 g樣品用核磁膜包裹后放入10 mm核磁管中,隨后放入分析儀中。自旋-自旋弛豫時間T用Carr-Purcell-Mebiboom-Gill(CPMG)序列進行測量,參數設置為:掃描次數8 次,掃描迭代6 500 ms,回聲1 200,τ值(90°脈沖和180°脈沖之間的時間)為10 ms。用儀器自帶軟件分析T弛豫時間。
1.4 數據處理
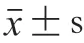
2 結果與分析
2.1 NFB-Ca在肌球蛋白膠凝過程中賦存形態的變化
NFB中,鈣主要存在于羥基磷灰石與膠原交錯互穿的結構中,大部分以不溶性鈣形態存在。如表1所示,將NFB加入肌球蛋白后,樣品中離子鈣的含量在未加熱條件下僅占1.65%,40 ℃加熱處理顯著提高離子鈣含量(P<0.05),隨后于90 ℃加熱又使部分離子鈣轉變成為另外2 種形態的鈣。螯合鈣含量變化與離子鈣呈現相反的趨勢。此外,前期實驗室研究發現,NFB中可溶性鈣的含量約為8.88%~14.02%,本實驗中添加NFB的肌球蛋白凝膠中可溶性鈣(離子鈣+螯合鈣)質量分數低于8.88%,不溶性鈣質量分數較高,推測NFB中部分可溶性鈣以鹽橋方式參與凝膠形成轉變為不溶性鈣。Jiang Yang等已證實加熱會顯著提高NFB中可溶性鈣的含量。然而,本研究表明與未加熱條件相比,一段式加熱和二段式加熱處理顯著提高了添加NFB的肌球蛋白凝膠中不溶性鈣的含量(P<0.05)。該結果說明,肌球蛋白膠凝過程中,NFB釋放出的可溶性鈣部分轉變成不可溶性鈣。前期研究發現,熱膠凝過程中,肌球蛋白分子二級結構變得伸展,并暴露出帶電基團(COO),Ca與帶電基團(COO)之間形成鹽橋,推測該鈣橋的形成使Ca被包埋在肌球蛋白凝膠網絡中,致使不溶性鈣含量增多。

表1 NFB-Ca在肌球蛋白膠凝過程中賦存形態的變化Table 1 Changes in occurrence form of NFB-Ca during myosin gelation
2.2 NFB對肌球蛋白表面元素的影響
如表2所示,未加熱條件下,NFB中礦物元素含量最多的是Ca(8.29±0.10)keV和P(5.25±0.25)keV,Na和Mg的含量相對較低。魚骨的無機相主要由磷酸氫鈣(CaHPO)和羥基磷灰石(Ca(PO)(OH))構成,這解釋了NFB中Ca、P含量較高的原因。一段式加熱和二段式加熱處理顯著提高了NFB表面Ca、P含量(P<0.05),推測這是由于加熱處理破壞了NFB的晶體結構,促進了Ca、P向表面遷移。加熱過程中,NFB中的Ca/P無顯著變化(P>0.05)。
加熱前,相較于肌球蛋白組,添加NFB的肌球蛋白樣品組中Ca含量顯著升高(P<0.05)。40 ℃加熱后,添加NFB的肌球蛋白表面鈣元素較未加熱條件下增長了約51%,隨后于90 ℃加熱其表面鈣元素進一步增多,與未加熱相比提高了約85%。然而,加熱過程中未添加NFB的肌球蛋白樣品表面鈣元素無顯著變化(P>0.05)。該結果說明肌球蛋白膠凝過程中表面鈣元素的增加主要來源于NFB的添加,且進一步反映加熱可促進NFB中Ca的釋放。
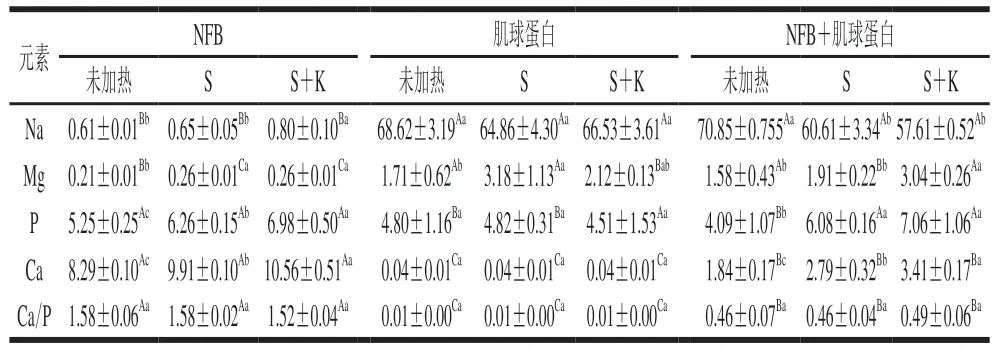
表2 NFB的添加對肌球蛋白表面元素的影響Table 2 Effect of NFB on surface elements of myosin keV
能譜結合電鏡分析是一種監測樣品中元素分布的有效手段。如圖1所示,綠色圓點表示分布在肌球蛋白表面的鈣元素。所有樣品中均存在鈣元素。未加熱時,鈣元素較少且分布不均勻,一段式加熱和二段式加熱處理后,肌球蛋白表面鈣元素逐漸增多,分布的均勻性也有所提升,在加熱過程中,NFB晶體結構被破壞,釋放出部分鈣,膠凝時肌球蛋白與鈣形成鹽橋,形成了較為均一的凝膠結構,使表面鈣元素分布得更加均勻。
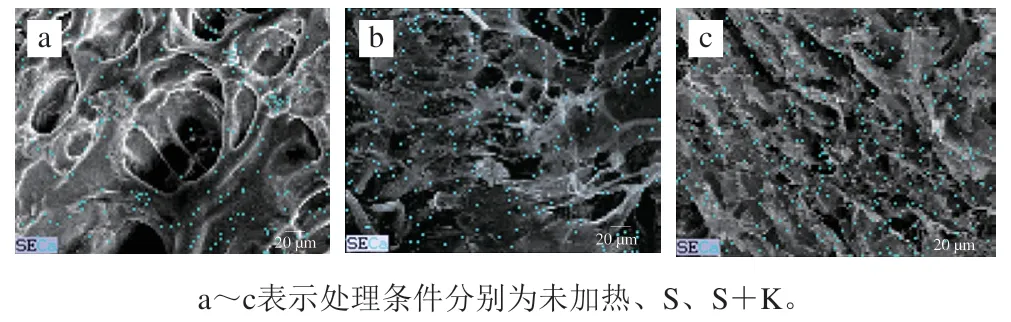
圖1 添加NFB的肌球蛋白在膠凝過程中表面鈣元素的分布狀況Fig. 1 Calcium distribution on the surface of myosin with the addition of NFB during gelation
2.3 光學顯微鏡分析
茜素紅可將鈣鹽染成玫紅色,而考馬斯亮藍可將蛋白質染成亮藍色,茜素紅與考馬斯亮藍雙染能夠較好地表征熱膠凝時肌球蛋白樣品中鈣鹽的分布與凝膠的結構變化。如圖2所示,空白組中(未加NFB),樣品均被染成亮藍色,未觀察到玫紅色,說明空白組中Ca含量較少;NFB加入后,樣品中均觀察到玫紅色,表明樣品中Ca含量明顯增多,這與表面元素的結果(表2)一致。
未加熱條件下,空白組與NFB組中肌球蛋白均以粗絲形式存在。40 ℃加熱處理后,肌球蛋白樣品形成凝膠網絡結構,但是孔隙較大。相較于空白組,NFB組中的網絡結構更為連續,二段式加熱處理后,NFB組形成了更為致密的三維凝膠網絡結構。Jia Dan等研究發現,Ca會誘導肌球蛋白的雙螺旋結構變得伸展,在凝膠化及魚糕化過程中伸展的肌球蛋白進一步通過疏水相互作用和二硫鍵發生聚集,形成致密的網絡結構。
圖2 經染色后的肌球蛋白樣品的光學顯微鏡圖Fig. 2 Optical microscopic images of stained myosin samples
2.4 CLSM結果
如圖3所示,未加熱條件下,相較于空白組,NFB組中肌球蛋白粗絲排列更為有序,粗絲間隙變小。本研究中蛋白體系pH值為7.5,高于pI 5.5,此時,肌球蛋白帶凈負電荷,根據Arfat等報道,推測NFB釋放的Ca與肌球蛋白所帶負電荷形成鹽橋,促進了肌球蛋白粗絲之間發生交聯,使粗絲間隙減小。一段式加熱和二段式加熱處理后,相較于空白組,NFB組凝膠網絡結構更為均勻,粗糙程度有所改善。加熱過程中,Ca誘導肌球蛋白構象改變,同時暴露疏水性氨基酸殘基、巰基等功能性基團,這有利于蛋白質之間通過疏水相互作用、二硫鍵形成聚集體,進而形成均勻的網絡結構。
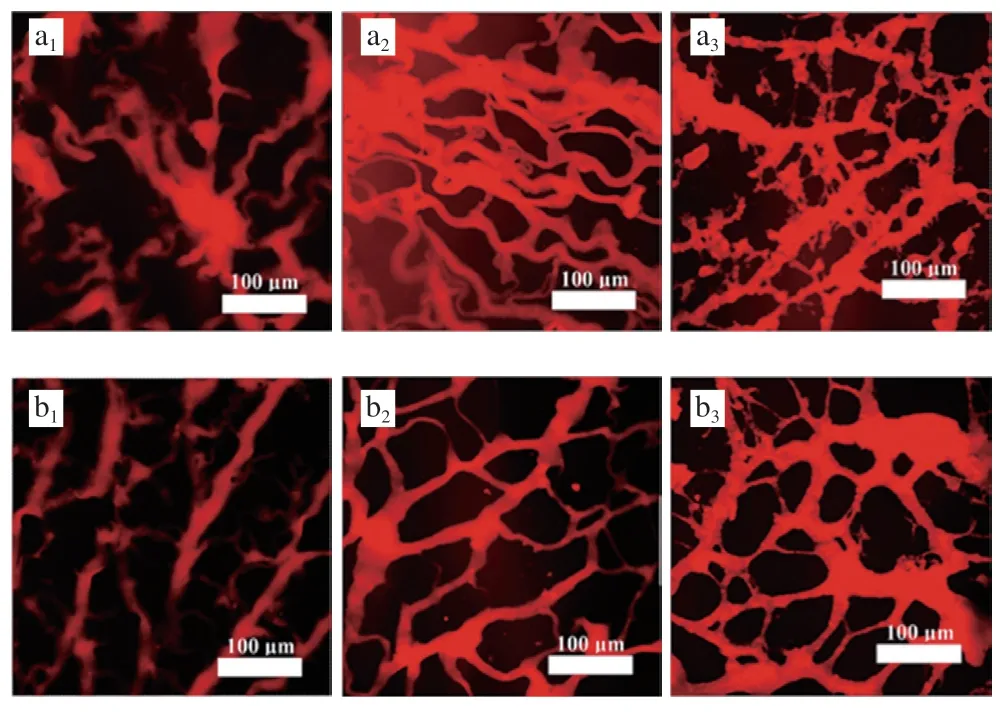
圖3 NFB加入后肌球蛋白在不同加熱方式下的激光共聚焦圖像Fig. 3 CLSM images of myosin with the addition of NFB during gelation
2.5 NFB對肌球蛋白水分分布的影響
低場核磁技術是一種安全、非破壞性的檢測手段,被廣泛地用來監測食品中水分的分布與流動性。如圖4所示,肌球蛋白膠凝過程中存在2 個水分分布峰,分別位于65.79~403.7 ms和464.16~1 873.82 ms附近。根據相關文獻報道,這2 個峰分別對應不易流動水(T)和自由水(T)。表3為膠凝過程中肌球蛋白T弛豫時間的變化。空白組中,隨著加熱的進行,T向低弛豫時間移動,表明水分子的流動性降低,推測這是由于加熱過程中形成的凝膠網絡結構(圖3)將水分子束縛其中。與空白組相比,加入NFB顯著降低了T弛豫時間(P<0.05),表明自由水的流動性降低。根據Ahmad等報道,推測NFB釋放的Ca與熱處理使蛋白質構象發生變化,暴露出水分子結合位點,這有利于提高蛋白質的水合作用,降低自由水流動性;此外,加入NFB后形成更致密的微觀結構(圖2、3)也有利于增強對水分子的束縛能力,降低水分子流動性。
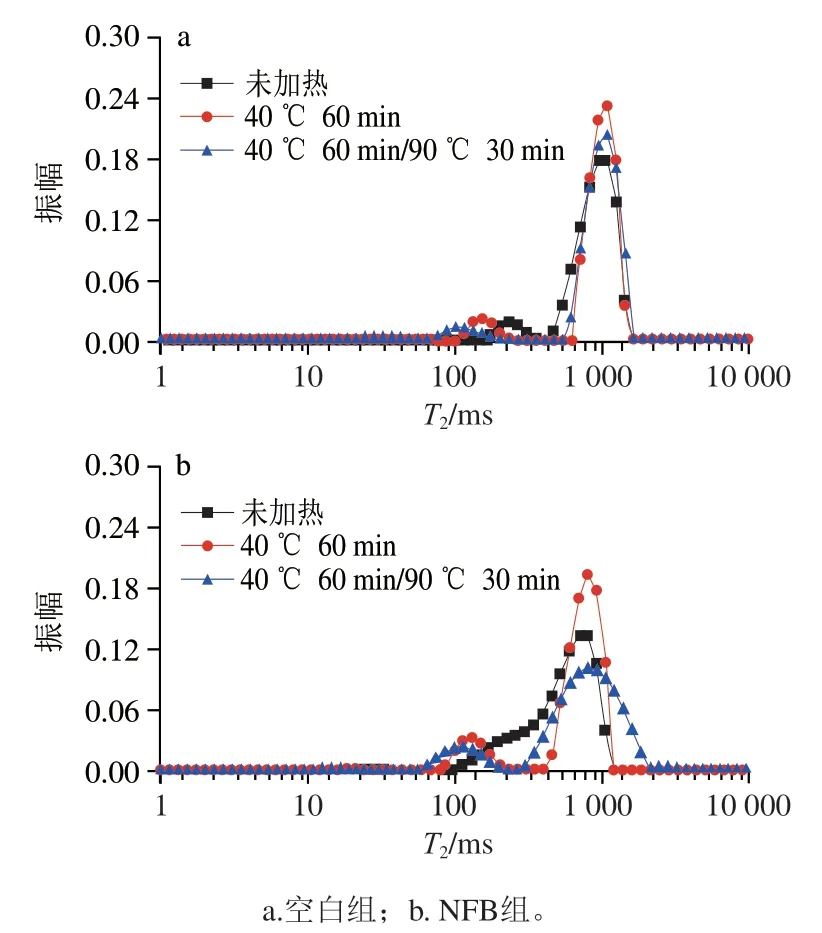
圖4 NFB對肌球蛋白加熱過程中水分分布的影響Fig. 4 Effect of NFB on LF-NMR spetrum of myosin under different heating conditions

表3 NFB對肌球蛋白T2弛豫時間的影響Table 3 Effect of NFB on T2 relaxation time of myosin
3 結 論
NFB中含有較多的Ca、P元素,加入肌球蛋白后,NFB-Ca仍以不溶性鈣形態為主(>95%),加熱處理促進了Ca元素向表面遷移。隨著加熱的進行,樣品中部分可溶性鈣以鹽橋方式參與形成肌球蛋白凝膠,促進形成較為致密的凝膠結構,有利于增強對水分子的束縛,降低自由水的流動性,同時提高了表面Ca元素的分布均勻性。綜上,肌球蛋白膠凝過程中NFB-Ca賦存形態發生改變,部分離子鈣通過參與形成鹽橋的形式轉變為不溶性鈣,促進肌球蛋白形成均勻致密的凝膠網絡結構,增強了對水分子的束縛能力。

