動物組織提取的促皮質素和硫酸魚精蛋白中病毒去除/滅活工藝驗證
孫源遠 王欣 周輝 劉弘忍
(上海上藥第一生化藥業有限公司 上海 200240)
隨著動物源性組織、細胞、體液制備的生物制品逐漸增多,應用范圍越來越廣,生物組織提取制品中潛在的動物源性病毒感染問題愈發受到關注[1-2]。2005年國家藥品評審中心發布《生物組織提取制品和真核細胞表達制品的病毒安全性評價技術評審一般原則》,規定對生物組織提取制品生產工藝進行病毒去除/滅活驗證及有效工藝步驟的評價[3-4]。目前由動物組織提取的生化藥制品,大多采用有機試劑提取、酸堿提純、鹽析梯度沉淀等方法對生物組織中的有效成分進行提取,但其生產工藝中缺乏病毒去除/滅活的步驟,這一方面不符合現行藥品法規的規定,另一方面也對后續的藥品質量埋下隱患。因此,本研究針對動物組織提取中較為常見的工藝步驟,增加病毒去除/滅活驗證,完善工藝質量體系。
1 材料和方法
1.1 樣品
三批次垂體前葉粉(批號為161029、161112和170101,泰興市金葉農副產品有限公司):三批次垂體前葉沉淀前濾清液(批號為520171102、520171103和520171104)、三批次硫酸魚精蛋白粗制中間體(批號490190401-1、490190402-1和490190403-1)、三批次硫酸魚精蛋白精制中間體(批號490190401-2、490190402-2和490190403-2)均來自上海上藥第一生化藥業有限公司。
1.2 指示病毒
考慮指示病毒的基因組、有無包膜和理化抗性等因素,同時結合促皮質素和硫酸魚精蛋白的病毒滅活驗證工藝,選擇了六種具有代表性的指示病毒(表1)。
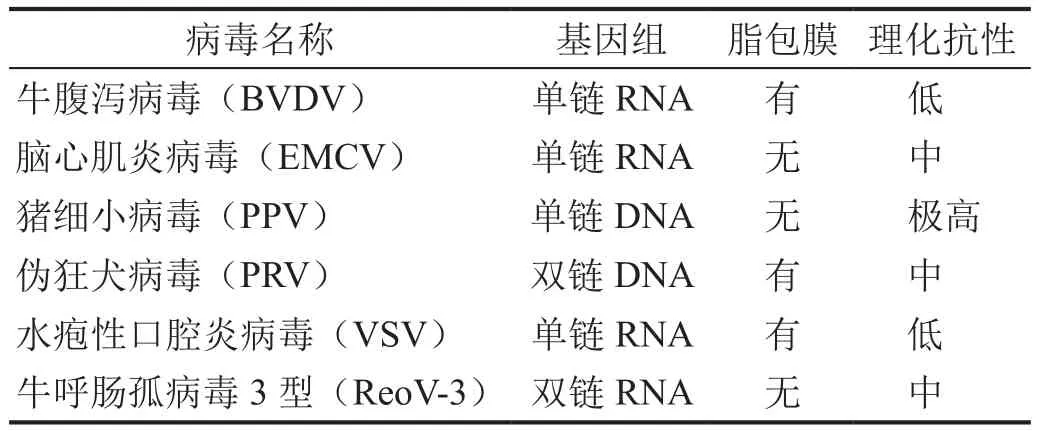
表1 指示病毒及其理化性質
1.3 方法
促皮質素病毒去除/滅活工藝驗證都選擇加熱步驟和丙酮沉淀步驟;硫酸魚精蛋白病毒去除/滅活工藝驗證選擇酸醇處理步驟和加熱步驟。
病毒滴度測定參照消毒技術規范(2002版)“2.1.1.10病毒滅活試驗”[5]以及《動物病毒學》(第二版)“(四)病毒感染力的滴定”[6]的標準,應用微量滴定法測定。
1.3.1 促皮質素病毒去除/滅活工藝驗證
促皮質素是垂體前葉粉經過鹽酸丙酮法提取再經丙酮沉淀得到,因此選擇了工藝中鹽酸加熱步驟和丙酮沉淀步驟作為病毒去除/滅活步驟。
1)加熱步驟 取垂體前葉粉加入7倍量(W/V)丙酮,3倍量(W/V)1 mol/L HCl溶液,攪拌溶解15 min后,將其置于(51±1)℃恒溫水浴鍋中,待樣品溫度升至50 ℃時,按25∶1(樣品-病毒,V∶V)比例分別加入指示病毒EMCV、PPV或ReoV-3,混勻后開始計時,繼續于(51±1)℃恒溫水浴鍋中保溫滅活,分別在0、5、15、30和60 min時從中取樣測定各取樣時間點的病毒滴度。最終病毒滅活效果以樣品與起始滴度對照的病毒滴度差值計算。
2)丙酮沉淀步驟 按9∶1(垂體前葉中間體濾清液-病毒,V∶V)比例分別加入指示病毒BVDV,PRV或VSV,混勻。取其中一份,加入7倍量純水,剩余五份分別按1∶7(樣品-冷丙酮,V∶V)比例加入冷丙酮,攪拌混勻后繼續于(51±1)℃恒溫液浴循環兩用槽中靜置沉淀,開始計時,分別在計時至0、5、15、30和60 min時取出一份,3 000 r/min離心(Eppendorf Centrifuge 5810R)1 min后,用移液器分離上清和沉淀,沉淀用純水復溶至原體積,分別從上清和沉淀復溶液中取樣測定病毒滴度。最終病毒滅活效果以樣品與起始滴度對照的病毒滴度差值計算。
3)盲傳三代 將各指示病毒三批次加熱保溫30 min取樣的樣品50倍稀釋度的測定細胞孔(測定為陰性的細胞孔)分別進行盲傳三代。
1.3.2 硫酸魚精蛋白病毒去除/滅活工藝驗證
硫酸魚精蛋白是由魚白粗品經過酸醇提取,高溫、酸堿去除核酸最終得到,因此選取了酸醇處理和加熱步驟作為病毒去除/滅活步驟。
1)酸醇處理步驟 取粗制中間體,按每公斤粗品加入1.2 L酸醇溶液(量取98%硫酸147 mL加入純化水至2 L待用,再量取95%乙醇240 mL,加入上述硫酸溶液,再加純化水至總體積2.4 L,配制成含6%硫酸的酸醇溶液)計算加入酸醇溶液,將其置于(16±1)℃恒溫液浴循環兩用槽中,按15∶1(粗制中間體-病毒,W∶V)比例加入指示病毒PRV和VSV,攪拌混勻后開始計時,分別在計時至0、0.5、1和2 h時從中取樣測定各取樣時間點的病毒滴度。最終病毒滅活效果以樣品與起始滴度對照的病毒滴度差值計算。
2)加熱步驟 取精制中間體,加入2.5倍重量(W∶V)的純水,將其置于(86±1)℃恒溫水浴鍋中加熱至85 ℃后,用玻棒攪拌10 min使中間體全部溶解,再按14∶1(樣品-病毒,W∶V)比例加入指示病毒PPV和ReoV-3,混勻后開始計時,分別在計時至0、10、20和30 min時從中取樣用培養基稀釋200倍后測定各取樣時間點的病毒滴度。
3)盲傳三代 將各指示病毒三批次加熱保溫30 min時取樣的樣品加入50倍稀釋度的測定細胞孔(測定為陰性的細胞孔)分別進行盲傳三代。
2 結果
2.1 促皮質素病毒去除/滅活工藝驗證
2.1.1 加熱法病毒滅活
三批次樣品中EMCV、PPV和ReoV-3滴度均降至檢測限1.7 logs(經細胞毒試驗,將培養基稀釋50倍,此時細胞生長良好,所以檢測限為1.7 logs)以下,滴度平均下降值≥4 logs(表2),表明該升溫過程對這些病毒具有滅活作用。
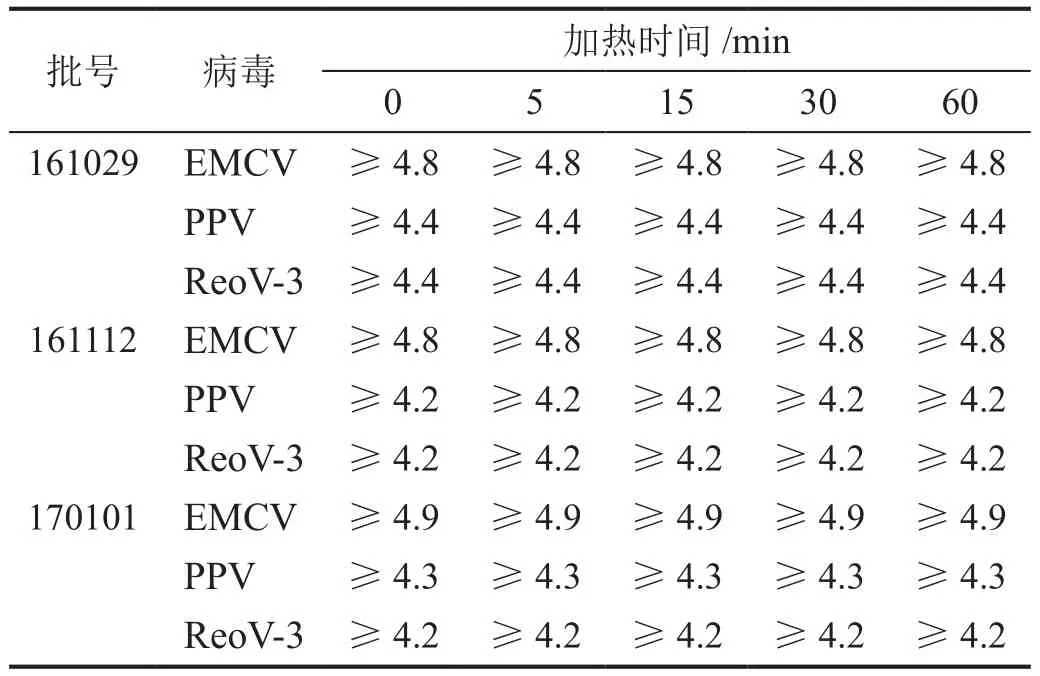
表2 加熱時間對促皮質素中病毒滅活的影響
2.1.2 丙酮沉淀步驟病毒滅活
三批次上清和沉淀中BVDV、PRV和VSV滴度均降至檢測限1.7 logs以下(表3)。
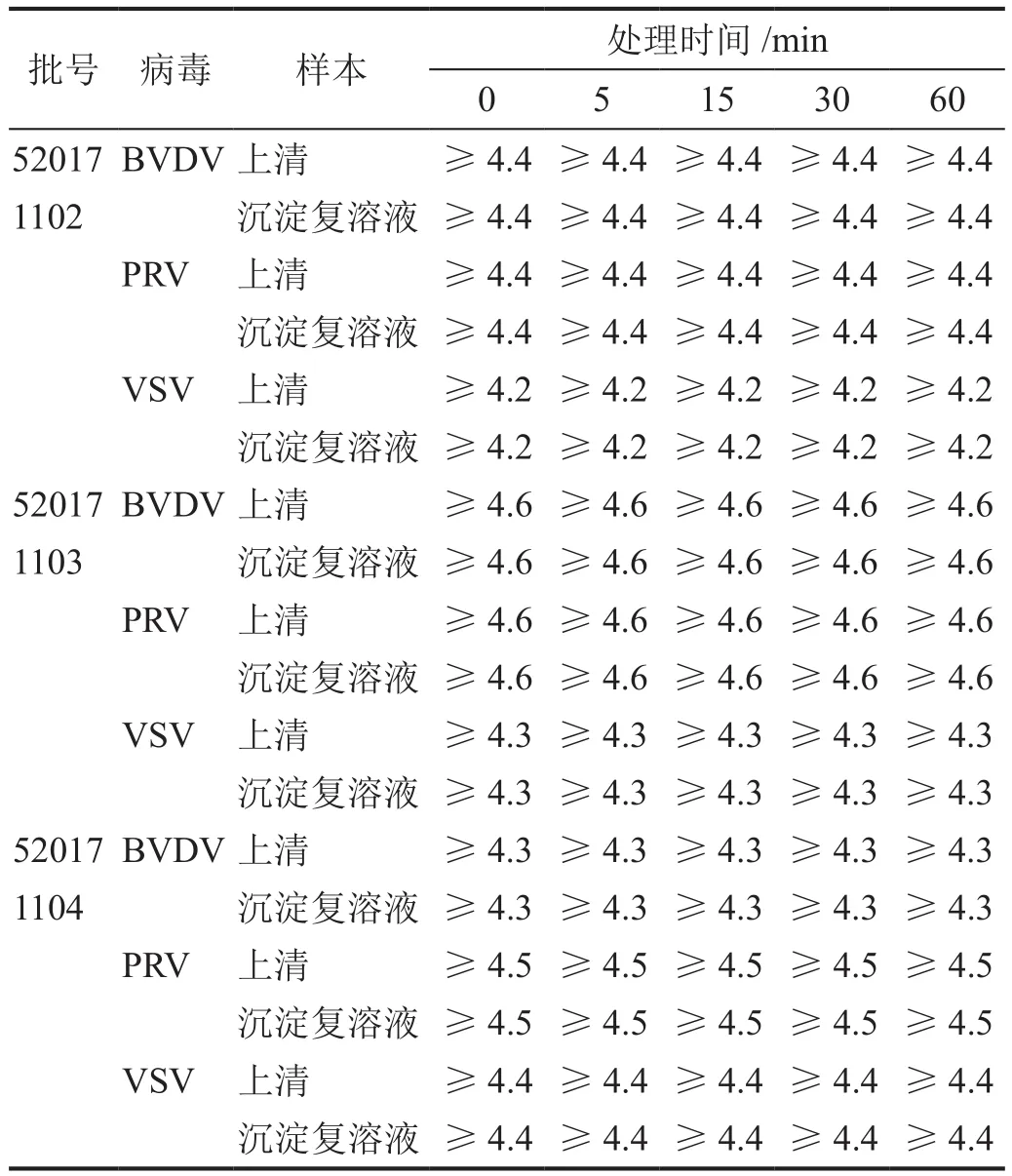
表3 丙酮處理時間對促皮質素中病毒滅活的影響
將三批次丙酮沉淀30 min時從上清和沉淀復溶液中分別取樣的樣品加入50倍稀釋度的細胞孔(測定為陰性的細胞孔)分別進行盲傳三代,指示細胞(MDBK細胞、ST細胞和Vero細胞)均正常生長,即盲傳三代無病變,表明BVDV、PRV和VSV均被完全滅活。這些結果表明,該工藝對脂包膜指示病毒(BVDV、PRV和VSV)均具有快速滅活作用。
2.2 硫酸魚精蛋白病毒去除/滅活工藝驗證
2.2.1 酸醇處理步驟病毒滅活
三批次粗制中間體中加入酸醇溶液后再加入指示病毒,攪拌混勻后立即取樣,三批次樣品中PRV滴度均降至檢測限1.50 logs(經細胞毒試驗,將培養基稀釋100倍,此時細胞生長良好,所以檢測限為1.50 logs)以下,滴度平均下降值≥4.52 logs;取樣后剩余染毒樣品于(16±1)℃水浴攪拌保溫,經攪拌保溫滅活0.5 h,三批次樣品中VSV滴度均降至檢測限1.50 logs以下,滴度平均下降值≥ 4.30 logs(表4)。
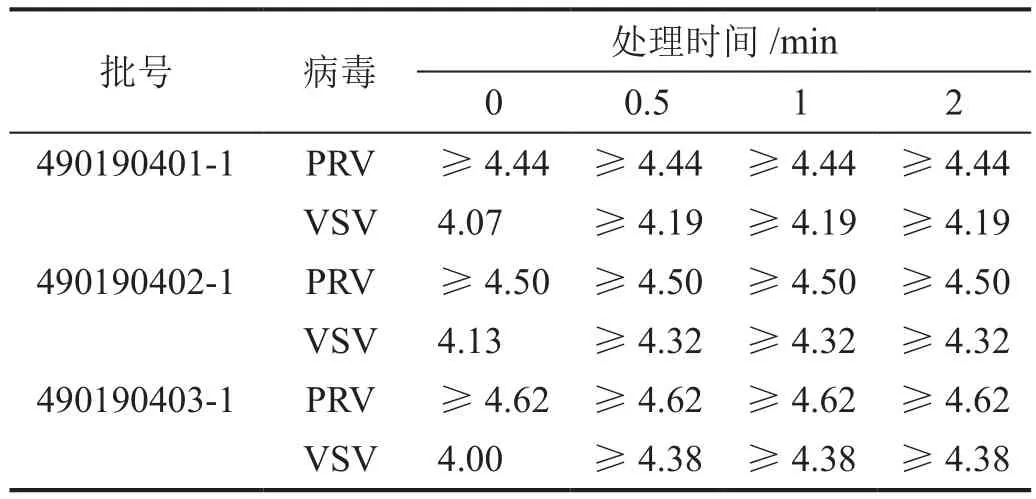
表4 酸醇處理時間對硫酸魚精蛋白中病毒滴度的影響
將三批次酸醇處理1 h時取樣的樣品加入100倍稀釋度的細胞孔(測定為陰性的細胞孔)分別進行盲傳三代,指示細胞(ST細胞/Vero細胞)均正常生長,即盲傳三代無病變,表明指示病毒PRV和VSV均被完全滅活。這些結果表明,酸醇處理對脂包膜指示病毒PRV和VSV均具有快速滅活作用。
2.2.2 加熱步驟病毒滅活
三批次精制中間體中加入純水后升溫至85 ℃,攪拌溶解后再加入指示病毒,混勻后立即取樣,三批次樣品中PPV和ReoV-3滴度均降至檢測限1.80 logs(經細胞毒試驗,將培養基稀釋200倍,此時細胞生長良好,所以檢測限為1.80 logs)以下,其中PPV滴度平均下降值≥4.08 logs,ReoV-3滴度平均下降值≥4.23 logs(表5)。
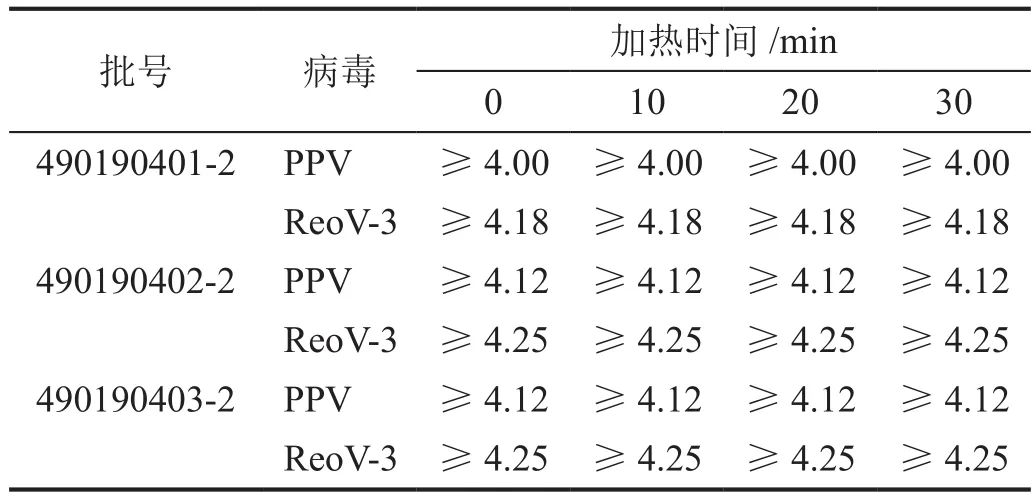
表5 加熱時間對硫酸魚精蛋白中病毒滴度的影響
將三批次加熱20 min時取樣的樣品加入200倍稀釋度的細胞孔(測定為陰性的細胞孔)分別進行盲傳三代,指示細胞(ST細胞/LLC-MK2細胞)均正常生長,即盲傳三代無病變,表明指示病毒PPV和ReoV-3均被完全滅活。這些結果表明,加熱步驟對非脂包膜指示病毒PPV和ReoV-3也具有快速滅活作用。
3 討論
本文三種動物源性生物組織提取制品經病毒去除/滅活工藝,病毒滴度下降值可達到4 logs,為有效的病毒去除/滅活工藝,達到了《生物組織提取制品和真核細胞表達制品的病毒安全性評價技術評審一般原則》的安全標準。說明丙酮處理和加熱法是在生產工藝中有效的病毒去除/滅活的方法。
病毒去除/滅活方法驗證還須基于原始工藝步驟,其重要的原則是盡可能不改變原始工藝,因此本研究的幾種方法并不是適用于全部的動物組織提取制品,除了本研究驗證的去病毒方法,通常動物組織提取中還有S/D法[7-8]、巴氏消毒法[9]、色譜柱及納米膜過濾法[10]等有效去除/滅活病毒的方法,可以針對不同工藝體系進行去病毒驗證,以保證藥品生產的質量。
鑒于動物組織提取制品的特殊性(其來源多為動物內臟或組織),所以除了針對其工藝進行去病毒工藝步驟的選擇和驗證,同時也要積極地改進工藝步驟,采用層析,超濾等本身具有病毒去除/滅活特性的步驟來達到藥品質量的安全性;另一方面,藥品生產企業也同時要把好粗品來源的關口,積極主動地進行原料商的審查,從粗品來源保證藥品的質量。
致謝:感謝王小良,吳娟對本研究中病毒測定的貢獻。

