川芎嗪調控Gαs/cAMP/PKA信號通路改善哮喘模型大鼠氣道炎癥的作用研究
王雅娟,鄒瑩瑩,高華武,陳 明,王桐生
(1. 安徽中醫藥大學中西醫結合學院,2. 安徽省中醫藥科學院中藥藥效與安全性評價研究所,安徽 合肥 230012)
支氣管哮喘是呼吸系統常見疾病,近年來發病率逐年上升,日漸成為影響人民生活質量的主要因素之一,也是發展中國家衛生行業的一項沉重負擔。哮喘以可逆的氣道阻塞、支氣管氣道高反應性為特征,以氣道的慢性炎癥為主要致病因素。反復發作的氣道炎癥與機體免疫失衡共同導致了氣道重塑和氣道高反應性(airway hyperresponsiveness, AHR)的發生。目前,臨床上哮喘的治療方法以松弛氣道平滑肌和抗氣道慢性炎癥為主,一線藥物包括β2腎上腺素受體激動藥和糖皮質激素類藥。β2腎上腺素受體屬于G蛋白偶聯受體(G-protein coupled receptors, GPCRs),其激動后介導了氣道平滑肌的舒張。而氣道平滑肌上的其他GPCRs,如膽堿受體、組胺受體、白三烯受體、白介素受體、趨化因子受體及前列腺素受體等,均與氣道平滑肌的收縮及氣道的慢性炎癥密切相關,甚至介導了腫瘤壞死因子α(tumor necrosis factor α, TNF-α)、白細胞介素(interleukin, IL)-4、IL-13等炎癥因子的釋放及氣道慢性炎癥反應。因此近年來靶向這些G蛋白偶聯受體(G-protein coupled receptors, GPCRs)的藥物也層出不窮,如白三烯受體拮抗劑、抗IL-4Rα抗體等。這類藥物能夠通過細胞內第二信使cAMP影響其下游的PKA、Ca2+通道、PKC的激活及ERK、JNK、MAPK、JAK的磷酸化等,介導了包括支氣管松弛、抑制氣道炎癥等多種細胞內代謝、免疫、炎癥反應,促進了哮喘的病理生理過程發生[1-3]。
中藥川芎具有祛風止痛、活血行氣之功效,為“血中之氣藥”。川芎嗪作為川芎的主要藥效成分,對血管平滑肌有解痙作用,并能夠提高血小板中的cAMP含量,可降低血小板表面活性,抑制血栓烷A2(thromboxane A2,TXA2)的活性和生物合成,抑制血小板聚集,并且能使已聚集的血小板解聚[4]。祖國傳統醫學將哮喘歸于肺氣虛證,認為其兼有氣虛、血瘀的特點,而氣虛血瘀則可使血液中的白細胞、單核細胞等黏附于血管內皮,促進炎癥的發生發展。已有研究表明,多種具有活血化瘀作用的中藥及方劑對哮喘有較好的療效[5-6]。近年來也有研究發現,川芎嗪能夠影響白介素及其受體的功能,有效抑制哮喘中的氣道炎癥,對p38MAPK通路的活性具有明顯的抑制作用,有可能成為一種潛在的哮喘治療藥物[7-9]。我們前期的研究表明,川芎嗪能夠明顯改善哮喘大鼠的血流變特征,抑制大鼠的血小板聚集,并減少大鼠氣道的炎癥細胞浸潤,抑制AHR的發生并降低血清IgE含量,對催化cAMP水解反應的磷酸二酯酶(phosphodiesterase,PDE)也有明顯的抑制作用[10-12]。
為進一步研究川芎嗪對哮喘的防治作用及其對GPCR信號活性的影響,闡明其作用機制,該研究以幼齡大鼠復制哮喘模型,研究川芎嗪對哮喘模型大鼠的AHR及氣道炎癥細胞浸潤、膠原增生、黏液分泌的影響,并從GPCR信號通路的活性方面進一步研究其作用機制,為闡明川芎嗪對哮喘的防治作用及可能的作用機制提供實驗依據。
1 材料與方法
1.1 實驗動物3~4周齡Sprague-Dawley大鼠(80~100) g,SPF級,♂,動物合格證號: Scxk(滬)2008-0016,購自上海西普爾-必凱實驗動物有限公司,在安徽中醫藥大學動物中心飼養。環境溫度(22±2)℃,濕度 50%~80%,光照實行每12 h明暗交替,自由攝食飲水。實驗設計已經安徽中醫藥大學倫理委員會論證(動物倫理號:AHUCM-rats-008)。
1.2 藥物與試劑卵白蛋白(ovalbumin,OVA,V級,Sigma公司,A5253);乙酰甲膽堿(methacholine,Mch,Sigma公司,批號79H1505);磷酸川芎嗪片(鼎復康藥業股份有限公司,批號160511);硫酸沙丁胺醇片(天津力生制藥股份有限公司,批號160522),IL-4、IL-5、IL-13、TNF-α 大鼠ELISA試劑盒(武漢基因美科技有限公司,JYM0647Ra & GR2016-05、JYM0490Ra & GR2016-05、JYM0477Ra & GR2016-05、JYM0635Ra & GR2016-05);環磷酸腺苷(cAMP)大鼠ELISA試劑盒(上海源葉生物科技有限公司,20161108)。TRIzol(Invitrogen公司,135303);氯仿、無水乙醇、異丙醇(上海蘇懿化學試劑有限公司,20151020);DEPC(Sigma公司,20150802554);QuantiFast SyBr Green PCR kit(Qiagen,151033144);逆轉錄試劑盒(RevertAidTMfirst Strand cDNA Synthesis Kit)(Thermo公司,00330969);引物由Invitrogen公司合成。RIPA細胞裂解液(Beyotime,P0013B);預染蛋白Marker(Thermo,00495577);ECL超敏發光試劑盒(Thermo,QF220648);Western一抗二抗去除液(Beyotime,P0025);cAMP反應元件結合(cAMP response element,CREB)(兔抗大鼠,Bioworld,CJ36131);PKA(兔抗大鼠,北京博奧森,AD17852061);Gαs(兔抗大鼠,NewEast Bio,21007);GRK2(兔抗大鼠,Bioss,bs-1209R);β-Actin(小鼠抗大鼠,Zsbio,17AV0303);通用二抗試劑盒(北京中杉,K136830B)。
1.3 主要儀器小動物肺功能儀(南京美易公司,V5.0);霧化吸入器(上海新天緣醫療設備有限公司,980型);顯微鏡 (Olympus BX51,Germany);冷凍離心機(黑馬儀器公司,TGL-18R)。切片機(德國Leica RM2135);自動脫水機(亞光 ZT-12M、亞光YB-7B,湖北孝感)。酶標儀(雷杜公司,RT-6000);熒光定量PCR儀(Thermo PIKOREAL 96);微量離心機(海門市其林貝爾儀器制造有限公司,LX300);洗板機(雷杜公司,RT-3100);Millipore PVDF膜;EPS300型電泳儀(Tanon);VE-180型電泳槽(Tanon);VE-186型轉膜儀(Tanon);醫學影像分析系統(江蘇省捷達科技發展有限公司,JD801)。
1.4.1哮喘大鼠模型復制 哮喘大鼠模型采用十點致敏法,以含0.2%OVA (GradeⅤ)的Al(OH)3凝膠十點致敏,并以含1%OVA的生理鹽水溶液霧化被動吸入攻擊復制。具體方法如下:d 0,對各組大鼠進行十點致敏,每點皮下注射0.05 mL 含0.2%OVA的Al(OH)3凝膠,另再腹腔注射0.5 mL,每鼠總共1 mL[13]。從d 14開始,每天用含1%OVA的生理鹽水溶液給大鼠霧化吸入30 min進行攻擊,連續7 d,復制哮喘大鼠模型。
1.4.2動物分組及給藥 各組大鼠適應性飼養1周,隨機分為對照組、哮喘模型組、川芎嗪組(根據前期實驗結果[11],結合臨床成人用量,選擇最佳劑量40 mg·kg-1·d-1,每片含川芎嗪50 mg,取8粒藥加入100 mL 5%葡萄糖溶液中充分溶解,配成4g·L-1的藥液,每天按10 mL·kg-1給藥)、沙丁胺醇組(1 mg·kg-1·d-1,每片含沙丁胺醇2 mg,取5粒藥加入100 mL 5%葡萄糖溶液中充分溶解,配成0.1 g·L-1的藥液,每天按10 mL·kg-1給藥),每組15只。哮喘模型組及各給藥組動物采用十點致敏法復制哮喘模型,其中川芎嗪組和沙丁胺醇組大鼠于每次攻擊前0.5 h灌胃給藥,每天1次,持續7 d。
1.4.3大鼠AHR測定 哮喘大鼠在末次抗原攻擊后24 h,以20%烏拉坦 5 mL·kg-1腹腔注射實施麻醉,行氣管插管,置于小動物肺功能儀的密閉的體描箱內,記錄各組大鼠的初始肺阻力(resistance of lung,RL) 和肺順應性(dynamic compliance,Cdyn),之后以超聲霧化器將質量濃度分別為0.5、1.0、2.0、4.0和8.0 g·L-1的 Mch霧化依次注入大鼠氣道,每一濃度Mch吸入20 s,記錄5 min內的RL和Cdyn的變化。
1.4.4哮喘大鼠的肺組織形態學變化觀察 以10%甲醛固定大鼠肺組織,行常規石蠟包埋,HE、Masson、PAS染色觀察哮喘大鼠肺組織及氣道周圍炎癥細胞浸潤、黏液分泌及纖維增生。
1.4.5大鼠血清中炎癥因子含量測定 末次抗原攻擊后24 h,麻醉大鼠,股動脈取血,離心取血清,依照ELISA檢測試劑盒說明書檢測血清中炎癥因子含量。檢測的炎癥因子,包括IL-4、IL-5、IL-13、TNF-α。
1.4.6大鼠肺組織及血漿中cAMP含量的測定 末次抗原攻擊后24 h,麻醉大鼠,股動脈取血,抗凝后離心取血漿,ELISA法檢測血漿cAMP含量。取大鼠肺組織勻漿,離心取上清,ELISA法檢測肺組織cAMP含量。
1.4.7大鼠肺組織中PKA蛋白的表達量測定 取肺組織蠟塊切片,常規免疫組化染色法觀察哮喘大鼠肺組織PKA表達情況。PKA一抗選用兔抗大鼠(1 ∶200),二抗選用即用型二抗。
(1) 目前許多學者對地震作用下巖質邊坡的動力響應特征進行了研究,但是已有的研究成果不夠深入,尚需進一步深入研究,針對復雜地質構造巖質邊坡的研究較少,尤其是對同時含順向及逆向軟弱結構面的巖質邊坡研究更少,急需開展該類型邊坡的地震響應特征及其變形破壞機制研究。目前,針對地震作用下巖質邊坡響應規律的研究及對地形效應的認識,多是關于邊坡頂部放大及坡底衰減,對邊坡的整個坡面上及坡體內部的作用效應認識具有局限性,還未形成定量規律,尤其是對于含軟弱結構面的巖質邊坡難以指導抗震設計。
1.4.8q-PCR法檢測大鼠肺組織CREB的mRNA表達量 TRIzol法提取肺組織RNA,定量檢測RNA濃度,合成cDNA,進行qRT-PCR。以二步法熒光定量PCR檢測大鼠肺組織中CREB的基因表達量,反應條件為95 ℃進行1 min,95 ℃變性20 s、60 ℃退火30 s,72 ℃延伸20 s,循環進行40次。ΔΔCt法分析Ct值,以β-actin作為內參參照基因進行計算,以2-ΔΔCt表示基因表達量。所用引物序列見Tab 1。

Tab 1 Primers involved in Real-Time PCR
1.4.9Western blot法檢測大鼠肺組織中Gαs、GRK2、CREB的蛋白表達量 取100 mg肺組織,常規方法提取肺組織總蛋白。按照1 ∶4比例在蛋白樣品中加入5×SDS-PAGE蛋白上樣緩沖液,沸水中加熱10 min,充分變性蛋白。冷卻至室溫,上樣到SDS-PAGE膠加樣孔內,電泳(80 V 30 min,120 V 1 h)、轉膜、封閉后,加入一抗、二抗孵育。一抗參考說明書,CREB抗體按照1 ∶500比例、GRK2抗體按照1 ∶200比例、Gas抗體按照1 ∶200比例,分別用一抗稀釋液進行稀釋(抗體屬性均為兔抗);二抗參考說明書,按照1 ∶10 000比例用二抗稀釋液稀釋。蛋白檢測按照說明書要求,用ECL發光試劑盒檢測。
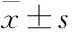
2 結果
2.1 川芎嗪對哮喘大鼠AHR的影響根據小動物肺功能儀分析所得數據,分別繪制大鼠肺阻力變化和肺順應性變化趨勢圖。如Fig 1A所示,模型組大鼠肺阻力較對照組明顯升高,隨Mch刺激濃度的增加,模型組大鼠肺阻力上升趨勢增加,4.0 g·L-1和8.0 g·L-1的Mch濃度刺激時肺阻力增加較對照組差異具有統計學意義(P<0.01),肺阻力上升趨勢大于其余各組,說明哮喘大鼠的AHR較其余各組明顯;與模型組相比,川芎嗪和沙丁胺醇組大鼠在各個濃度Mch刺激時的肺阻力明顯降低,4.0 g·L-1和8.0 g·L-1的MCh濃度刺激時較模型組大鼠差異有統計學意義(P<0.05)(Fig 1A)。如圖1B所示,模型組大鼠的肺順應性較對照組明顯降低,在2.0 g·L-1、4.0 g·L-1和8.0 g·L-1的Mch濃度刺激時肺順應性的降低較對照組差異具有統計學意義(P<0.05),且Mch刺激濃度增加時降低趨勢增加,高于其余各組;與模型組相比,川芎嗪和沙丁胺醇組大鼠在各Mch濃度刺激時肺順應性明顯升高,其中沙丁胺醇組在2.0 g·L-1、4.0 g·L-1和8.0 g·L-1的MCh濃度刺激下與模型組大鼠相比差異有統計學意義(P<0.05),川芎嗪組也能夠增加哮喘大鼠的肺順應性,但是與模型組相比差異沒有統計學意義(P>0.05)(Fig 1B)。

Fig 1 Effect of ligustrazine on RL (A) and Cdyn (B) of asthmatic rats
2.2 川芎嗪對哮喘大鼠肺組織形態學的影響HE染色觀察肺組織及氣道周圍病理變化,Fig 2可見,對照組氣道壁及肺泡結構正常,氣道黏膜上皮結構完整,未見明顯炎癥細胞浸潤,哮喘大鼠肺間質及氣道周圍可見炎癥細胞大量浸潤,支氣管管壁明顯增厚、管腔變窄,氣道壁及肌層較對照組明顯增厚。川芎嗪組、沙丁胺醇組大鼠肺間質及氣道周圍炎癥細胞浸潤明顯減少,氣道壁及肌層較模型組明顯變薄,且二者作用相當(Fig 2)。

Fig 2 Effect of ligustrazine on lung tissues of asthmatic rats (HE×200)
氣道炎癥會導致杯狀細胞增生及黏液分泌增加,從而加重氣流受限,誘發AHR。PAS糖原染色可觀察大鼠氣道杯狀細胞黏液分泌的變化,黏液染色為紫紅色。由Fig 3可見,對照組大鼠氣道黏液分泌不明顯,杯狀細胞基本無增生,哮喘大鼠氣道內可見杯狀細胞明顯增生,黏液分泌也較對照組明顯增加。川芎嗪組、沙丁胺醇組大鼠氣道黏液分泌和杯狀細胞增生情況較模型組明顯改善,且川芎嗪作用優于沙丁胺醇(Fig 3)。
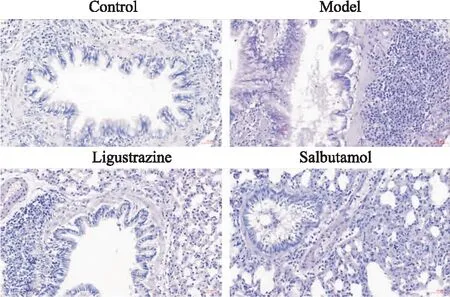
Fig 3 Effect of ligustrazine on goblet cell hyperplasia and mucus secretion of asthmatic rats (PAS staining, ×200)
氣道慢性炎癥會導致肺間質及氣道周圍纖維增生,從而降低肺彈性,增加肺阻力,降低肺順應性。Masson染色可觀察大鼠肺間質與氣道周圍纖維增生的情況,纖維組織染色為藍色。由Fig 4可見,對照組大鼠肺間質及氣道周圍未見明顯纖維增生情況,哮喘大鼠肺間質及氣道周圍可見大量纖維增生,和對照組相比纖維增生明顯。川芎嗪組、沙丁胺醇組大鼠肺組織及氣道周圍纖維增生較模型組明顯減少,川芎嗪作用稍弱于沙丁胺醇(Fig 4)。

Fig 4 Effect of ligustrazine on fibroplasia of asthmatic rats (Masson ×200)
2.3 川芎嗪對哮喘大鼠外周血中炎癥因子含量的影響呼吸道慢性炎癥是哮喘的本質,大量Th2型炎癥因子的分泌是介導氣道慢性炎癥反應和機體的免疫失衡的關鍵因素,也是AHR和氣道重塑的主要誘因,其中最重要的是以IL-4、IL-5、IL-13和TNF-α為代表的炎癥因子。本研究發現,哮喘大鼠的血清中TNF-α、IL-4、IL-5及IL-13水平與對照組相比明顯升高(P<0.01);川芎嗪組和沙丁胺醇組大鼠血清及肺組織中IL-4、IL-5、IL-13及TNF-α水平較模型組明顯降低(P<0.01),且川芎嗪與沙丁胺醇作用相當,提示川芎嗪能夠抑制支氣管哮喘中相關炎癥因子的過度分泌,從而抑制氣道的慢性炎癥,對機體免疫失衡也可能有改善作用(Fig 5)。

Fig 5 Effect of ligustrazine on IL-4, IL-5, IL-13 and TNF-α levels in serum of asthmatic rats
2.4 川芎嗪對哮喘大鼠血漿和肺組織中cAMP含量的影響cAMP是GPCR下游的關鍵信號,介導了細胞炎癥、免疫等多種生理、生化反應,血漿cAMP水平的降低也是臨床上哮喘的主要特征。如Fig 6所示,哮喘模型組大鼠血漿和肺組織勻漿中cAMP含量與對照組相比明顯降低(P<0.01),川芎嗪組和沙丁胺醇組大鼠血漿和肺組織中cAMP含量與模型組相比均有明顯升高(P<0.05),提示川芎嗪對cAMP信號的活性有一定的影響(Fig 6)。

Fig 6 Effect of ligustrazine on cAMP level in plasma and lung tissues of asthmatic rats
2.5 川芎嗪對幼齡哮喘大鼠肺組織中PKA蛋白表達影響PKA是cAMP的下游的關鍵效應蛋白,細胞內cAMP通過活化PKA激活下游信號級聯反應,引發GPCR信號通路介導的生物效應。本研究通過免疫組化染色發現,哮喘大鼠的肺組織中PKA蛋白表達量與對照組相比明顯減少,川芎嗪和沙丁胺醇干預能使大鼠肺組織中PKA蛋白表達量明顯升高(P<0.01),提升川芎嗪能夠增加cAMP信號通路的活性(Fig 7A、B)。
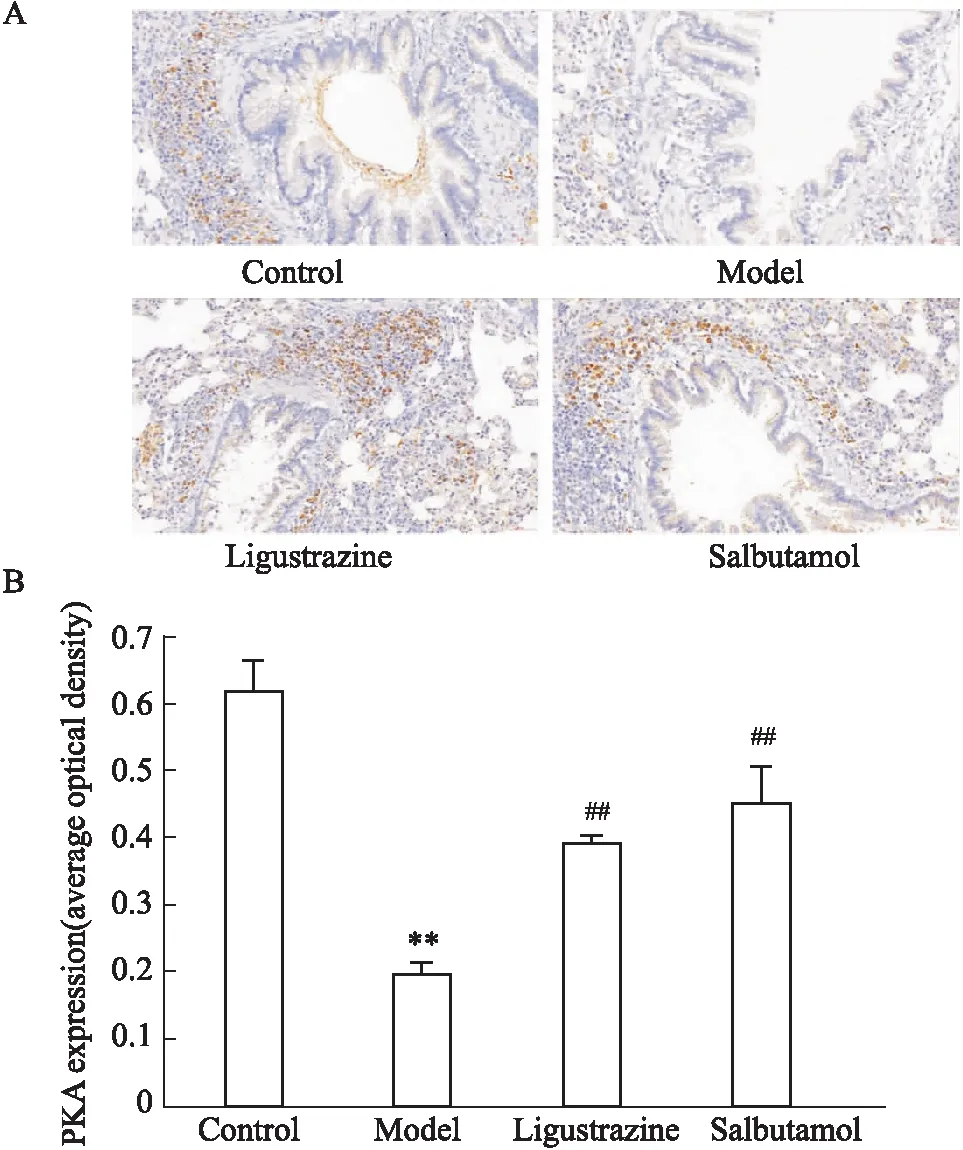
Fig 7 Effect of Ligustrazine on PKA expression of asthmatic rats (IHC staining) (A) and analysis of average optical density(B)
2.6 川芎嗪對幼齡哮喘大鼠肺組織中CREB mRNA表達影響CREB是PKA下游的信號蛋白,能夠被PKA介導活化引起氣道平滑肌細胞的松弛。哮喘時cAMP水平的下降引起PKA活化減少,CREB表達下降,氣道收縮。CREB是cAMP信號激活并引發效應的重要標志性蛋白。川芎嗪能夠增加血漿及肺組織中的cAMP水平,并上調肺組織PKA表達,而PKA活化后會增強CREB的轉錄活性,因此,川芎嗪可能通過上調cAMP信號活性使CREB表達增加。哮喘模型組大鼠肺組織中CREB表達與對照組相比明顯降低(P<0.01);川芎嗪和沙丁胺醇組大鼠肺組織CREB mRNA表達較模型組明顯升高,差異具有顯著性(P<0.05)(Fig 8)。

Fig 8 Effect of ligustrazine on CREB mRNA expression of
2.7 川芎嗪對幼齡哮喘大鼠肺組織中CREB、Gαs、GRK2蛋白表達影響模型組大鼠肺組織中CREB和Gαs表達水平降低而GRK2表達升高,較對照組差異明顯(P<0.01);川芎嗪組和沙丁胺醇組大鼠的肺組織中CREB和Gαs表達水平升高而GRK2表達降低,與模型組相比差異有統計學意義(P<0.01),且二者相當(Fig 9)。

Fig 9 Effect of ligustrazine on CREB, Gαs and GRK2 expression of asthmatic rats
3 討論
哮喘的病理過程涉及機體的炎癥、免疫等多個環節,是機體對外界細菌、病毒、抗原等多種致病因素過度抵抗引發的綜合結果,在致病因素的刺激下,機體釋放一系列的刺激分子和細胞因子,促進氣道炎癥發生,引起粘液分泌、氣道平滑肌痙攣等哮喘癥狀[14],因此哮喘是以免疫系統功能紊亂為基礎,以氣道炎癥及氣流受限、AHR為表現形式的復雜免疫炎癥性疾病。GPCR是具有7次跨膜結構的蛋白質,其信號活性受到G蛋白的狀態、功能及GPCR激酶(GRK)和β-arrestin的調節[15],其中GRK2在肺動脈及肺動脈平滑肌中表達,抑制GRK2可為肺血管收縮性疾病提供一種替代治療策略,其介導的信號通路更有望成為潛在的阻止或治療氣道平滑肌對β2腎上腺素受體激動劑敏感性降低的治療手段[16-17]。cAMP是GPCR信號激活后關鍵的細胞內信號分子,其介導的生理功能與G蛋白狀態密切相關。cAMP激活PKA,繼而促進CREB轉錄,引起膜上的Gq蛋白活化,激活蛋白激酶C(protein kinase C,PKC),引起肌球蛋白輕鏈激酶(myosin light chain kinase, MLCK)激活,最后促進氣道平滑肌(airway smooth muscle, ASM)松弛[18]。
本實驗結果顯示,川芎嗪能夠有效改善哮喘模型大鼠的AHR,減輕氣道阻力并增加肺順應性,在高濃度的乙酰甲膽堿刺激下,可以明顯降低肺阻力;肺組織HE染色結果顯示川芎嗪能夠抑制哮喘大鼠肺組織及氣道周圍的炎癥細胞浸潤,PAS染色結果顯示川芎嗪能夠減少氣道杯狀細胞增生和黏液分泌,Masson染色結果也顯示川芎嗪能夠降低哮喘大鼠肺組織及氣道周圍纖維增生,以上結果提示川芎嗪對幼齡哮喘模型大鼠的氣道炎癥和AHR有改善作用。對外周血中相關炎癥因子的檢測結果顯示,川芎嗪能夠降低哮喘大鼠血清中炎癥因子含量,顯著降低TNF-α和IL-4、IL-5、IL-13水平,提示川芎嗪能夠抑制Th2型細胞因子和炎癥因子分泌,可能對哮喘大鼠的免疫失衡有改善作用。在進一步對GPCR信號通路活性的研究中發現,川芎嗪能夠明顯抑制GRK2蛋白表達并增加Gαs蛋白表達,增加血漿中cAMP含量,上調cAMP的效應蛋白PKA和CREB的表達,提示川芎嗪對GPCR信號通路活性具有有一定的調節作用,能夠減弱GRK對GPCR信號的抑制作用并減少受體脫敏,增加Gαs蛋白活性從而產生更多的cAMP,從而激活細胞內PKA/CREB信號,這也可能是川芎嗪防治哮喘的關鍵機制。由于GPCR信號涉及多種信號分子,共同參與了機體的炎癥反應和免疫平衡的調節,在哮喘的發生發展過程中G蛋白發生了哪些具體變化,G蛋白的平衡如何影響了機體的免疫平衡,而川芎嗪對于其他的G蛋白亞型又是否有影響,這些問題還有待進一步研究。