基礎胰島素聯(lián)合GLP-1受體激動劑方案治療超重肥胖T2DM的效果*
區(qū)覺璋 劉得華 朱錦匙 黃澤 柳孫艷
糖尿病(DM)是以高血糖水平為特征的代謝性疾病,其中2型糖尿病(T2DM)占90%左右[1]。T2DM主要表現(xiàn)為胰島素進行性分泌不足伴胰島素抵抗[2],長期高血糖水平會引起嚴重并發(fā)癥,對患者生命安全造成較大威脅。目前臨床用于治療T2DM的主要方式為注射胰島素控制血糖,但長期使用可能增加T2DM患者身體負擔并加重胰島素抵抗[3]。超重肥胖是T2DM的危險因素,該類患者常伴有不健康的飲食習慣,血糖控制水平較差。胰高血糖素樣肽-1(GLP-1)受體激動劑可以增加胰島β細胞增殖,進而減少胰高血糖素分泌,增加中樞飽腹感,達到降糖減重的作用[4]。基于此,本研究旨在觀察多次胰島素注射轉(zhuǎn)換為基礎胰島素聯(lián)合GLP-1受體激動劑方案治療超重肥胖T2DM的效果及對生活質(zhì)量的影響。現(xiàn)報道如下。
1 資料與方法
1.1 一般資料
選擇2019年8月-2021年8月在江門市五邑中醫(yī)院就診的80例超重肥胖T2DM患者為研究對象,按隨機數(shù)字表法分為觀察組(n=40)和對照組(n=40)。(1)納入標準:①符合T2DM的診斷標準[5];②年齡18~75歲;③配合度高,依從性好;④均為超重或肥胖人群,即體重指數(shù)(BMI)>24 kg/m2。(2)排除標準:①有 GLP-1受體激動劑和二肽基肽酶抑制劑使用史;②對本次研究使用藥物過敏;③肝腎功能不全;④不能耐受藥物的嚴重胃腸道副作用。觀察組,男22例,女18例;年齡32~72 歲,平均(51.26±8.41)歲;BMI 25~32 kg/m2,平 均(28.64±2.31)kg/m2; 病程2~10年,平均(5.62±1.73)年。對照組,男21例,女19例;年齡32~75 歲,平均(52.36±8.26) 歲;BMI 25~32 kg/m2,平均(28.96±2.44)kg/m2;病程2~10年,平均(5.36±1.68)年。兩組一般資料比較,差異均無統(tǒng)計學意義(P>0.05),具有可比性。本研究已經(jīng)醫(yī)院倫理委員會批準,患者及家屬均知情同意并簽署知情同意書。
1.2 方法
兩組研究前均采用多次胰島素注射方案,且囑患者糖尿病飲食并加強運動鍛煉。
對照組無轉(zhuǎn)換用藥,繼續(xù)胰島素多次注射方案,具體操作如下:胰島素需求量0.4~0.8 U/(kg·d),給予精蛋白鋅重組賴脯胰島素混合注射液(50R)(生產(chǎn)廠家:Lilly France,批準文號:國藥準字J20080055,規(guī)格:3 ml∶300單位)皮下注射,分2~3次餐前皮下注射。療程3個月。
觀察組轉(zhuǎn)換為基礎胰島素聯(lián)合GLP-1受體激動劑方案,具體操作如下,給予諾和達德谷胰島素(生產(chǎn)廠家:丹麥Novo Nordisk A/S,批準文號:國藥準字 J20171096,規(guī)格:3 ml∶300單位)皮下注射,0.3~0.6 U/(kg·d),1 次 /d;利拉魯肽注射液[生產(chǎn)廠家:諾和諾德(中國)制藥有限公司,批準文號:國藥準字 J20160037,規(guī)格:3 ml∶18 mg]皮下注射,初始日劑量0.6 mg,逐漸增加日劑量至1.2 mg,1次/d。療程3個月。
兩組除針劑轉(zhuǎn)換外,其他口服降糖藥物不變。
1.3 觀察指標及評價標準
比較兩組治療前后相關(guān)指標。(1)記錄BMI變化。(2)便攜血糖儀測量空腹血糖(FBG)和餐后2 h 血糖(2 h PG)水平。(3)采集兩組外周靜脈血,3 000 r/min離心 10 min后,取上層血清,用親和層析法測定糖化血紅蛋白(HbA1c)水平。(4)酶聯(lián)免疫吸附法測定兩組空腹胰島素(FINS)水平,并計算出胰島β細胞功能(HOMA-β)和胰島素抵抗指數(shù)(HOMA-IR)水平。(5)采用糖尿病患者生存質(zhì)量特異性量表(DSQL)評估兩組生活質(zhì)量,該量表共有生理(12~60分)、心理(8~40分)、治療(3~15分)和社會關(guān)系(4~20分)4個維度,得分在27~135分,分數(shù)越低生存質(zhì)量越高[6]。(6)統(tǒng)計兩組治療3個月內(nèi)不良反應發(fā)生情況。不良反應包括輕度胃腸道反應、皮膚瘙癢、低血糖、水腫。
1.4 統(tǒng)計學處理
采用SPSS 19.0軟件對所得數(shù)據(jù)進行統(tǒng)計分析,計量資料用(±s)表示,組間比較采用獨立樣本t檢驗,組內(nèi)比較采用配對t檢驗;計數(shù)資料以率(%)表示,比較采用χ2檢驗。以P<0.05為差異有統(tǒng)計學意義。
2 結(jié)果
2.1 兩組BMI和血糖相關(guān)指標比較
治療前,兩組BMI和血糖相關(guān)指標比較,差異均無統(tǒng)計學意義(P>0.05);治療3個月后,兩組FBG、2 h PG 和 HbA1c較治療前均降低(P<0.05),觀察組BMI較治療前降低(P<0.05),且觀察組BMI、HbA1c較對照組均更低(P<0.05),見表1。
表1 兩組BMI和血糖相關(guān)指標比較(±s)
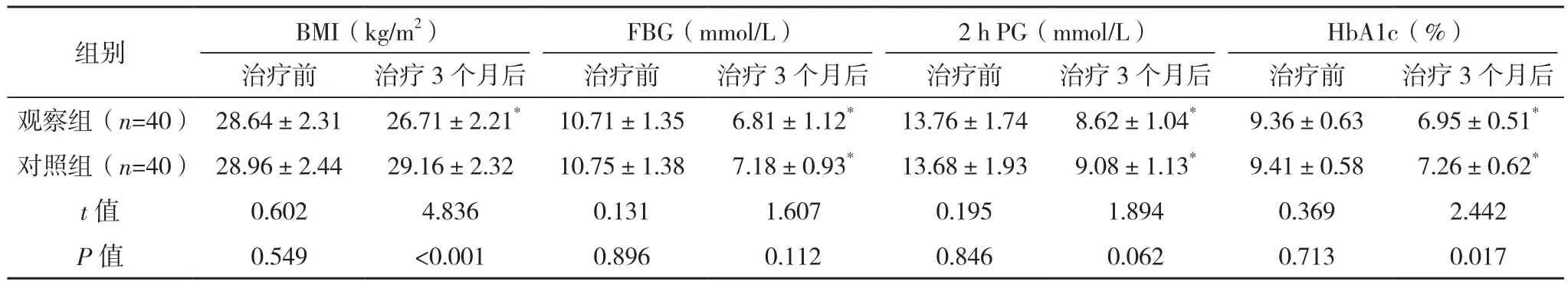
表1 兩組BMI和血糖相關(guān)指標比較(±s)
*與本組治療前相比,P<0.05。
組別 BMI(kg/m2)FBG(mmol/L)2 h PG(mmol/L)HbA1c(%)治療前 治療3個月后 治療前 治療3個月后 治療前 治療3個月后 治療前 治療3個月后觀察組(n=40) 28.64±2.31 26.71±2.21* 10.71±1.35 6.81±1.12* 13.76±1.74 8.62±1.04* 9.36±0.63 6.95±0.51*對照組(n=40) 28.96±2.44 29.16±2.32 10.75±1.38 7.18±0.93* 13.68±1.93 9.08±1.13* 9.41±0.58 7.26±0.62*t值 0.602 4.836 0.131 1.607 0.195 1.894 0.369 2.442 P值 0.549 <0.001 0.896 0.112 0.846 0.062 0.713 0.017
2.2 兩組胰島功能比較
治療前,兩組胰島功能比較,差異均無統(tǒng)計學意義(P>0.05);治療3個月后,兩組FINS和HOMA-β較治療前均升高,且觀察組較對照組均更高(P<0.05);治療3個月后,兩組HOMA-IR較治療前均降低,觀察組較對照組更低(P<0.05),見表2。
表2 兩組胰島功能比較(±s)
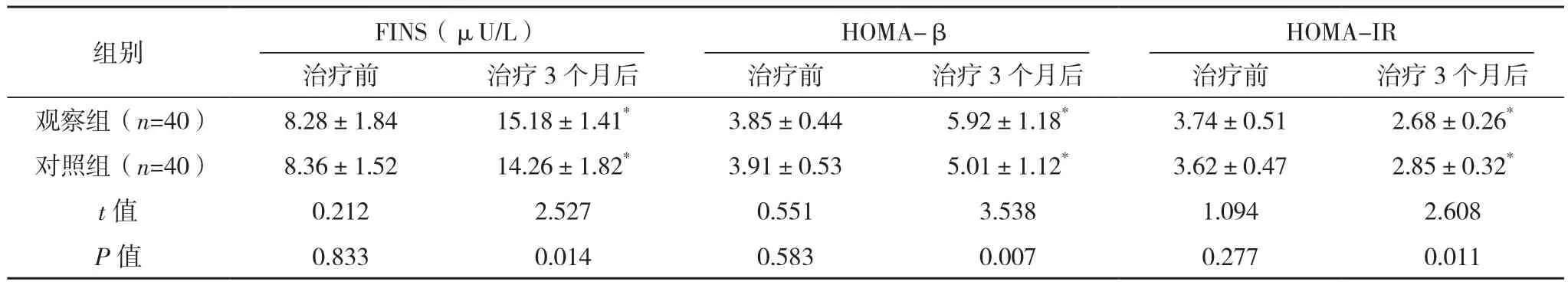
表2 兩組胰島功能比較(±s)
*與本組治療前相比,P<0.05。
組別 FINS(μU/L)HOMA-βHOMA-IR治療前 治療3個月后 治療前 治療3個月后 治療前 治療3個月后觀察組(n=40) 8.28±1.84 15.18±1.41* 3.85±0.44 5.92±1.18* 3.74±0.51 2.68±0.26*對照組(n=40) 8.36±1.52 14.26±1.82* 3.91±0.53 5.01±1.12* 3.62±0.47 2.85±0.32*t值 0.212 2.527 0.551 3.538 1.094 2.608 P值 0.833 0.014 0.583 0.007 0.277 0.011
2.3 兩組DSQL評分比較
治療前,兩組DSQL各維度評分及總分比較,差異均無統(tǒng)計學意義(P>0.05);治療3個月后,觀察組DSQL各維度評分及總分較治療前均降低(P<0.05),對照組較治療前均無明顯變化(P>0.05),且觀察組較對照組均更低(P<0.05),見表3。
表3 兩組DSQL評分比較[分,(±s)]
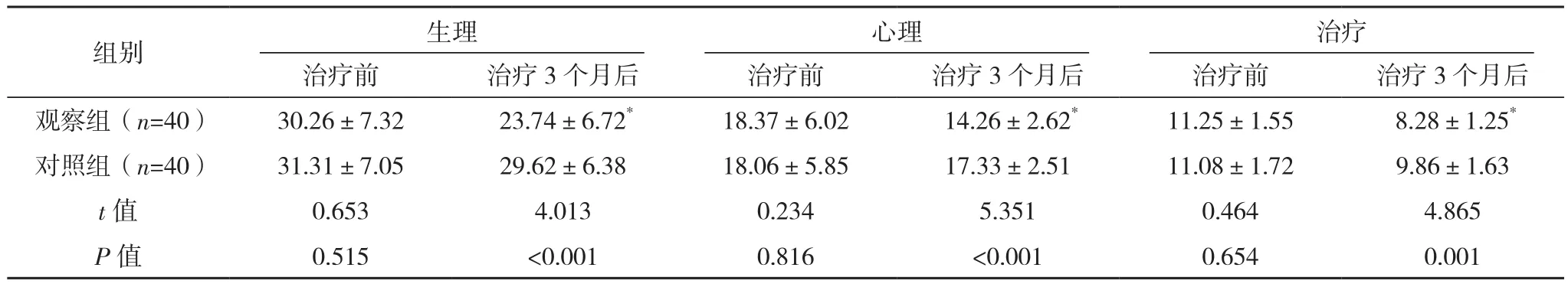
表3 兩組DSQL評分比較[分,(±s)]
組別 生理 心理 治療治療前 治療3個月后 治療前 治療3個月后 治療前 治療3個月后觀察組(n=40) 30.26±7.32 23.74±6.72* 18.37±6.02 14.26±2.62* 11.25±1.55 8.28±1.25*對照組(n=40) 31.31±7.05 29.62±6.38 18.06±5.85 17.33±2.51 11.08±1.72 9.86±1.63 t值 0.653 4.013 0.234 5.351 0.464 4.865 P值 0.515 <0.001 0.816 <0.001 0.654 0.001
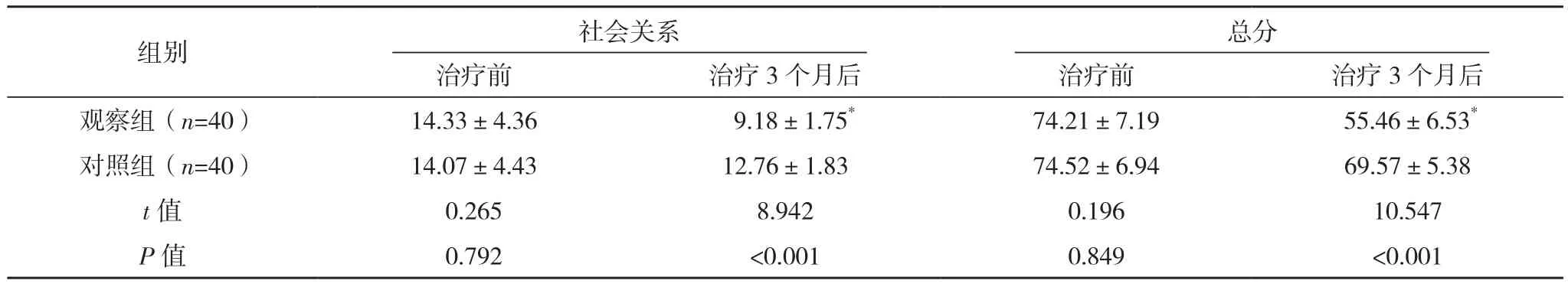
表3(續(xù))
2.4 兩組不良反應發(fā)生率比較
治療3個月內(nèi),觀察組低血糖發(fā)生率、不良反應發(fā)生率均低于對照組(P<0.05),見表4。

表4 兩組不良反應發(fā)生率比較[例(%)]
3 討論
超重肥胖T2DM患者大多伴有胰島素抵抗,進而對胰島素敏感性降低,外周血糖消耗減少,肝臟合成肝糖水平升高,最終導致血糖升高,當血糖升高至一定水平時將產(chǎn)生高糖毒性,可影響β細胞功能,進而引發(fā)高胰島素血癥[7],加重胰島素抵抗,如此惡性循環(huán),最終造成胰島功能衰竭。肥胖作為T2DM的獨立危險因素,與該疾病的發(fā)展關(guān)系密切。因此,對于超重肥胖T2DM患者,改良用藥方案以兼顧控制血糖與減輕體重雙重治療目的尤為關(guān)鍵[8]。
胰島素為控制血糖最有效的方法,但胰島素的藥理作用為促進糖原和蛋白質(zhì)合成,阻止其分解,故糖尿病患者大多伴有BMI增加。而常規(guī)多次預混胰島素注射方案作為維持胰島素治療的常見方案,雖然能控制血糖水平,但針對胰島素引起的BMI升高卻無明顯療效,因血糖波動,常需調(diào)整劑量,但患者缺乏專業(yè)知識,不恰當?shù)膭┝空{(diào)整容易引起低血糖發(fā)生。
本研究中,治療3個月后,兩組FBG、2 h PG和HbA1c較治療前均降低(P<0.05),觀察組BMI較治療前降低(P<0.05),且觀察組BMI、HbA1c較對照組均更低(P<0.05)。表明多次胰島素注射方案是否轉(zhuǎn)換為基礎胰島素聯(lián)合GLP-1受體激動劑方案對超重肥胖T2DM患者FBG、2 h PG水平控制方面無明顯差異,但能有效減輕超重肥胖T2DM患者體重。考慮與GLP-1受體激動劑的作用有關(guān),GLP-1受體激動劑可提高胰島素的敏感度,減少胰高血糖素分泌,進而發(fā)揮降糖作用;除此之外,GLP-1受體激動劑還能減少胃酸分泌,增加中樞飽腹感,從而減輕患者體重水平,藥代動力學表明,基礎胰島素聯(lián)合GLP-1受體激動劑可在降血糖的同時不影響各自的藥代動力學模式[8]。使用胰島素時可通過增加用量來加強血糖控制效果,但也會增加低血糖的發(fā)生率,還會造成體重增加,而基礎胰島素與GLP-1受體激動劑聯(lián)用具有協(xié)同互補的作用,基礎胰島素降低FBG,GLP-1受體激動劑可降低2 h PG,兩種藥物相互協(xié)同可顯著減少胰島素的用量,增加血糖控制水平,且不增加低血糖發(fā)生率[9]。同時,有研究表明,隨著T2DM患者體重指數(shù)的升高,GLP-1受體激動劑對胰島功能的改善作用越明顯[10]。
胰島素可平穩(wěn)快速控制血糖水平,逆轉(zhuǎn)高糖毒性[11],進而對胰島細胞功能的損害減輕,有助于延緩胰島功能退化進程。本研究中,治療3個月后,兩組FINS和HOMA-β較治療前均升高,且觀察組較對照組均更高(P<0.05);治療3個月后,兩組HOMA-IR較治療前均降低,觀察組較對照組更低(P<0.05)。表明多次胰島素注射轉(zhuǎn)換為基礎胰島素聯(lián)合GLP-1受體激動劑方案可顯著改善超重肥胖T2DM患者胰島功能。分析原因為基礎胰島素可以延緩胰島功能退化進程,加之GLP-1受體激動劑可保護β細胞功能,增加胰島素的分泌,增強胰島素敏感性,從而更有利于胰島功能的改善[12]。
本研究還發(fā)現(xiàn),治療3個月后,觀察組DSQL各維度評分及總分較治療前均降低(P<0.05),對照組較治療前均無明顯變化(P>0.05),且觀察組較對照組均更低(P<0.05)。表明多次胰島素注射轉(zhuǎn)換為基礎胰島素聯(lián)合GLP-1受體激動劑方案可明顯提高超重肥胖T2DM患者的生活質(zhì)量,考慮是因為多次胰島素注射方案需要每天用藥2~3次,且需要在餐前用藥,而基礎胰島素聯(lián)合GLP-1受體激動劑方案每天只需用藥1次,且不受進食時間影響,簡化用藥方案的同時,能顯著減輕患者體重,進而降低血糖控制不良和心血管不良事件的發(fā)生風險,故有利于提升患者生活質(zhì)量。
本研究中,治療3個月內(nèi),觀察組低血糖發(fā)生率、不良反應發(fā)生率較對照組均更低(P<0.05)。表明基礎胰島素聯(lián)合GLP-1受體激動劑方案治療超重肥胖T2DM患者可顯著降低低血糖不良反應發(fā)生率,可能是因為GLP-1受體激動劑可增加胰島素的敏感度,減少胰高血糖素分泌,屬于葡萄糖依賴性降糖,故能有效避免低血糖出現(xiàn)。除此之外,有學者提出,預混胰島素與三餐餐時聯(lián)合長效胰島素治療方案在控制血糖方面具有同等療效[13]。因此,對于目前使用預混胰島素類似物多次注射方案或者基礎胰島素聯(lián)合餐時胰島素多次注射方案的超重肥胖T2DM患者,可優(yōu)先考慮基礎胰島素聯(lián)合GLP-1受體激動劑方案。
綜上所述,基礎胰島素聯(lián)合GLP-1受體激動劑方案治療超重肥胖T2DM患者在保證其降糖作用的同時還能顯著降低BMI,改善胰島功能,提高其生活質(zhì)量,減少低血糖不良反應發(fā)生風險。

