守恒思想在初中化學解題中的應用
王慶越
(山東省鄒平市韓店鎮新世紀中學 256209)
1 守恒思想在初中化學解題中的應用模式
1.1 根據化學反應前后物質質量不變,開展相關的求解
根據化學反應的質量守恒定律,參加化學反應的各物質總質量和反應后生成的物質總質量是相同的,這也就意味著,反應前后的物質質量是不變的,處于質量守恒的定律中.例如,白磷和氧氣在完全反應中會生成一定質量的五氧化二磷.只要該化學反應恰好完全反應,反應前后的物質質量是完全不變的,反應前后的氧原子、磷原子的總數、質量也是不變,只是在化學反應中分子會發生破裂,分子的總數會發生變化.所以,在遇到相關的求解問題時,學生就可以根據化學反應前后物質質量不變,開展相關的求解.以氯酸鉀和二氧化錳混合制氧氣為例,已知反應后的固體物體質量,結合反應前的固體質量,學生就可以通過分析化學方程式,得出最后制得氧氣的質量.這個案例運用的化學方法同樣是化學反應前后物質質量不變,也就是守恒定律在化學反應中的應用.這類題型在初中化學教學中非常常見,應用的范圍也非常廣泛.學生如果對守恒思想不了解,在化學計算中不能很好地應用守恒思想,就會帶來一系列的問題,甚至會影響到化學解題的步驟或者思路.所以這也就需要相關的化學教師在開展日常的實驗中,將守恒思想貫穿到實驗過程中,讓學生對守恒思想有更加深入的了解,從而應用到實際的問題解決中.
1.2 根據反應前后某元素的質量不變,開展相關的解題實驗
根據質量守恒定律可以了解到,同一種元素在化學反應前后的質量是不會發生變化的.這也就意味著,無論是反應前還是反應后,元素的總質量是一定的.例如,將4 g的金屬樣品投入到100 g溶質質量分數為9.8%的稀硫酸中,在完全反應后,形成了一定的硫酸鹽,而該硫酸鹽中含硫、氧兩種元素的質量分數為80%,要求學生判斷出該金屬的質量分數.拿到這樣一個例題,不少學生會陷入到迷茫之中,這道題目中并沒有具體的給出該金屬的質量分數以及一些比率,所以如果學生直接從理論上計算,是很難得到真正的結果,即使通過理論驗證,過程上也非常復雜.這時,教師就可以帶領學生換另一種思路,題目中已經提到了“完全反應”,也就是說,根據質量守恒因素,同一元素在反應前后的質量是不變的,所以無論是硫元素還是氧元素,反應前后的質量處于恒定中.所以根據這樣一個質量等式,再依據題目中提到的硫酸鹽中含硫、氧兩種元素的質量分數為80%,可以輕松地計算出最后的質量,而最后依據反應的結果,可以計算出金屬的質量,最后得出金屬的質量分數.通過化學質量守恒定律,將原本較為復雜的一個求解方程式,變得更加輕松、簡單,也通過這種方式給題目找到了一個全新的突破口,在整體上使解題過程變得更加清晰,也減輕了學生的學習負擔.這類題目在初中化學中非常常見,尤其是當出現一些較為復雜的元素時,學生一時間很難找到突破口,就完全可以通過元素反應前后質量守恒的定律,開展相關的解題實驗.
1.3 根據化學反應前后原子的數目和種類守恒,開展相關的解題
根據對初中化學相關題型的了解,往往在一道簡單的化學題目中,會出現各種各樣復雜的元素,有的元素對解題有幫助,有的元素卻只是用來干擾學生的解題視線.遇到這種情況時,學生就可以抓住守恒定律,根據化學反應前后原子的數目和種類守恒的要求,應用到化學解題中.例如,一氧化碳是一種有毒的大氣污染源,不管是對環境還是人體都產生了極大的危害.而在化學中,為了檢測大氣中一氧化碳的含量和濃度,可以利用五氧化二碘進行檢測.而在這個檢測的過程中也發生了劇烈的化學反應,反應的化學方程式為:

題目給出了相關的條件,并要求學生根據反應的情況,判斷出A的具體化學式.這類問題看似非常荒誕,學生也摸不著頭腦,事實上,卻很好的體現了化學反應前后原子數目質量守恒的定律.也就是說,在化學反應前后,無論是氧原子、碳原子還是其他的元素,反應前后是不會忽然消失或質量上出現變化的.也就是說,“I2O5+5CO”出現的原子總數和“I2+5A”的原子總數目是完全一致的.根據這樣的要求和特點,學生就可以輕松地求出A的具體化學式.在整個過程中既不需要復雜的化學計算,也不需要進行嚴格的思考,只是需要將守恒定律應用到解題中.
1.4 在電荷守恒、化合價守恒以及溶質質量守恒中的突出應用
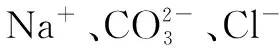
對于化合價守恒來說,對同一個化學物質來說,要想使結構處于一種平衡狀態,化學物質元素的正負化合價需要達到一種平衡,也就是說,無論是正化合價還是負化合價,他們的絕對值都是平衡的.在九年級的化學學習中,學生并不需要深入了解化合價的一些重難點,只需要簡單的判斷一些化合物的化合價,對此有一個簡單的認識即可.所以此類問題的解決方法也非常簡單,直接依據不同物質的正負化合價,得出化學物質正確的化學方程式即可.而這類題目也多數以判斷題、填空題的方式出現,比如說要求學生依據化合價,寫出氧化鋁的化學式.學生除了進行日常的背誦,也可以依據正負化合價為零的方式,根據鋁的元素+3價,氧的元素-2價,來判斷出氧化鋁的化學式.
在九年級下學期的化學實驗中,學生已經需要接觸到相關的化學溶液實驗,就需要完成相關的問題,尤其是在初中化學的溶液實驗題.溶液在化學反應的過程中,雖然會通過加水稀釋,或者會有一定的蒸發產生結晶的過程,但在整體上,無論溶液的質量發生怎樣的變化,溶質都不會發生變化.這也就是溶液中常用的溶質守恒定律.尤其是在九年級的相關化學作業中,這類題型的出現頻率非常高,而且大多數是以應用題的模式.例如,在20℃時,100 g的某溶液質量分數是10%,這時如果需要提高溶液的質量分數,從10%上升到20%,就必須要對水分進行蒸發.那么對于這類溶液來說,應該蒸發掉多少克的水呢?這類題目看似非常復雜,甚至需要進行復雜的計算.如果學生利用溶質反應前后質量守恒定律,溶質在反應前后的質量并沒有發生變化,依據這樣的等量關系,就可以直接得出最終的水質量.同樣在有關于加水稀釋的相關題目中,質量守恒定律也非常好運用.這就是相關的化學守恒定律問題,無論是在化學填空題還是簡答題,應用的范圍都非常廣,也需要化學教師在日常的教學中有意識地滲透,幫助學生培養將守恒定律運用到化學解題中的意識,從而提高學生化學學習的效率,更好地完成相關的學習.
2 學生在學習和應用質量守恒中應該注意的相關問題
守恒思想雖然在初中化學的應用性非常廣,但同樣也有一定的應用范圍,需要學生在學習和應用的過程中注意.
2.1 理解好化學守恒的適用范圍和思想
化學守恒思想雖然應用的范圍比較廣,但同樣有一定的適用條件,不能隨意應用到所有的化學題目中.初中學生在接受相關的思想后,往往會帶來一種混亂感,題目尚未審清就直接將守恒定律運用到了解題中.但學生卻不能將這理解為分子數守恒,或者說是體積守恒,也不能胡亂應用到相關的題目中,最后帶來了一系列的解決問題.
2.2 具體了解反應前后的物質變化,注意相關的前提
對反應前后物質質量的總和要進行深入理解,不能遇到質量問題就直接應用質量守恒進行解答,必須要注意相關的前提,也就是是否進行了完全的反應.比如說氫氣和氧氣進行化學反應,但并沒有進行完全反應,如果學生在解答此類問題時仍然按照質量守恒定律,就會帶來一定的失誤,反應后生成的物質數目也會因此變多,出現問題.
2.3 注意化學反應中可能會有氣體逸出
在有些特殊的初中化學題目中,化學反應后不僅會帶來物質的生成,同樣也會生成一定的氣體.但這個氣體一旦逸出到大氣環境中,具體的質量就很難得到估算,如果此時學生忽視了氣體的重量,仍然按照固體的方式開展相關的質量守恒計算,就會發生錯誤.這就要求學生不能只根據簡單的質量數進行加減,必須要對反應的化學方程式進行分析,確保沒有特殊情況后,在開展相關的氣體計算問題.
2.4 守恒變化是自然界一切化學變化遵循的定律,與其他變化無關
雖然說在相關的物理變化面前,物質的質量同樣是守恒的,但這并不意味著物理變化也遵循質量守恒定律.學生在應用守恒定律前必須要明白,守恒變化是自然界一切化學變化都應該要遵循的定律,但與其他變化無關.在相關的化學實驗中,除了會出現一些化學變化,也同樣會出現一些物理變化,這就需要學生進行系統的分析,做出正確的判斷方式.
守恒思想在初中化學的學習過程中發揮了非常重要的作用,尤其是在化學的解題過程中.化學教師必須要大力培養學生的思維能力,幫助學生將守恒思想運用到日常的化學學習過程中,提高解題的效率.在利用守恒思想解決相關的難題時,學生也必須要了解到不同守恒思想的應用范圍,了解好每個思想的使用特點,真正理解每個思想背后的含義.

