不同密度海藻酸鈣復合微球的制備及其對Cu(Ⅱ)吸附行為的研究
詹李明,李建華,黃雅雯,藍森美,馮芳芳,陳作義,柳曉俊,趙丹華
(廣東第二師范學院化學與材料科學學院,廣東 廣州 510303)
由于工農業經濟的快速發展,重金屬工業廢水排放量越來越多,嚴重污染水體和土壤環境,對人體健康造成極大威脅[1-2]。由于重金屬穩定性強、收集難、毒性大,研發有效的重金屬廢水處理工藝已成為保障水體安全的當務之急。在重金屬廢水處理工藝中,吸附法[3]因操作簡便、效果顯著、成本低等優點備受關注。常見的吸附劑有活性炭[4]、膨潤土[5]、殼聚糖[6]和海藻酸鈉[7]等。乙二胺四乙酸二鈉(EDTA-2Na)是一種具有六配位原子的良好絡合劑,可與多種金屬離子結合形成穩定絡合物[8],若將其引入吸附材料中,可提高吸附效率。
作者通過調控EDTA-2Na與CaCO3、海藻酸鈉與EDTA-2Na/CaCO3的配比,采用原位化學交聯法制備毫米級海藻酸鈣復合微球,然后經酸化處理制備具有不同密度的三維多孔海藻酸鈣復合微球:漂浮型海藻酸鈣微球(FCAM)、沉浸型海藻酸鈣微球(ICAM),通過掃描電鏡和紅外光譜對其形貌和結構進行分析;并將復合微球FCAM、ICAM用于含Cu(Ⅱ)廢水的吸附,考察復合微球投加量、Cu(Ⅱ)初始濃度、吸附時間、體系pH值等對吸附效果的影響,探究吸附動力學及吸附熱力學。
1 實驗
1.1 試劑與儀器
海藻酸鈉、乙二胺四乙酸二鈉(EDTA-2Na)、鹽酸,天津大茂化學試劑廠;碳酸鈉、氯化銅,天津福晨化學試劑廠;氯化鈉、氫氧化鈉,廣州化學試劑廠;氯化鈣,上海潤捷化學試劑有限公司。所有試劑均為分析純。
S-4800型掃描電鏡,日本日立公司;TENSOR-37型紅外光譜儀,美國Bruker公司;TAS-990型原子吸收分光光度計,北京普析通用儀器有限責任公司;84-1A型同步轉速數顯磁力攪拌器,上海司樂儀器有限公司;DHG-905型電熱恒溫鼓風干燥箱,上海浦東榮豐科學儀器有限公司。
1.2 不同密度海藻酸鈣復合微球的制備
將2.5%海藻酸鈉溶液與EDTA-2Na/CaCO3(EDTA-2Na與CaCO3物質的量比分別為1∶2.5、1∶1)溶液按一定比例混合,于300 r·min-1磁力攪拌10 min,得混合凝膠溶液;取混合凝膠溶液3.5 mL滴入2%氯化鈣溶液中,靜置固化60 min,得海藻酸鈣復合微球;用去離子水洗滌海藻酸鈣微球3次,置于0.1 mol·L-1鹽酸中酸化一段時間,取出,洗滌至中性,即得不同密度海藻酸鈣復合微球FCAM、ICAM。
1.3 不同密度海藻酸鈣復合微球對Cu(Ⅱ)的吸附實驗
在50 mL錐形瓶中加入一定濃度含Cu(Ⅱ)廢水、復合微球FCAM或ICAM,室溫(25 ℃)下靜置吸附一定時間,待吸附平衡后測定Cu(Ⅱ)濃度,按式(1)計算平衡吸附量(qe,mg·g-1):
(1)
式中:c0、ce分別為Cu(Ⅱ)的初始濃度及吸附平衡濃度,mg·L-1;V為廢水體積,L;m為復合微球投加量,g。
通過單因素實驗考察復合微球投加量、Cu(Ⅱ)初始濃度、吸附時間、體系pH值等對吸附效果的影響,并對吸附行為進行動力學及熱力學分析。
2 結果與討論
2.1 復合微球的形貌和結構分析
2.1.1 SEM表征(圖1)
由圖1可知,復合微球FCAM、ICAM均呈蜂窩狀且具有疏松多孔的結構,其原因是酸化過程中,H+滲入微球內部與其中的碳酸鈣反應釋放出二氧化碳,從而產生了大量三維多孔的結構,不僅增大了復合微球的比表面積,而且也提供了大量的傳質通道,利于復合微球對Cu(Ⅱ)的吸附;與復合微球ICAM相比,復合微球FCAM的微孔多而密集,其原因是在制備過程中,復合微球FCAM的碳酸鈣含量較高,酸化處理時釋放出較多的二氧化碳所致。

圖1 復合微球FCAM(a、b)、ICAM(c、d)的SEM照片 Fig.1 SEM images of composite microspheres FCAM(a,b)and ICAM(c,d)
2.1.2 FTIR表征(圖2)

圖2 復合微球吸附前后的FTIR圖譜Fig.2 FTIR spectra of composite microspheres before and after adsorption
由圖2可知,吸附前,3 423 cm-1處寬峰歸屬于分子中游離的-OH,表明大量-OH存在于復合微球表面;2 924 cm-1處吸收峰由EDTA-2Na、海藻酸鈉中-CH2的C-H伸縮振動產生;2 528 cm-1處吸收峰由EDTA-2Na中-COOH和-OH的伸縮振動產生;1 733 cm-1、1 425 cm-1處吸收峰分別由-COOH中C=O、C-O的伸縮振動產生,表明復合微球表面存在大量-COOH[9],可以提供大量的吸附位點,利于復合微球吸附更多的Cu(Ⅱ);1 612 cm-1處尖峰由EDTA-2Na中N-H的面內彎曲產生;1 262 cm-1處吸收峰由海藻酸鈉中苯羥基的C-O伸縮振動產生;1 029 cm-1處尖峰由EDTA-2Na中C-N的伸縮振動產生[9];813 cm-1處吸收峰由C-H的面外彎曲產生。吸附后,3 423 cm-1處的-OH吸收峰消失,于3 680 cm-1和3 163 cm-1處出現2個新的吸收峰;其它吸收峰強度明顯減弱,可能是復合微球中活性基團-COOH、-OH、-NH2與Cu(Ⅱ)發生了絡合作用所致,但主要官能團并未發生變化。
2.2 吸附效果影響因素分析
2.2.1 復合微球投加量對吸附效果的影響
在室溫、Cu(Ⅱ)初始濃度為100 mg·L-1、吸附時間為300 min、體系pH值為4.7的條件下,考察復合微球投加量對吸附效果的影響,結果如圖3所示。
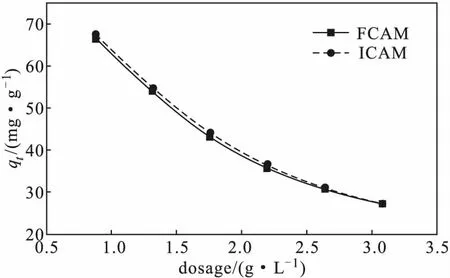
圖3 復合微球投加量對吸附效果的影響Fig.3 Effect of dosage of composite microspheres on adsorption
由圖3可知,復合微球FCAM、ICAM對Cu(Ⅱ)的吸附量均隨其投加量的增加逐漸降低。其原因可能是隨著復合微球投加量的增加,廢水中大部分Cu(Ⅱ)被復合微球吸附,且存在Cu(Ⅱ)的吸附-解吸過程,致使復合微球中較多的活性吸附位點變得無效,故吸附量逐漸降低。
2.2.2 Cu(Ⅱ)初始濃度對吸附效果的影響
在室溫、復合微球投加量為1.76 g·L-1、吸附時間為300 min、體系pH值為4.7的條件下,考察Cu(Ⅱ)初始濃度對吸附效果的影響,結果如圖4所示。
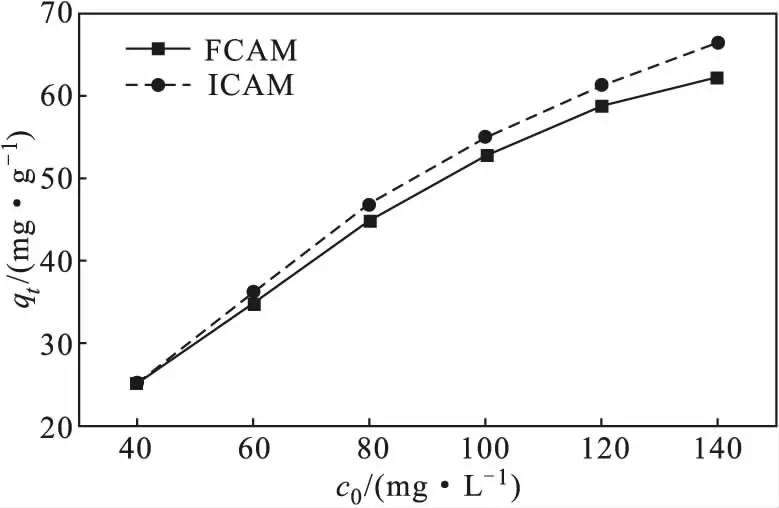
圖4 Cu(Ⅱ)初始濃度對吸附效果的影響Fig.4 Effect of initial concentration of Cu(Ⅱ) on adsorption
由圖4可知,復合微球FCAM、ICAM對Cu(Ⅱ)的吸附量均隨Cu(Ⅱ)初始濃度的升高逐漸升高。當Cu(Ⅱ)初始濃度較高時,存在較大的傳質推動力,促進了Cu(Ⅱ)與復合微球之間的靜電及非靜電吸附作用,使得兩者接觸幾率增加,復合微球表面的活性吸附位點被充分利用,能夠吸附更多的Cu(Ⅱ)[10-11]。
2.2.3 吸附時間對吸附效果的影響
在室溫、復合微球投加量為1.32 g·L-1、Cu(Ⅱ)初始濃度為90 mg·L-1、體系pH值為4.7的條件下,考察吸附時間對吸附效果的影響,結果如圖5所示。
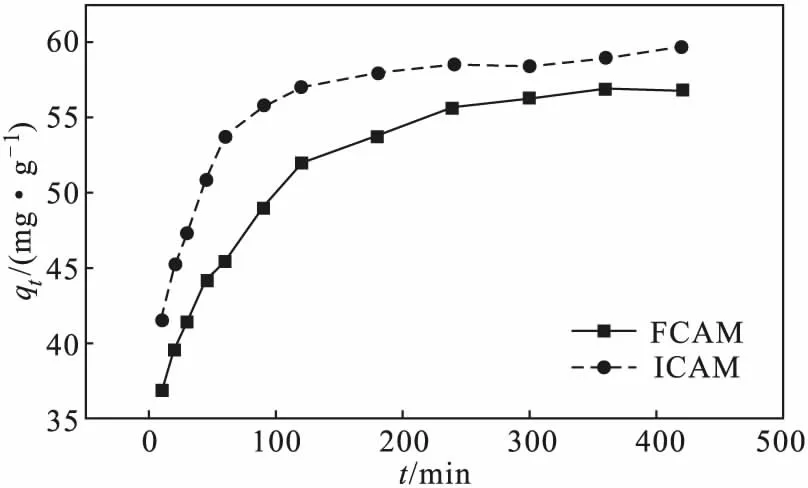
圖5 吸附時間對吸附效果的影響Fig.5 Effect of adsorption time on adsorption
由圖5可知,復合微球FCAM、ICAM對Cu(Ⅱ)的吸附過程均可分為快速、慢速、動態平衡3個階段。0~100 min處于快速吸附階段,此時曲線斜率較大,這是由于吸附開始時復合微球表面存在大量的活性吸附位點,復合微球與溶液間存在較大的濃度差,固液間傳質推動力大[12-14],吸附速率較快;100~300 min處于慢速吸附階段,吸附量變化較小,其主要原因是復合微球表面活性吸附位點減少,復合微球與溶液間存在靜電斥力,不利于進一步吸附;300 min后,吸附處于動態平衡階段,復合微球表面活性吸附位點逐漸達到飽和,吸附量變化不明顯。故復合微球對Cu(Ⅱ)的吸附平衡時間為300 min。另,復合微球ICAM的初始吸附量較FCAM的高,是因為復合微球ICAM沉浸在底部,由于重力作用,溶液傳質速率較快,故吸附速率較快。
2.2.4 體系pH值對吸附效果的影響
文獻[15]報道,當pH>5時,Cu(Ⅱ)會發生水解。因此,本實驗在室溫、復合微球投加量為1.32 g·L-1、Cu(Ⅱ)初始濃度為90 mg·L-1、吸附時間為300 min的條件下,考察體系pH值在1~5范圍內對吸附效果的影響,結果如圖6所示。
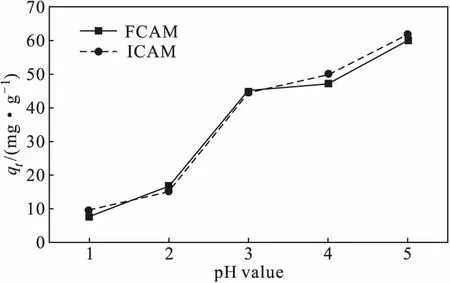
圖6 體系pH值對吸附效果的影響Fig.6 Effect of pH value of system on adsorption
由圖6可知,復合微球FCAM、ICAM對Cu(Ⅱ)的吸附量均隨著體系pH值的增大逐漸升高,在pH值為5時達到最高,其中,復合微球ICAM對Cu(Ⅱ)的吸附量達到61.84 mg·g-1。其原因可能是:H+與Cu(Ⅱ)存在競爭吸附,在強酸性條件下,體系中H+濃度較大,導致復合微球表面的有效負電荷較少,對Cu(Ⅱ)的吸附量相應較低;隨著體系pH值的增大,復合微球表面的活性吸附位點脫質子化,對Cu(Ⅱ)的靜電吸附相應增強,吸附量相應升高[16]。
2.3 復合微球的吸附動力學研究
吸附動力學[17-19]主要研究吸附速率隨時間的變化規律和各種因素對吸附過程的影響,不僅可以計算吸附速率,還能推測吸附機理。將數據分別進行準一級動力學方程、準二級動力學方程和顆粒內擴散方程擬合,以探究復合微球對Cu(Ⅱ)的吸附原理及吸附類型。其公式如下:
準一級動力學方程:ln(qe-qt)=lnqe-K1t
(2)
(3)
顆粒內擴散方程:qt=Kidt0.5+C
(4)
式中:qe為平衡吸附量,mg·g-1;qt為t時刻的吸附量,mg·g-1;t為吸附時間,min;K1為準一級動力學常數,min-1;K2為準二級動力學常數,g·mg-1·min-1;Kid是顆粒內擴散系數,mg·g-1·min-0.5;C為與反應邊界層有關的常數,mg·g-1。
分別用準一級動力學方程、準二級動力學方程和顆粒內擴散方程對復合微球吸附Cu(Ⅱ)的動力學數據進行擬合,得到各方程相關參數(表1)。

表1 復合微球吸附Cu(Ⅱ)的動力學參數
由表1可知,準二級動力學方程對復合微球FCAM、ICAM吸附Cu(Ⅱ)過程的擬合程度更高,計算得到的平衡吸附量與實驗數據更接近。表明復合微球FCAM、ICAM對Cu(Ⅱ)的吸附主要是化學吸附。
在室溫、復合微球投加量為1.32 g·L-1、Cu(Ⅱ)初始濃度為90 mg·L-1、吸附時間為300 min、體系pH值為5的條件下,復合微球對Cu(Ⅱ)吸附過程的顆粒內擴散曲線如圖7所示。
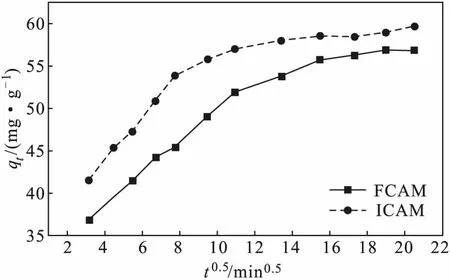
圖7 復合微球對Cu(Ⅱ)吸附過程的顆粒內擴散曲線 Fig.7 Intraparticle diffusion curves for adsorption process of Cu(Ⅱ) by composite microspheres
由圖7可知,qt-t0.5曲線兩頭彎曲、中間直線且不經過原點,呈現多段線性,表明顆粒內擴散是復合微球FCAM、ICAM吸附Cu(Ⅱ)過程的限速步驟,由于擬合度不高,說明不是唯一的限速步驟。故復合微球FCAM、ICAM對Cu(Ⅱ)的吸附過程可分為2個階段:(1)由于復合微球表面具有大量活性吸附位點,位點與分子之間產生物理吸附作用,表現為吸附速率較快的表面吸附階段;(2)隨著活性吸附位點被占據,Cu(Ⅱ)進入復合微球FCAM、ICAM的孔隙,表現為吸附速率較慢的孔道內擴散階段,受顆粒內擴散和化學作用所控制。
2.4 動邊界模型
動邊界模型可用于描述多孔材料的吸附行為,以研究固-液體系的吸附限速步驟,一般認為吸附過程包括3個步驟:液膜擴散(吸附質在吸附劑表面擴散)、顆粒內擴散(吸附質在吸附劑內部擴散)、化學反應(吸附質通過化學反應與吸附劑結合)[20]。其線性表達式分別為:
液膜擴散:-ln(1-F)=kt
(5)
(6)
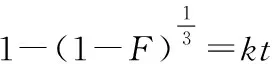
(7)
式中:F為離子交換度,F=qt/qe;k為速率常數。
復合微球FCAM、ICAM吸附Cu(Ⅱ)過程的動邊界模型限速步驟參數見表2。
由表2可知,復合微球FCAM、ICAM吸附Cu(Ⅱ)過程中,液膜擴散步驟-ln(1-F)與t擬合程度最佳,R2分別為0.990 4和0.992 9;顆粒內擴散和化學反應步驟的速率常數相對較小,分別為0.003 51、0.004 90、0.002 42、0.003 40。故吸附過程的主要限速步驟為顆粒內擴散和化學反應。其原因可能為Cu(Ⅱ)與FCAM、ICAM表面的活性基團(如-OH、-COOH等)產生范德華力及靜電作用力,快速擴散到FCAM、ICAM的表面;隨后由于濃差作用,穿透FCAM、ICAM表面大小不一的多孔結構,在內部進行擴散,與FCAM、ICAM形成絡合作用力和其它物理作用力,最終達到吸附平衡。
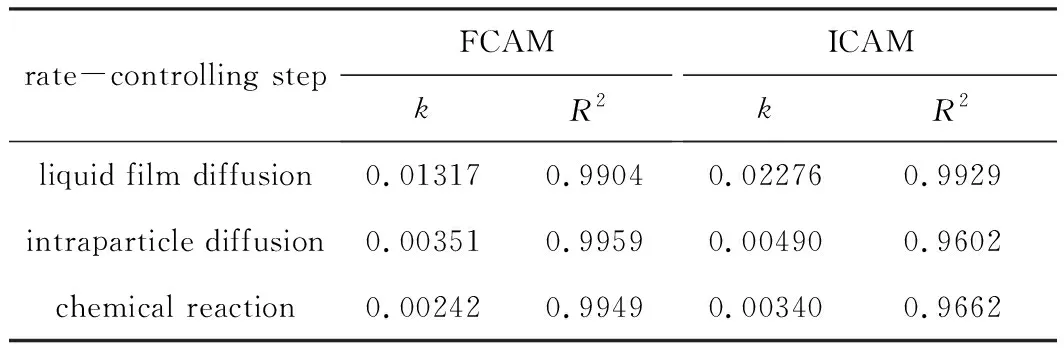
表2 動邊界模型限速步驟參數
2.5 復合微球的吸附熱力學研究
2.5.1 等溫吸附模型擬合
數學模型可以很好地反映溶液中吸附量與殘留濃度之間的關系,Langmuir、Freundlich兩種等溫吸附方程被廣泛用于吸附熱力學研究,根據擬合數據的相關度,可以得到吸附質與吸附劑之間的吸附類型。其公式如下[20-21]:
(8)
(9)
式中:ce為吸附平衡濃度,mg·L-1;qe為平衡吸附量,mg·g-1;qm為最大吸附量,mg·g-1;KL為Langmuir常數,L·mg-1;KF為Freundlich常數,mg·g-1;n為Freundlich常數。
分別用Langmuir等溫吸附方程、Freundlich等溫吸附方程對復合微球吸附Cu(Ⅱ)過程數據進行回歸分析,結果見表3。
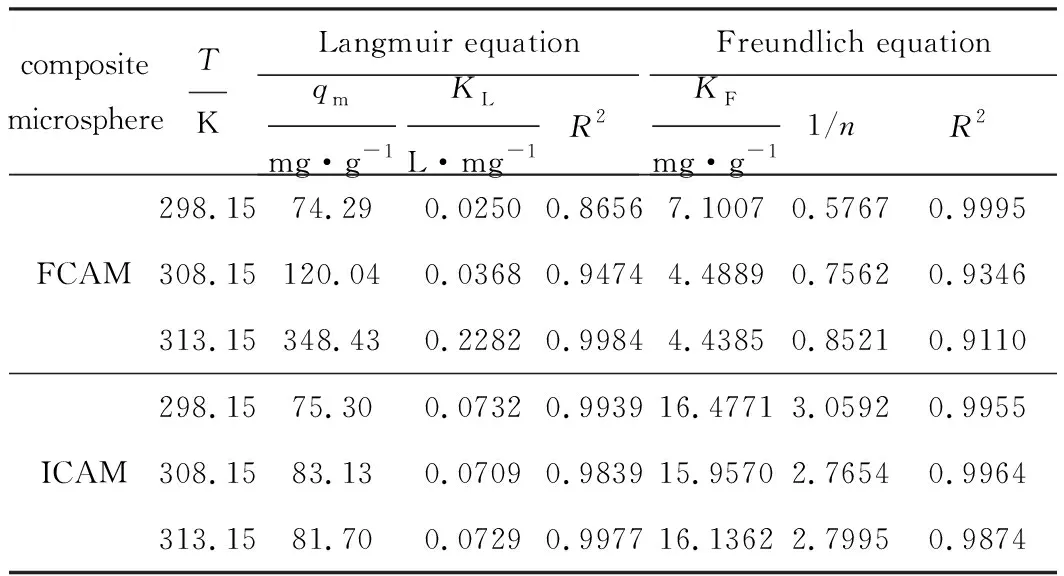
表3 復合微球吸附Cu(Ⅱ)的等溫吸附方程參數
由表3可知,在298.15~313.15 K范圍內,復合微球FCAM、ICAM對Cu(Ⅱ)的吸附更符合Freundlich等溫吸附方程,表明復合微球FCAM、ICAM與Cu(Ⅱ)的結合方式更傾向于多層吸附[22];復合微球FCAM、ICAM對Cu(Ⅱ)的吸附量整體隨溫度的升高逐漸升高,說明溫度越高越有利于吸附,吸附過程為吸熱的化學吸附過程;復合微球FCAM對Cu(Ⅱ)的吸附量受溫度影響更大,可能是因為復合微球FCAM吸附Cu(Ⅱ)的過程受重力影響較大,而溫度升高使分子運動加快,更有利于吸附更多的Cu(Ⅱ)。
2.5.2 吸附熱力學參數
根據Van′t Hoff方程對吸附實驗結果進行熱力學分析,計算吸附過程的吉布斯自由能變ΔG、焓變ΔH,以確定吸附過程的熱效應和可行性。其公式如下[23]:
(10)
ΔG=-RTlnK
(11)
ΔG=ΔH-TΔS
(12)
式中:K為吸附平衡常數,L·g-1;qe為平衡吸附量,mg·g-1;c0和ce分別為Cu(Ⅱ)的初始濃度和吸附平衡濃度,mg·L-1;V為溶液體積,L;m為吸附劑投加量,g;T為熱力學溫度,K。
復合微球FCAM、ICAM吸附Cu(Ⅱ)過程的熱力學參數見表4。
由表4可知:(1)ΔG<0且數值隨溫度升高趨于更負,說明復合微球FCAM、ICAM對Cu(Ⅱ)的吸附過程可自發進行,側面反映升高溫度有利于吸附,吸附作用主要是固液兩相濃度差所致的傳質推動力以及EDTA-2Na與Cu(Ⅱ)的絡合作用,屬于物理化學吸附;
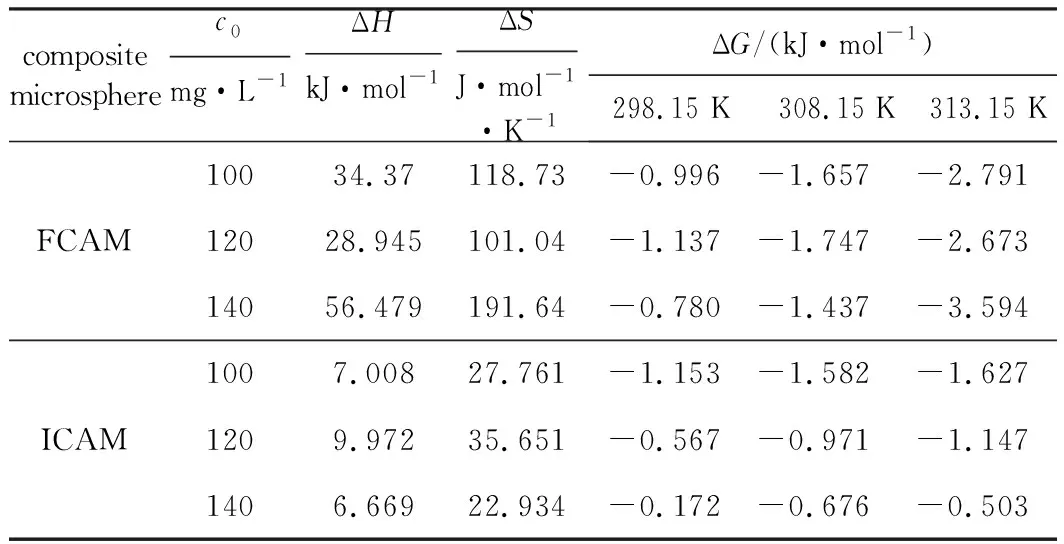
表4 復合微球吸附Cu(Ⅱ)的熱力學參數
(2)ΔH>0,說明吸附過程吸熱,與Freundlich等溫吸附方程的擬合結果一致;(3)ΔS>0,說明吸附過程是熵增過程,Cu(Ⅱ)在吸附劑表面逐漸呈無序狀態。
3 結論
以EDTA-2Na/CaCO3、海藻酸鈉為原料,以氯化鈣為固化劑,調控EDTA-2Na與CaCO3、海藻酸鈉與EDTA-2Na/CaCO3的配比,采用原位化學交聯法制備了不同密度的海藻酸鈣復合微球FCAM、ICAM。該復合微球制備工藝簡單,成本低。室溫下,在復合微球投加量為1.32 g·L-1、Cu(Ⅱ)初始濃度為90 mg·L-1、吸附時間為300 min、體系pH值為5時, 復合微球ICAM對Cu(Ⅱ)的吸附量為61.84 mg·g-1。該復合微球對Cu(Ⅱ)的吸附過程符合準二級動力學方程,符合Freundlich等溫吸附方程,吸附可自發進行。該復合微球在工業廢水處理領域具有廣闊的市場發展前景。

