超聲-微酸性電解水聯合處理對腐敗希瓦氏菌的作用機制
藍蔚青,趙欣宇,周大鵬,莫雅嫻,王彥波,馮豪杰,謝 晶,*
(1.上海海洋大學食品學院,上海 201306;2.上海水產品加工及貯藏工程技術研究中心,上海 201306;3.浙江工商大學食品與生物工程學院,浙江 杭州 310018)
我國是世界漁業大國,相關統計顯示,2020年水產品產量為6 549.02萬 t,比上年增長1.06%。其中,養殖水產品產量達5 224.20萬 t,增長了2.86%。然而,水產品在產量逐年遞增的同時,由于其營養豐富、含水量高,微生物極易在流通期間大量繁殖,使其發生腐敗,目前腐損率在15%左右。現有研究發現,水產品的腐敗菌主要有希瓦氏菌、假單胞菌、不動桿菌、氣單胞菌等,而腐敗希瓦氏菌是導致水產品腐敗的主導者之一。因此,只有通過適當的處理方式抑制水產品中優勢腐敗菌的生長繁殖,才能進一步降低其流通腐損率。
超聲(ultrasonic,US)是超出人類聽力范圍的機械波,已被廣泛應用于食品殺菌、加速肉類腌制與嫩化、延長肉制品貨架期、某些活性物質的輔助提取等方面。其中,Antunes-Rohling等研究得出,US(2.9 W/kg)解凍可明顯提升鱈魚魚片的解凍品質;Pedrós-Garrido等研究發現高強度US(30 kHz、51.41 W/L)處理45 min可顯著降低三文魚、鯖魚、鱈魚和無須鱈魚片微生物數,改善其質量。US在液體介質中傳播時,能在液體中形成微小氣泡(即空化泡),產生空化效應,該效應被認為是超聲波滅菌的主要效應。US技術作為一種非熱殺菌技術被應用在食品加工過程中,利用其產生的空化效應來破壞細菌細胞結構,但單獨作用時低強度下殺菌效果不明顯。Huu等研究發現,用40 kHz US分別處理大腸桿菌和單增李斯特菌,當處理時間低于30 min和45 min時,減菌效果不明顯。因此,US有必要結合其他處理技術,以達到提升其殺菌效果的目的。
微酸性電解水(slightly acidic electrolyzed water,SAEW)是在直流電場的環境下,通過對稀鹽酸或稀鹽酸與低濃度鹽混合液進行無隔膜電解獲得的水溶液,pH值為5.5~6.5,有效氯濃度(available chlorine concentration,ACC)為10~30 mg/L,氧化還原電位(oxidation reduction potential,ORP)為700~900 mV,具有特殊理化與殺菌特性,一般公認為安全(generally recognized as safe,GRAS)且環保,已成為苛刻化學消毒劑的流行替代品。SAEW屬于新型非熱殺菌技術,因其無殘留、無污染,且安全高效等特點,在水產品加工前處理與保鮮領域中得到廣泛應用。其中,向雅芳等用SAEW對鱸魚片進行殺菌處理,結果表明SAEW殺菌作用良好,能有效降低樣品中的微生物數;馮豪杰等研究得出SAEW處理可有效抑制暗紋東方鲀冷藏期間微生物繁殖,延緩總揮發性鹽基氮(total volatile base nitrogen,TVB-N)含量與pH值上升,維持其良好的感官品質,延長冷藏貨架期2~3 d。
研究表明,更換US的液體介質,將酸性電解水作為US介質,可提升US的殺菌效果。其中,Li Jiao等利用US與SAEW聯合處理金黃色葡萄球菌,能使菌體濃度降低3.68(lg(CFU/mL));Baumann等研究發現,US-臭氧聯用與US單一處理相比,其對單增李斯特菌的殺菌效果提升約30%;Carmen等結果得出,US-萬古霉素聯合處理能明顯提高US對銅綠假單胞菌與大腸桿菌的作用效果;Millan-Sango等研究顯示,US結合牛至精油對生菜中大腸桿菌O157:H7的殺菌效果比US單一殺菌提升26%。現有研究主要側重于US與酸性電解水協同作用對食品品質變化影響與作用效果方面,而對其協同作用機制鮮有研究。基于此,本實驗主要探討了US、SAEW及兩者聯合處理US+SAEW對腐敗希瓦氏菌的作用機制,分別從減菌率、細菌生長曲線、電導率、細胞膜通透性(碘化丙啶(propidium iodide,PI)攝入量)、堿性磷酸酶(alkaline phosphatase,AKP)與乳酸脫氫酶(lactate dehydrogenase,LDH)活力、紫外吸收物質泄漏量等指標,結合微觀結構觀察,綜合分析其作用機制,以期為US結合SAEW處理應用于水產品殺菌保鮮提供理論參考。
1 材料與方法
1.1 材料與試劑
腐敗希瓦氏菌()由課題組成員從腐敗后期的大黃魚中分離、篩選、鑒定后保存于農業農村部水產品貯藏保鮮質量安全風險評估實驗室(上海)。
胰蛋白胨大豆瓊脂(tryptic soy agar,TSA)培養基、胰蛋白胨大豆肉湯(tryptic soy broth,TSB)培養基、氯化鈉(NaCl)、硫代硫酸鈉、無水乙醇、戊二醛(均為分析純) 國藥集團化學試劑有限公司;PI染料北京索萊寶科技有限公司;AKP、LDH試劑盒 南京建成生物工程研究所。
1.2 儀器與設備
FX-SWS100型SAEW生成機 煙臺方心水處理設備有限公司;KQ-300DE型數控超聲波清洗器 昆山市超聲儀器有限公司;Synergy2型自動酶標儀 美國BioTek公司;DDB-11A型電導率儀 杭州齊威儀器有限公司;Mira 3型掃描電子顯微鏡(scanning electron microscope,SEM) 捷克Tescan公司;FE20型pH/ORP計 上海而立環保科技有限公司;RC-3F型高濃度有效氯測定儀 北京航軒科技發展有限公司;M334712型全自動微生物生長曲線分析儀 芬蘭Bioscreen公司;UV-2450型紫外-可見分光光度計 日本島津公司;F-7100型熒光分光光度計 日本日立公司。
1.3 方法
1.3.1 菌懸液與SAEW制備
將保存菌種取出,活化后平板劃線培養得到單菌落。挑取活化后的單菌落在TSB培養基中37 ℃振蕩培養8 h,隨后用質量分數0.85%的無菌生理鹽水洗滌3 次并離心(8 000 r/min、10 min)取其沉淀以去除TSB,最后調整菌懸液菌體濃度至10~10CFU/mL。
通過SAEW生成機電解體積分數9.0% HCl溶液制備SAEW。由pH/ORP計測定其pH值與ORP,由高濃度有效氯測定儀測定其ACC。經測定,所制備SAEW的pH值為6.35±0.04,ORP為(861.6±12.35)mV,ACC為(30.00±1.54)mg/L。
1.3.2 樣品處理
將菌懸液分成4 組:對照(CK)組:1 mL菌懸液加入9 mL無菌生理鹽水;US組:1 mL菌懸液加入9 mL無菌生理鹽水,20 kHz、600 W US處理10 min;SAEW組:1 mL菌懸液加入8 mL SAEW,10 min后加入1 mL終止劑(0.85%(質量分數,下同)NaCl溶液與0.50%硫代硫酸鈉),終止滅菌;US+SAEW組:1 mL菌懸液加入8 mL SAEW,20 kHz、600 W US處理10 min后加入1 mL終止劑,終止滅菌。
1.3.3 減菌效果測定
取100 μL不同處理后的菌懸液在TSA培養基上涂布,隨后置于37 ℃培養箱中培養24 h后,采用平板計數法進行計數。利用樣品殺菌前后的微生物殘存率的對數值表示減菌效果,絕對值越大,表明減菌作用越強,進行3 次平行實驗,計算公式如下。
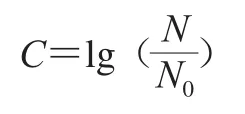
式中:為處理前細菌菌落數/(CFU/mL);為處理后細菌菌落數/(CFU/mL)。
1.3.4 微生物生長曲線的測定
將不同處理后的菌懸液按照1%接種量添加于TSB培養基中,置于37 ℃搖床150 r/min培養24 h,每隔1 h用微生物生長曲線分析儀取樣測定OD,每組3 個平行。以培養時間為橫坐標,OD為縱坐標,繪制微生物生長曲線。
1.3.5 電導率測定
將不同處理后的菌懸液按照1%接種量添加于TSB培養基中,置于37 ℃搖床150 r/min培養10 h,分別于0、2、4、6、8、10 h測定其電導率。
1.3.6 PI攝入量測定
菌懸液10 000 r/min、4 ℃離心10 min,棄上清液,用無菌生理鹽水重懸,進行PI染料染色。染色后室溫黑暗孵化15 min,用熒光分光光度計測定吸光度,激發光波長490 nm,發射光波長635 nm,以菌懸液煮沸10 min為陽性對照組,以吸光度表征PI攝入量。
1.3.7 AKP與LDH活力測定
不同處理的菌懸液分別于0、10 h取樣后,按照AKP與LDH試劑盒說明書要求測定其AKP與LDH活力。
1.3.8 對紫外吸收物質泄漏量的測定
將不同處理后的菌懸液按照1%接種量添加于TSB培養基中,置于37 ℃搖床150 r/min培養,分別于0、10 h取樣,8 000 r/min離心5 min,使用紫外-可見分光光度計測定其上清液(表征核酸含量)和(表征蛋白質含量)。
1.3.9 SEM觀察
參考Han Qiao等實驗方法,將不同處理組的菌液重懸后靜置過夜,4 000 r/min離心5 min,棄上清液,沉淀分別用不同體積分數的乙醇溶液梯度脫水后重懸。取適量樣品滴至蓋破片上晾干,真空鍍膜后進行SEM觀察。
1.4 數據處理與分析
所有實驗進行3 次平行,采用SPSS軟件對數據進行分析,采用Duncan’s法進行差異顯著性分析和多重比較(<0.05為顯著性差異),結果以平均值±標準差表示;使用Origin軟件制圖。
2 結果與分析
2.1 不同處理方式對腐敗希瓦氏菌減菌效果的影響
SAEW具有強氧化性,被廣泛用于食品原料的清洗殺菌過程中。研究發現SAEW可破壞細胞結構,且能進一步破壞菌體細胞的蛋白質及酶系統,從而殺滅微生物。本實驗研究US聯合SAEW對腐敗希瓦氏菌殺滅效果,其減菌效果如圖1所示。
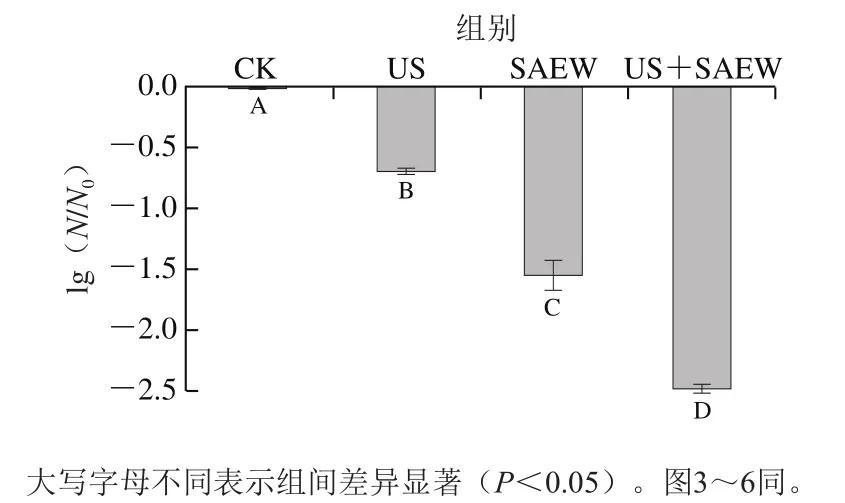
圖1 不同處理方式對腐敗希瓦氏菌減菌效果的影響Fig. 1 Effects of different treatments on the inactivation of Shewanella putrefaciens
由圖1可知,經不同方式處理后,US、SAEW及US+SAEW組的菌落數分別較CK組減少了0.69、1.55、2.48(lg(CFU/mL))。結果表明,US與SAEW聯合處理有協同殺菌作用。可能由于US處理破壞了菌體結構,促進了SAEW進入細胞內部,更直接作用于菌體細胞的酶、蛋白質等,增強其殺菌效果。
2.2 不同處理方式對腐敗希瓦氏菌生長曲線的影響
由圖2可知,CK組的腐敗希瓦氏菌在2 h后快速生長,進入對數生長期,隨后在10 h達到穩定期;而菌體經不同處理后,其對數生長期出現相應延滯。其中,US處理組在7 h進入對數生長期,SAEW處理組在9 h后生長速率緩慢上升,對數生長期出現在12~14 h。US+SAEW組的腐敗希瓦氏菌生長始終處于低水平,可見其對腐敗希瓦氏菌抑制效果明顯。該變化趨勢與Li Jiao等研究結果一致。
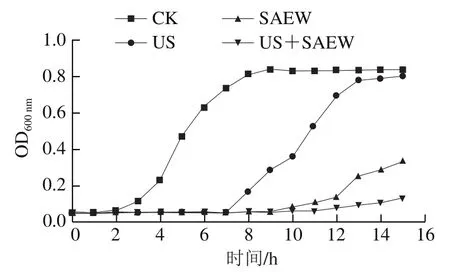
圖2 不同處理方式對腐敗希瓦氏菌生長的影響Fig. 2 Effects of different treatments on the growth of Shewanella putrefaciens
2.3 不同處理方式對腐敗希瓦氏菌電導率的影響
當微生物細胞處于不利環境中,菌體細胞膜的通透性增加,導致電解質外泄,電導率相應升高。不同處理方式對腐敗希瓦氏菌的電導率變化影響如圖3所示。
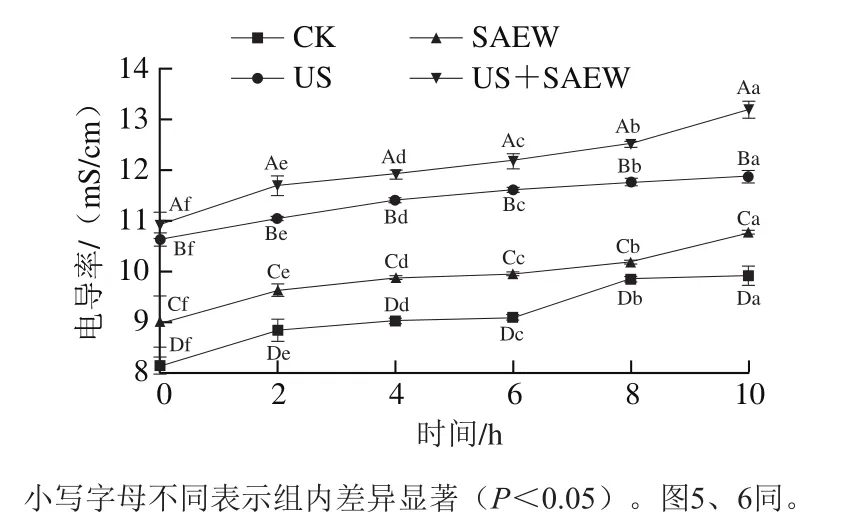
圖3 不同處理方式對腐敗希瓦氏菌電導率的影響Fig. 3 Effects of different treatments on the electrical conductivity of Shewanella putrefaciens
由圖3可知,隨著處理時間的延長,各組菌懸液的電導率相應升高。其中,處理組的電導率較CK組顯著上升,尤其是經US+SAEW處理后,其菌懸液的電導率最高(<0.05),表明US+SAEW對菌體細胞膜影響最大,菌體細胞膜受到損傷,其保護屏障被打破,致使胞內電解質外泄至培養液中,電導率隨之升高。
2.4 不同處理方式對腐敗希瓦氏菌細胞PI攝入量的影響
PI是一種大分子熒光染料,其無法進入具有完整質膜的細胞,但可進入膜受損的細胞,并與細胞內DNA和RNA結合。通過對菌體細胞進行PI染色,能測定處理后菌體細胞膜通透性的變化。不同處理方式對腐敗希瓦氏菌細胞PI攝入量的影響如圖4所示。
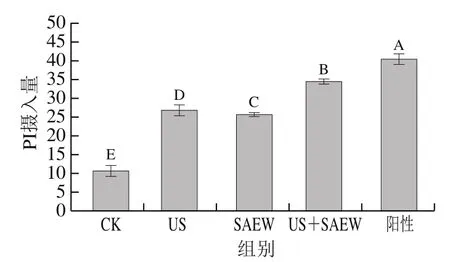
圖4 不同處理方式對腐敗希瓦氏菌細胞PI攝入量的影響Fig. 4 Effects of different treatments on the PI uptake of Shewanella putrefaciens
由圖4可知,與CK組相比,各處理組菌懸液的PI攝入量顯著升高(<0.05),表明US與SAEW單獨或聯合處理均對腐敗希瓦氏菌的菌體結構帶來嚴重破壞,使PI染料更易進入細胞,其中以US+SAEW處理組的PI攝入量最高,由此說明了US與SAEW聯合處理對菌體細胞膜通透性產生顯著影響。
2.5 不同處理方式對腐敗希瓦氏菌胞外AKP與LDH活力的影響
AKP大多存在于細胞壁與細胞膜間,當細胞結構受到破壞,AKP由胞內滲出。因此,可通過檢測細菌胞外AKP活力高低來判斷菌體細胞壁的破壞情況。LDH調控細胞的糖酵解途徑,當菌體細胞膜受損時,其會由胞內泄漏至胞外,可通過測定其活力高低判斷菌體細胞膜的受損程度。不同處理方式對腐敗希瓦氏菌胞外AKP與LDH活力變化影響如圖5所示。
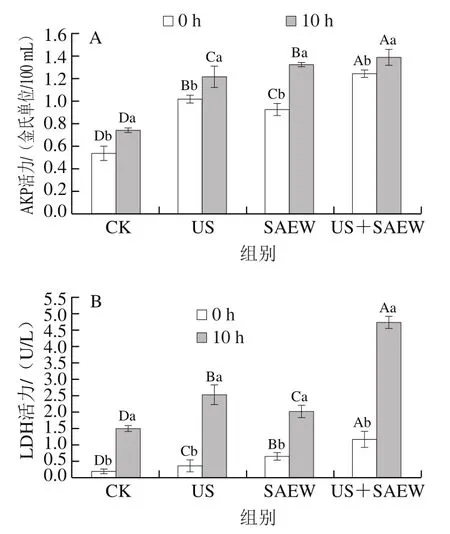
圖5 不同處理方式對腐敗希瓦氏菌胞外AKP(A)與LDH(B)活力的影響Fig. 5 Effects of different treatments on extracellular AKP (A) and LDH (B) activity of Shewanella putrefaciens
如圖5A所示,不同處理后的腐敗希瓦氏菌胞外AKP活力均顯著上升,且在10 h后與0 h差異顯著(<0.05)。該結果同前期指標分析結果一致,可見US+SAEW聯合處理可進一步破壞菌體細胞壁的完整性。遲媛等研究表明US處理在殺菌過程中會作用菌體細胞壁,破壞菌體外層結構,而SAEW也能攻擊細胞壁與細胞膜,導致其通透性增加。
由圖5B可見,菌懸液經處理10 h后,US、SAEW與US+SAEW處理組的LDH活力分別從0 h的0.34、0.63 U/L與1.15 U/L升至10 h的2.51、2.01 U/L與4.73 U/L,CK組的LDH活力顯著低于處理組(<0.05)。結果表明,US與SAEW處理均破壞了菌體細胞膜,使菌體內生物大分子外泄,從而達到其殺菌目的,其中,以US與SAEW聯合處理作用效果最明顯。
2.6 不同處理方式對腐敗希瓦氏菌紫外吸收物質泄漏量的影響
核酸與蛋白質的最大吸收波長分別為260 nm和280 nm。因此可以這兩處波長下的吸光度表征菌體細胞內部成分泄漏量。不同處理方式對腐敗希瓦氏菌紫外吸收物質泄漏的影響如圖6所示。相同處理時間下,US+SAEW組樣品的核酸(圖6A)和蛋白質(圖6B)物質泄漏量顯著高于US或SAEW單獨處理組(<0.05)。聯合處理導致菌體細胞膜結構的不可逆損傷,使膜透性喪失和細胞質大量滲漏。該結果與AKP、LDH活力變化結果一致。由此可知,US與SAEW聯合處理可引起細胞內容物的泄漏,加速菌體死亡的進程。
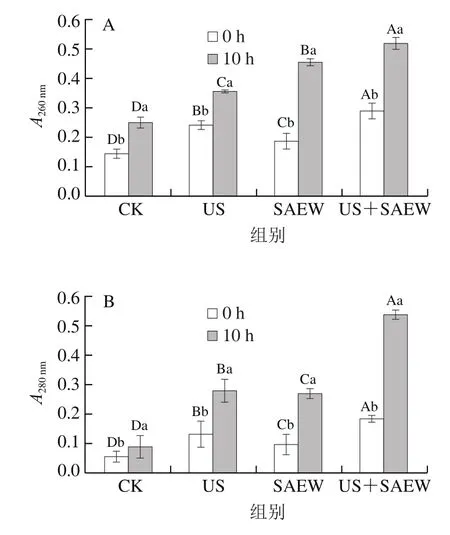
圖6 不同處理方式對腐敗希瓦氏菌核酸(A)與蛋白質(B)等紫外吸收物質泄漏量的影響Fig. 6 Effects of different treatments on leakage of ultravioletabsorbing substances: nucleic acid (A) and protein (B)
2.7 不同處理方式對腐敗希瓦氏菌微觀結構的影響
由圖7可知,CK組菌體細胞飽滿完整、形態均勻。經US處理后,細胞形狀不規則,菌體表面出現皺褶。經SAEW處理后,部分菌體細胞出現破裂,內容物溶出。而US與SAEW聯合處理造成了更嚴重的損傷,包括細菌表面塌陷、外膜斷裂、細胞壁受損,大量內容物外泄。這是由于US處理使菌體細胞的細胞壁和細胞膜受到嚴重破壞,促進SAEW進入細胞內部,增強其聯合殺菌效果。
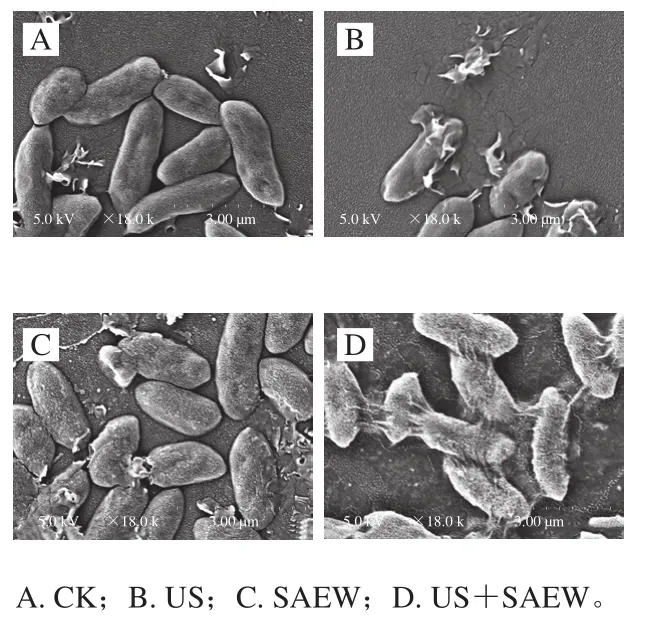
圖7 不同處理方式對腐敗希瓦氏菌微觀結構的影響(18 000×)Fig. 7 Effects of different treatments on the microstructure of Shewanella putrefaciens (18 000 ×)
3 結 論
本實驗研究了US、SAEW及US+SAEW聯合處理對腐敗希瓦氏菌的菌體作用機制,通過測定殺菌效果、微生物生長曲線、電導率、PI攝入量、AKP與LDH活力、細胞膜通透性等,初步闡明了US+SAEW處理對腐敗希瓦氏菌的作用機理。結果表明,US與SAEW處理的協同效應使腐敗希瓦氏菌菌落數減少了2.48(lg(CFU/mL))。聯合處理使菌體細胞膜的完整性明顯受損,導致其電導率、AKP和LDH活力、紫外吸收值(、)升高。SEM結果表明,US+SAEW處理嚴重破壞腐敗希瓦氏菌的菌體結構,造成其細胞壁破裂,蛋白質與核酸等細胞質成分的大量外泄。US+SAEW聯合處理能使腐敗希瓦氏菌菌體生長受到抑制,細胞膜受損,菌體活性降低,最終導致其死亡。因此,將US與SAEW聯合處理用于水產品的保鮮加工與前處理具有良好的應用前景。

