信迪利單抗致不良反應文獻分析
趙菲菲,李 滿,楊 楠,毛利緊,陳敬霞,郭 峰(鄭州大學第一附屬醫院藥學部,鄭州 450052)
信迪利單抗屬于免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs),是一種重組全人源免疫球蛋白G型抗程序性死亡受體1(programmed cell death receptor-1,PD-1)單克隆抗體,可與PD-1結合,阻斷PD-1與其配體PD-L1和PD-L2的結合,從而恢復內源性的抗腫瘤T細胞反應,發揮抗腫瘤作用[1]。2018年12月24日,信迪利單抗獲得國家藥品監督管理局批準,用于至少經過二線系統化療的復發或難治性經典型霍奇金淋巴瘤的治療。《國家基本醫療保險、工傷保險和生育保險藥品目錄(2021年)》中,信迪利單抗新增了聯合其他藥物用于不可手術切除的晚期或復發性鱗狀細胞非小細胞肺癌及不可切除或轉移性肝細胞癌一線治療的適應證。隨著該藥的廣泛應用,其不良反應(adverse drug reaction,ADR)的報道也逐步增多。信迪利單抗說明書中記載,其常見的ADR為免疫相關性肺炎、結腸炎、肝炎、腎炎及內分泌疾病等。由于信迪利單抗在我國上市時間較短,臨床應用經驗有限,目前尚未見基于真實世界數據的藥品安全性評價,故筆者嘗試對信迪利單抗致ADR的個案報道進行匯總分析,以探討該藥致ADR的發生情況和臨床特點,旨在為其臨床安全用藥提供參考。
1 資料與方法
1.1 納入與排除標準
本研究的納入標準為:(1)原始臨床研究或病例報告;(2)ADR與信迪利單抗相關;(3)患者基本情況、疾病情況及用藥情況等信息完整;(4)中英文發表的文獻。
本研究的排除標準為:(1)綜述;(2)重復發表或含重復病例的文獻。
1.2 文獻檢索方法
計算機檢索PubMed、Embase、中國知網、維普網及萬方數據,英文檢索詞為“sintilimab”“induced”“adverse drug reaction”“case”;中文檢索詞為“信迪利單抗”“達伯舒”“不良反應”“病例”。檢索時限均為2018年12月至2022年2月。
1.3 提取資料與分析方法
提取資料包括患者性別、年齡、原患疾病、用法用量、ADR發生時間、ADR臨床表現、ADR診斷、治療措施及轉歸情況等。采用Excel 2016軟件進行統計分析。
2 結果
2.1 文獻篩選結果
共篩選出文獻 32 篇[2-33],其中中文文獻18 篇[3,8,13-14,17-23,25,28-33],英文文獻 14 篇[2,4-7,9-12,15-16,24,26-27],共計 33 例患者。
2.2 患者性別與年齡分布
33例患者中,男性25例(75.76%)、女性8例(24.24%);年齡32~87歲,以40歲以上(27/33,81.82%)為主。結果見表1。
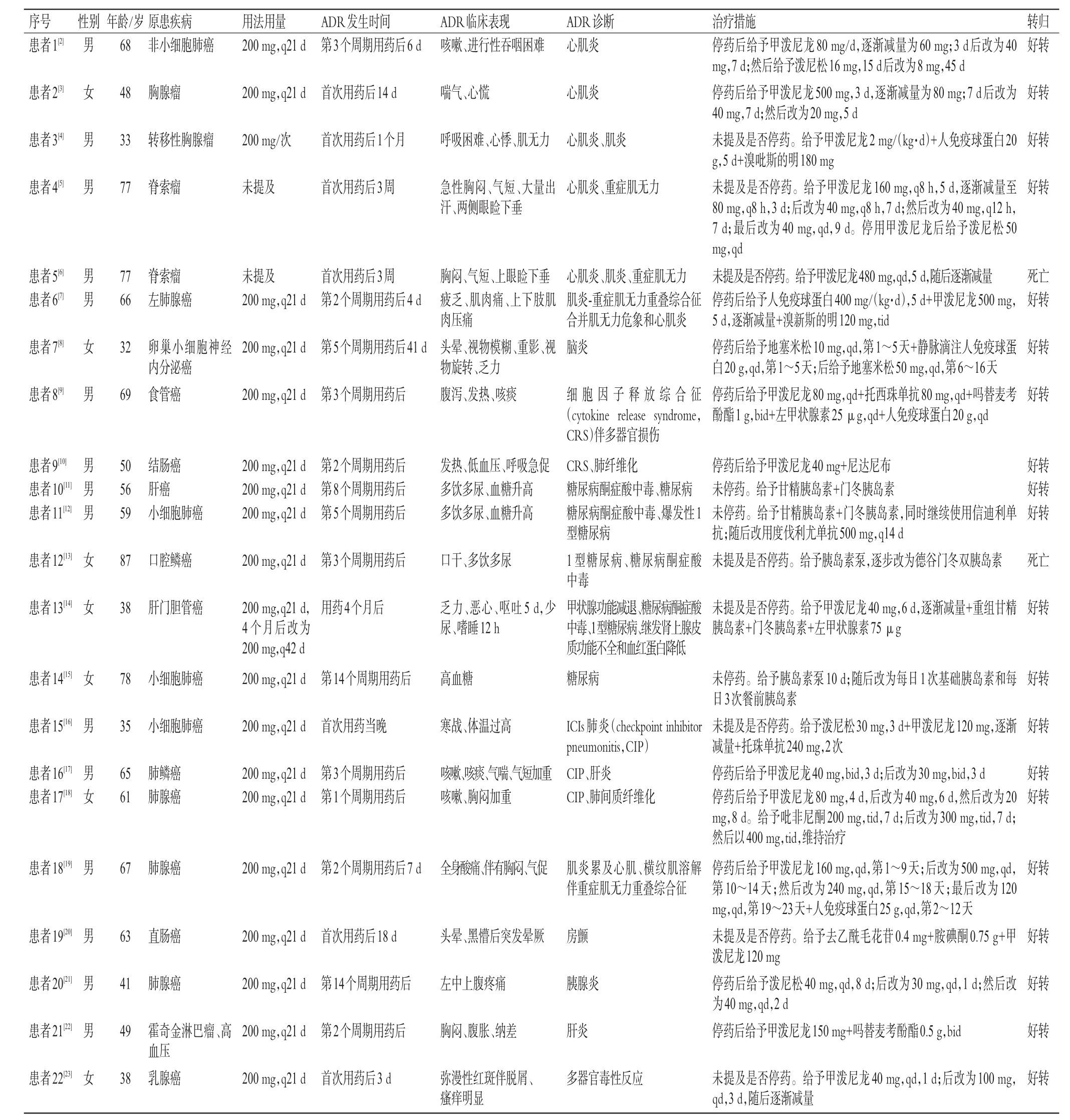
表1 33例患者ADR的發生情況
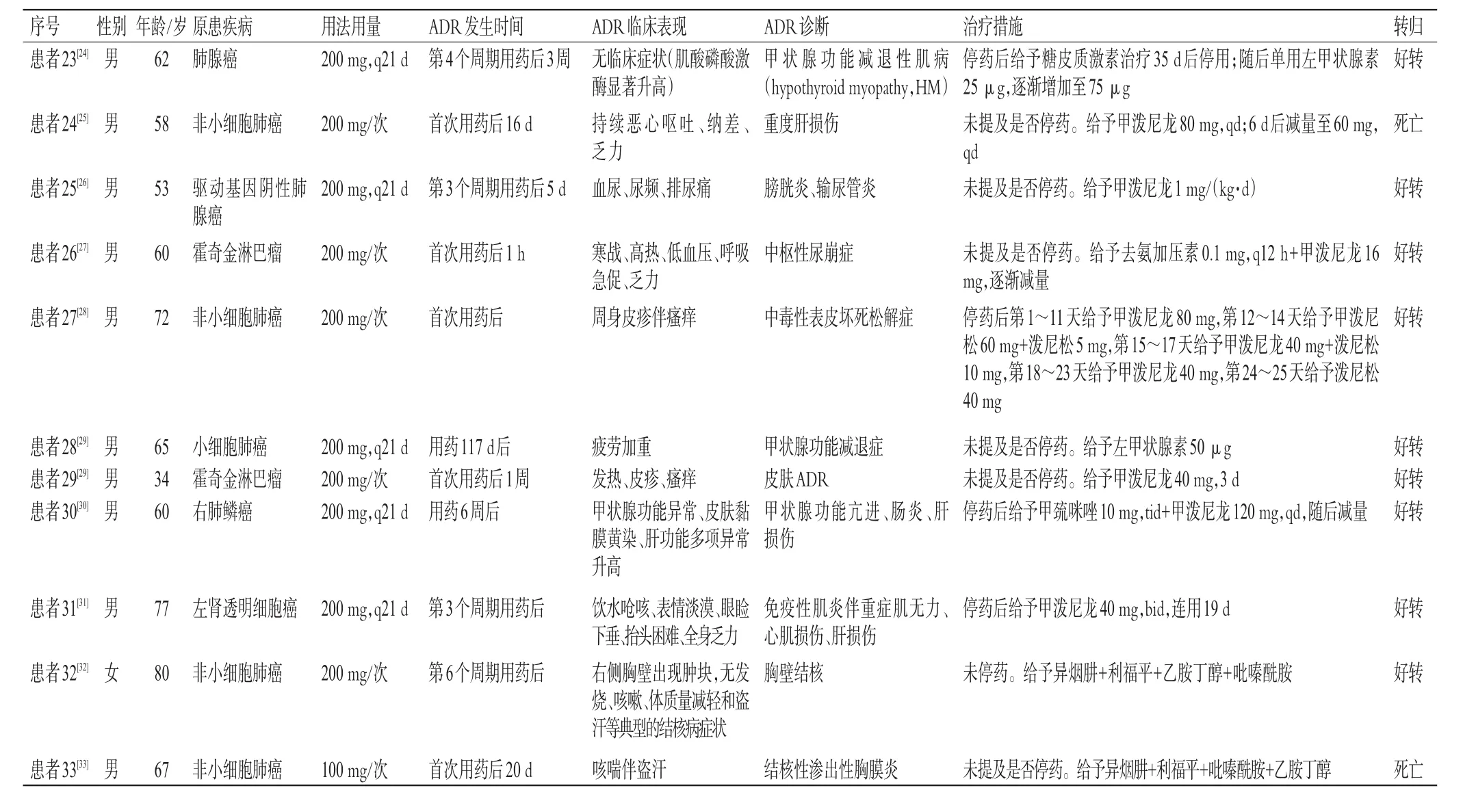
續表1
2.3 原患疾病分布
33例患者中,包括13例非小細胞肺癌(39.39%),4例小細胞肺癌(12.12%),3例霍奇金淋巴瘤(9.09%),2例胸腺瘤(6.06%),2例脊索瘤(6.06%),卵巢小細胞神經內分泌癌、食管癌、結腸癌、肝癌、口腔鱗癌、肝門膽管癌、直腸癌、乳腺癌、左腎透明細胞癌各1例(3.03%)。結果見表1(文獻[13]中,因第2例患者使用的是納武利尤單抗,故未納入)。
2.4 用法用量
33例患者中,有30例患者使用了藥品說明書推薦劑量200 mg,1例患者(患者33)用量為100 mg,2例(患者4、5)患者未提及用藥劑量;24例患者的用藥頻次為q21 d。結果見表1。
2.5 ADR發生時間
33例患者中,ADR最早發生在首次用藥后1 h(患者26),最晚為第14個用藥周期后(21 d為1個周期,患者14);以用藥4個月內ADR發生率較高,為27例(81.82%);尚無用藥12個月后發生ADR的情況。結果見表1。
2.6 治療與轉歸
33例患者中,15例出現ADR后停用信迪利單抗,給予對癥及支持治療后均好轉,其中有1例(患者17)好轉后,3個月后重啟免疫治療(信迪利單抗+貝伐珠單抗);未停藥患者中,有3例(患者10、14、32)經過對癥治療后好轉;1例(患者11)經對癥治療后好轉,1個月后更換為度伐利尤單抗繼續治療。另有14例患者未提及是否停用藥物,經對癥治療后有10例好轉、4例死亡。結果見表1。
3 討論
3.1 ADR的發生時間
信迪利單抗致ADR以用藥后4個月內發生率較高,尚無用藥12個月后發生ADR的報道,這可能與該藥在我國上市時間和腫瘤患者的生存時間較短等因素有關。因此,建議臨床應加強信迪利單抗使用后4個月內的藥學監護,尤其是重點關注心肌炎、糖尿病、肺炎、肝損傷和CRS的發生。
3.2 藥品說明書未記載的ADR
CRS屬于信迪利單抗藥品說明書未記載的ADR。目前,關于PD-1抑制劑引起CRS的文獻報道較少,其發生機制尚不明確。CRS是指任何免疫治療后導致內源性或輸注性T細胞和/或其他免疫效應細胞的激活或參與的超生理反應,是一種嚴重的過度免疫反應;其所帶來的機體的免疫調控失衡,可導致白細胞介素6(interleukin-6,IL-6)、IL-10、IL-2等多種細胞因子異常升高,而這些細胞因子可介導各種免疫反應,引起患者出現發熱、凝血障礙和多器官衰竭等癥[34]。CRS的常見癥狀包括發熱、疲勞、頭痛、皮疹、關節痛和肌痛,嚴重者以低血壓和高熱為特征,可發展為無法控制的全身炎癥反應[34]。本研究中有2例CRS患者,均出現發熱,其中1例患者(患者9)出現IL-6、IL-10、超敏C反應蛋白水平顯著升高伴肺纖維化,但白細胞、粒細胞計數正常,經給予糖皮質激素、尼達尼布等對癥治療后好轉;1例患者(患者8)出現IL-6、IL-10、IL-17A明顯升高伴多器官損傷,經給予糖皮質激素、托西珠單抗(IL-6受體靶向藥)等對癥治療后好轉。有研究認為,IL-6是CRS毒性的中樞介質,CRS的嚴重程度與IL-6水平呈正相關[35]。本研究中的2例CRS患者均出現IL-6升高,這提示使用信迪利單抗后,若患者的IL-6呈較高水平,應警惕CRS的發生。
甲狀腺功能減退是一種常見的內分泌疾病,主要表現為代謝率低下及交感神經興奮性下降,可累及全身多個系統。由甲狀腺功能減退引起的肌肉損害,稱為HM[36]。HM屬于信迪利單抗藥品說明書未記載的ADR。本研究中有1例HM患者(患者23),該患者的肌酸磷酸激酶顯著升高,但未出現肌肉或心臟癥狀,經糖皮質激素治療35 d后因體質量明顯增加而停用糖皮質激素;后經檢查,患者的肌酸激酶同工酶、乳酸脫氫酶、天冬氨酸轉氨酶均顯著升高,甲狀腺功能減退,經查核磁共振顯示中大型心包積液和室間隔肥大,確診為HM,使用左甲狀腺素治療后好轉[24]。這提示使用信迪利單抗后,若患者出現肌肉毒性,應及時監測患者的甲狀腺功能。
3.3 發生率較高的ADR
ICIs相關心肌炎在所有器官免疫毒性中致死率最高,已成為導致患者短期內死亡的重要原因[37]。其發生機制尚不清楚,但有研究認為,可能與免疫激活和自身抗體的產生有關——使用ICIs后,激活的T淋巴細胞除了識別腫瘤抗原外,還可與心臟等非靶器官的免疫檢查點結合,促進非靶器官產生自身抗體,引起心肌炎癥細胞浸潤和心肌纖維化,從而導致心肌炎的發生[38]。此外,從接受ICIs治療到發生心肌炎的時間差異較大,81%的心肌炎出現在用藥后3個月內,發生時間相對早于其他器官[37]。本研究中有6例患者(患者1~6)出現心肌炎,且均出現在用藥后3個月內,其中4例患者為首次用藥后出現心肌炎。ICIs相關心肌炎初始癥狀多為非特異性,如胸悶、氣短、乏力、心悸、呼吸困難等,而本研究中有1例患者(患者1)未出現上述癥狀,ADR表現為吞咽困難。這6例患者均出現了肌鈣蛋白水平明顯升高,有5例患者出現利鈉肽水平升高,這提示若懷疑患者發生心肌炎,應及時檢查心臟生物標志物,以便及時對癥處理。
ICIs相關糖尿病的發生隨ICIs的廣泛應用而逐漸增多,其發生機制并不明確。本研究中有5例患者發生糖尿病,這5例患者具有以下特點:(1)均無個人、家族糖尿病病史,其中4例為糖尿病酮癥酸中毒發病;(2)從開始使用信迪利單抗到確診糖尿病,中位時間為120 d(63~294 d);(3)1例患者C肽降低,其余4例患者C肽低至幾乎無法測出。C肽由胰島素原裂解產生,其血清水平能較準確地反映胰島β細胞功能,這5例患者C肽水平的降低表明其胰島β細胞功能遭到破壞,導致內源性胰島素缺乏。由此筆者推測,胰島β細胞功能損傷可能是信迪利單抗致糖尿病的主要機制。由于信迪利單抗使用一段時間后才會發生糖尿病,因此易被臨床忽視,故對于使用信迪利單抗的患者,臨床需注意監測其糖尿病相關指標,及時篩查,盡早給予對癥處理。
ICIs所致的CIP發生率為3%~5%,是致死人數最多的ADR[39]。CIP的發生機制尚不明確,目前認為是巨噬細胞和效應T細胞之間的PD-1/PD-L1信號通路被阻斷、效應T細胞過度活化而引起肺損傷;使用ICIs后發生CIP的時間差異較大,從給藥開始到停藥后均可出現[17]。本研究中,有3例患者發生CIP,發生時間分別為首次用藥當晚(患者15)、第1個用藥周期后(患者17)、第3個用藥周期后(患者16)。CIP的臨床表現具有非特異性,常見癥狀為呼吸困難、活動耐量下降、咳嗽,也可出現發熱、胸痛等,影像表現多樣且不典型,也缺乏相對特異的血清學標志物,臨床診斷相對困難。其診斷主要依據ICIs用藥史、臨床表現和影像學檢查,并排除其他疾病(如肺部感染、腫瘤進展等),或其他免疫反應(如免疫性心肌炎、甲狀腺功能減退、重癥肌無力)導致的呼吸道癥狀。CIP常用的治療藥物為糖皮質激素,規律、足量的激素治療可控制70%~80%的CIP[39]。本研究中3例發生CIP的患者經過糖皮質激素治療后均有好轉。
綜上所述,信迪利單抗致ADR常發生在用藥后4個月內,男性、40歲以上患者高發;對于使用信迪利單抗患者的用藥監護,需注意心肌炎、糖尿病、CIP,以及說明書中未記載的CRS和HM的發生;若出現ADR應及時采取干預措施,以避免嚴重ADR的發生。

