混合益生菌粉檢驗方法探討
吳家碧,蔡曉霞,陳葉蘭,李 露
(湯臣倍健股份有限公司,廣東珠海 519040)
0 引言
益生菌是一種攝取適當量后,能對食用者健康發揮有益作用的活菌[1-2],通過其中活菌的作用可以改善胃、腸道內微生態的平衡[3-4],抑制病原菌的生長,從而促進身體健康,一般認為其活數要在106CFU/g(mL)以上才能對人體產生益處[5-7]。然而,目前市場上混合益生菌粉的品種類很多,人們忽視了準確檢測活性益生菌產品中乳酸菌活菌數的方法,導致市場上許多產品的乳酸菌活菌數偏差大或難以檢出[8-9]。
目前,對益生菌產品的檢驗方法主要是我國食品藥品監督管理局于2016年12月發布GB 4789.35—2016《食品安全國家標準食品微生物學檢驗 乳酸菌檢驗》乳酸菌的檢驗方法[10],很多混合益生菌活菌數產品都超過100×108CFU/g,益生菌原料超過1 000×108CFU/g,原料活菌數大,成品添加各種輔料,按方法里規定的稀釋方法、時間和稱樣量,稱量25 g加225 mL生理鹽水混合,體積大,混合效果差;直接混合,樣品可能有結塊、無法全部分散、混合時間太短、樣品混合不均勻的風險,無法準確檢測乳酸菌活菌數,因此固體原料稱量10 g樣品加90 mL生理鹽水,用250 mL離心管加玻璃珠混合,體積合適,混合效果好;加玻璃珠混合,能加快樣品的分散,混合效果好;混合4~9 min,能保證樣品混合均勻,且對檢測結果無影響[11-12]。
建立一個可靠、準確檢測乳酸菌活菌數的檢測方法,優化試驗過程,可以減少因試驗誤差帶來的食品安全問題。
1 器材與方法
1.1 儀器材料
旋渦振蕩器、移液器(1,10 mL)、勻漿儀、勻漿杯、潔凈工作臺、生化培養箱(36±1℃)、高壓滅菌器、電子天平、離心管、量筒、玻璃珠(直徑5 mm)、一次性培養皿(φ90 mm)、厭氧盒、厭氧產生劑、厭氧指示劑、秒表等。
1.2 試劑及樣品
(1)試劑及培養基。MRS培養基、莫匹羅星鋰,均為北京陸橋公司提供;無菌生理鹽水。
(2)混合益生菌原料。乳酸菌粉A、乳酸菌粉B、乳酸菌粉C、乳酸菌粉P。
(3)益生菌成品。益生菌固體飲料1(a型,b型,c型,d型)、益生菌粉2、益生菌固體飲料3(e型,f型)、益生菌粉4、益生菌固體飲料5、益生菌固體飲料6。
1.3 試驗優化方案及試驗方法
1.3.1 樣品前處理優化
稱樣、均質和供試液制備時間優化前后對比見表1。

表1 稱樣、均質和供試液制備時間優化前后對比
1.3.2稀釋液配制方法
配制稀釋溶液時,稱取8.5 g氯化鈉到1 000 mL的燒杯中,用純化水完全溶解后,分裝255 mL于500 mL三角瓶中,于121℃條件下滅菌30 min。優化前9 mL試管水采用先分裝好、再滅菌的方式進行,優化后采用先滅菌、后分裝,避免滅菌過程中蒸發損耗,保證分裝量更準確。
1.3.3 供試液制備方法
(1)原料。稱取10 g置于300 mL勻漿杯或250 mL離心管中,準確量取90 mL無菌生理鹽水加入勻漿杯或離心管中,離心管加40顆直徑5 mm玻璃珠;勻漿儀以轉速13 000 r/min均質5~8 min或離心管在漩渦振蕩器以轉速3 000 r/min均質5~9 min,充分混勻制成1∶10的樣品勻質液。
(2)成品。稱取25 g置于勻漿杯或500 mL離心管中,準確量取225 mL無菌生理鹽水加入勻漿杯或離心管中,離心管加40顆直徑5 mm玻璃珠;用勻漿儀以轉速13 000 r/min均質3~8 min或離心管在漩渦振蕩器以轉速3 000 r/min均質4~8 min,充分混勻制成1∶10的樣品勻質液。
1.3.4 梯度稀釋方法
用移液器取1∶10樣品勻液1 mL,加入9 mL無菌生理鹽水稀釋液中,制成1∶100樣液,之后按10倍遞增關系稀釋,每次稀釋時以轉速3 000 r/min旋渦振蕩器振搖20 s,根據對待檢樣品活菌數含量的估計,選擇3個連續的適宜稀釋度,每個稀釋度吸取1 mL樣品勻質液于滅菌平皿內,每個稀釋度做2個平皿。
1.3.5 傾注培養基及培養方法
(1)乳酸菌總數。將冷卻至48℃的MRS瓊脂培養基傾注入平皿約15 mL,順時針和逆時針方向各旋轉5次使其混合均勻,待平皿凝固后,迅速裝入厭氧盒中,于36±1℃下厭氧培養72±2 h。從樣品稀釋到平板傾注要求在15~17 min內完成。
(2)雙歧桿菌。將冷卻至48℃半胱氨酸鹽酸鹽改良的MRS培養基,按比例加入莫匹羅星鋰鹽[13],充分混勻,傾注入平皿約15 mL,順時針和逆時針方向各旋轉5次使其混合均勻,待平皿凝固后,迅速裝入厭氧盒中,于36±1℃條件下厭氧培養72±2 h。從樣品稀釋到平板傾注要求在15~17 min內完成[14]。
(3)嗜熱鏈球菌。將冷卻至48℃的MC培養基傾注入平皿約15 mL,順時針和逆時針方向各旋轉5次使其混合均勻,待平皿凝固后,于36±1℃條件下有氧培養72±2 h。從樣品稀釋到平板傾注要求在15~17 min內完成。
1.3.6 結果計數方法
MRS瓊脂培養基上記錄所有菌落數,MC培養基上記錄菌落中等偏小,邊緣整齊光滑的紅色菌落,直徑2±1 mm,菌落背面為粉紅色[15]。
2 試驗優化前后及結果對比分析
2.1 均質方式的優化前后結果對比
傳統益生菌檢測,由于益生菌菌含量高,使用的均質方式無法使樣品中益生菌完全混合均勻,導致檢測結果不準確。
現優化益生菌前處理方式,將均質袋換成500 mL離心管,同時加入約40顆5 mm的玻璃珠,以轉速3 000 r/min旋渦振蕩器振搖加快混合,同時對比使用均質袋混合方式,選取混合益生菌A原料對比發現,優化前樣品混合不均勻,稀釋梯度不成比例,優化后結果準確穩定。
混合益生菌不同均質方式乳酸菌總數結果統計見表2。
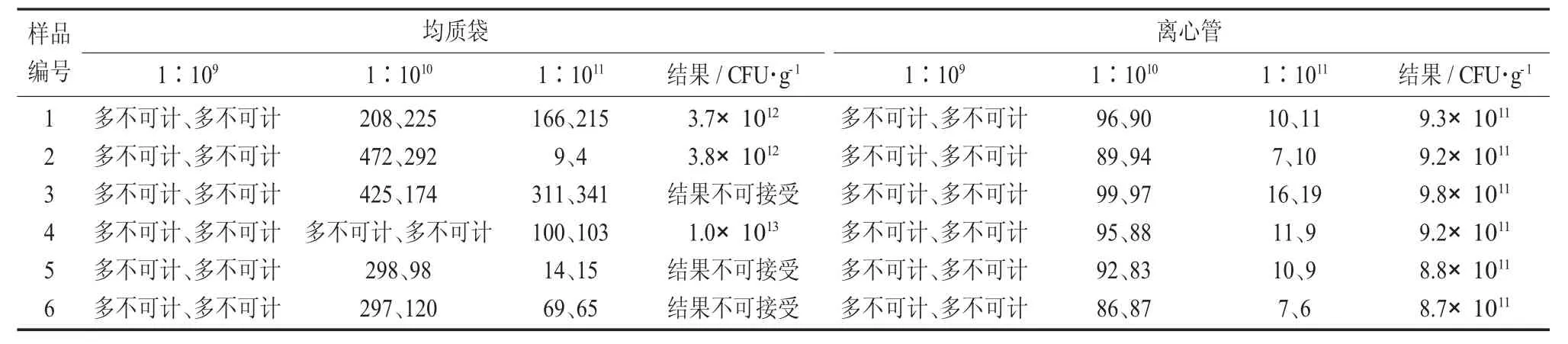
表2 混合益生菌不同均質方式乳酸菌總數結果統計
2.2 供試液制備時間優化前后結果對比
由于乳酸菌在相對受限制的環境中存活時間有限。因此,在前處理稀釋液中時間不同,太短會出現樣品混合不均勻,太長會出現乳酸菌死亡現象,將導致乳酸菌檢出值和真實值差別很大。
選擇益生菌固體飲料5,按成品益生菌檢測方式進行檢測,用離心管+玻璃珠前處理,前處理時間分別為2.0,4.5,8.0 min。對檢測結果進行對比,發現按不同前處理時間稀釋,檢測結果相差大,稀釋2 min時,樣品均質不均勻,導致檢驗結果不成稀釋比例;稀釋時間為8 min,雙歧桿菌活菌數檢測結果下降2個對數值;稀釋時間為4.5 min時,能準確檢測雙歧桿菌活菌數結果。
益生菌固體飲料5-雙歧桿菌檢測參數及結果見表3。
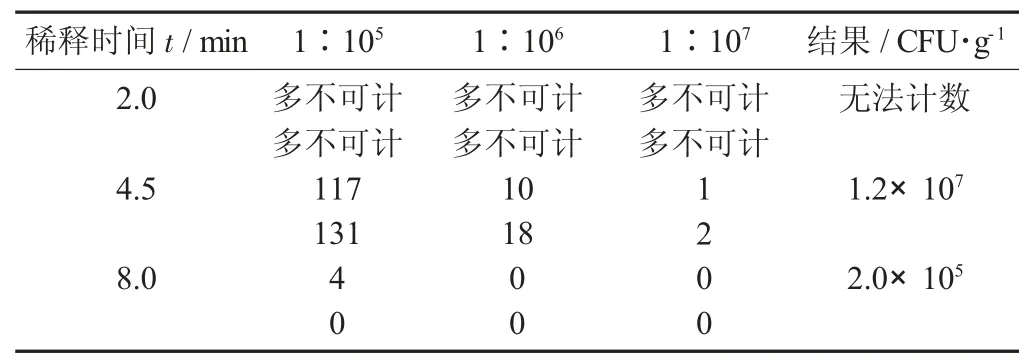
表3 益生菌固體飲料5-雙歧桿菌檢測參數及結果
(3)根據大量試驗驗證,總結出各種混合益生菌粉的均值方式參數和時間。
各種混合益生菌粉均質方法及時間統計見表4。
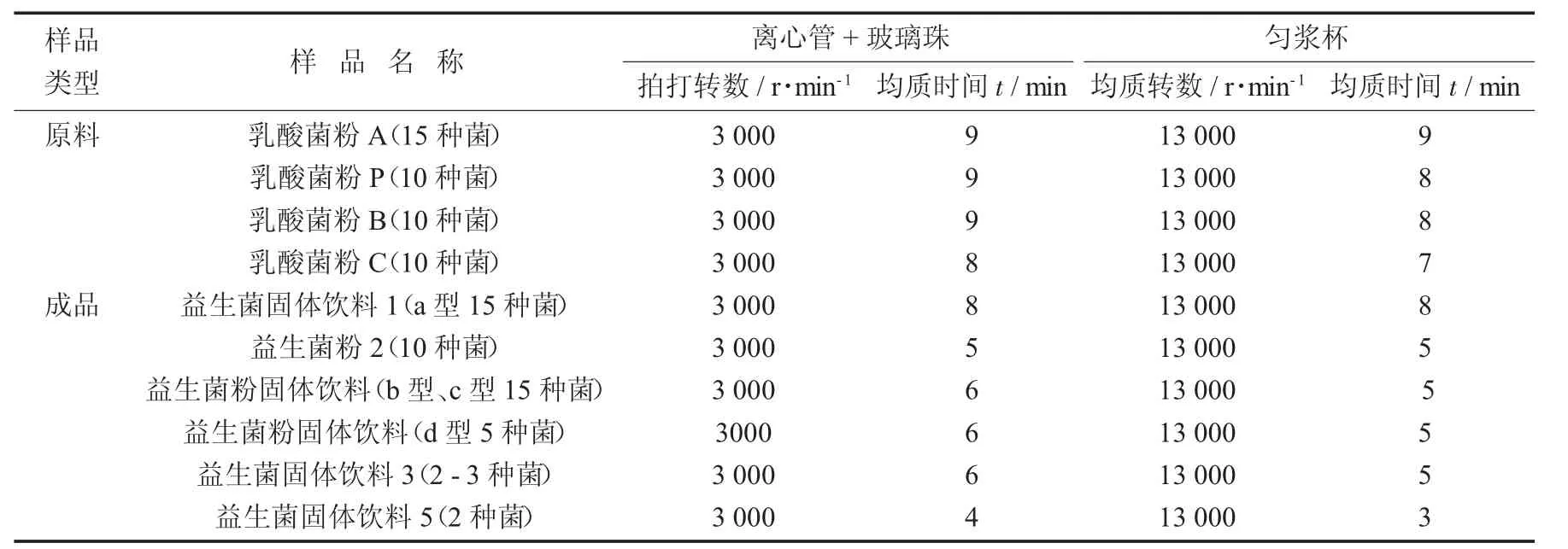
表4 各種混合益生菌粉均質方法及時間統計
2.3 益生菌原料稱樣量的優化前后結果對比
由于益生菌原料活菌數大,活菌數一般都在1 000×108CFU/g以上,稱量25 g加225 mL生理鹽水用均質袋稀釋,均值不均勻和檢驗結果偏差大,用500 mL離心管混合,體積太大,無法形成漩渦,混合效果差,存在混合不均勻。
取3批混合乳酸菌粉C原料,現按國標要求稱樣量25 g,與稱樣量改成10 g進行檢驗比對,結果發現當稱樣量為25 g時,樣品混合不均勻,出現梯度稀釋結果不成比例,稱樣量為10 g時,檢出率100%,另取一批益生菌粉P原料進行10次重復性試驗。檢驗相對標準偏差小于15%。
混合益生菌原料不同稱樣量乳酸菌總數結果統計見表5,益生菌粉P原料原料檢測改善前參數及結果見表6。

表5 混合益生菌原料不同稱樣量乳酸菌總數結果統計
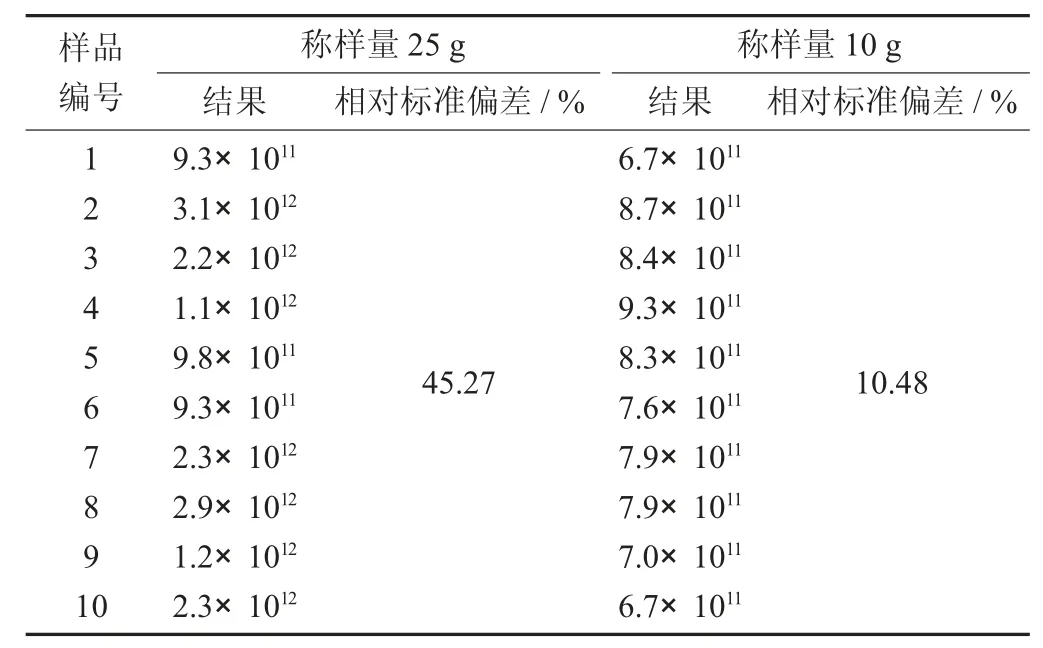
表6 益生菌粉P原料原料檢測改善前參數及結果
2.4 梯度稀釋使用試管水體積的優化前后結果對比
(1)梯度稀釋用的生理鹽水用玻璃試管裝,先分裝成9 mL/支后滅菌,滅菌過程水分蒸發體積減
少,試驗結果準確度不夠,試驗結果重復性差。
(2)改善后使用的是塑料試管,生理鹽水先滅菌后分裝,體積準確,試驗結果重復性好。塑料試管為帶蓋試管,密封性良好,可于121℃高溫高壓滅菌,臨用前用移液槍準確量取已滅菌的生理鹽水備用,避免滅菌過程中水分汽蒸發而導致稀釋液體積減少導致試驗誤差,經過3批原料2次驗證,改善后的重復性良好,2次試驗的對數差值都小于0.25。
乳酸菌粉A原料試管水優化前后重復性檢測結果對比統計見表7。
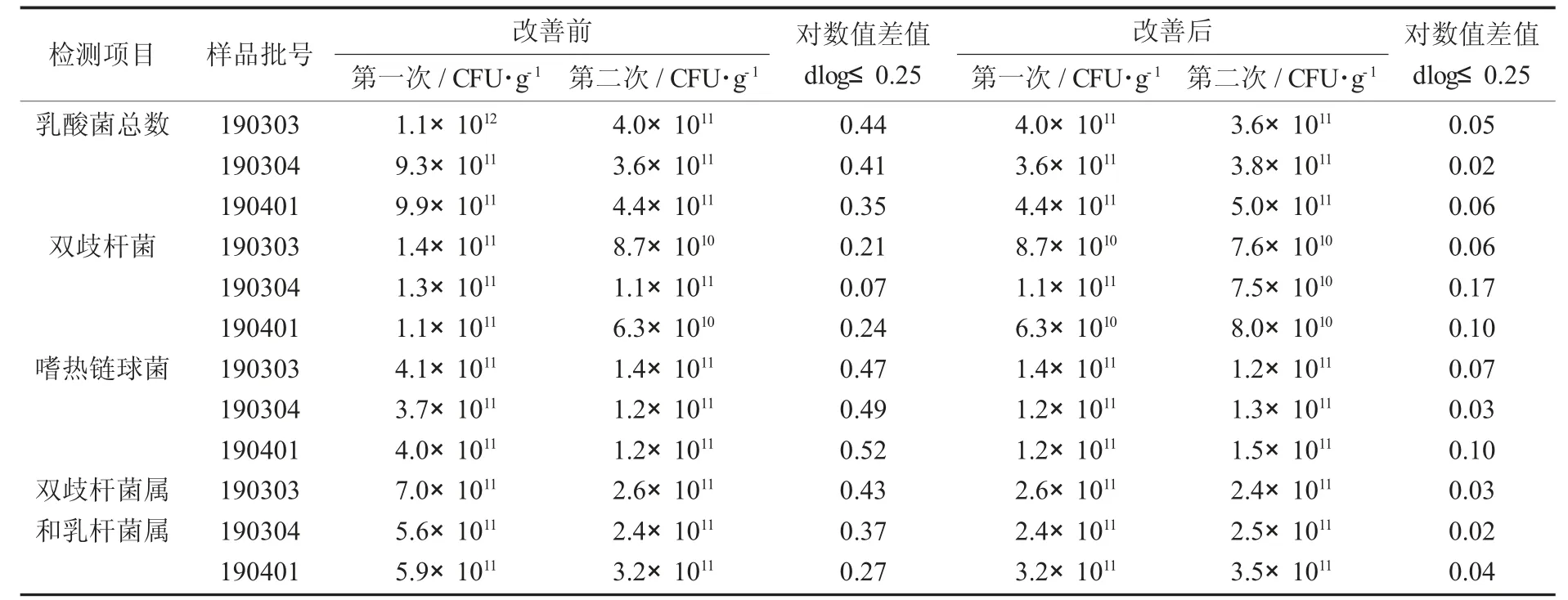
表7 乳酸菌粉A原料試管水優化前后重復性檢測結果對比統計
3 結論
通過優化檢測方法,有效提高混合益生菌粉中乳酸菌活菌數的檢驗準確率,根據不同樣品活菌數的量,通過改善稀釋容器及均質參數,離心管在漩渦振蕩以上能形成很好的漩渦,加上玻璃珠,能將樣品充分分散均勻,合理延長均質時間,能保證樣品混合均勻,且對檢測結果無影響;勻漿儀增加均質轉數,13 000 r/min合理延長均質時間,能保證樣品混合均勻,且對檢測結果無影響;優化稀釋液的分裝,滅菌后分裝,稀釋液體積更準確,保障混合益生菌原料及成品的檢測結果值準確、穩定,重復性好。該方法前處理過程較長,梯度稀釋時,動作要連貫及快速,每次只能處理一個樣品,提高檢測質量,減少試驗誤差。

