一種新型一氧化氮比率型近紅外熒光探針的制備及應用
張夢田,吳 麗,杜江燕*
(1.南京師范大學 化學與材料科學學院,江蘇 南京 210023;2.南通大學 公共衛生學院,江蘇 南通 226000)
一氧化氮(NO)是生物體內普遍存在的一種內源性氣體分子,由線粒體一氧化氮合成酶在氧氣和還原性輔酶Ⅱ(NADPH)參與下催化內源性L-精氨酸分解生成[1]。NO在人體內作為代謝產物形成的控制生理過程的信號分子,廣泛參與多種生理和病理過程,在血小板聚集和細胞粘附、心力衰竭、血管舒張、炎癥等生命過程中發揮關鍵作用[2-3]。此外,NO 還與信號轉導、中樞神經系統紊亂、平滑肌松弛、分解代謝自噬過程和免疫反應[4-8]密切相關。NO 的生物學效應與其在細胞微環境中的濃度密切相關,對生物體而言,細胞內NO 是一把“雙刃劍”,較低濃度的NO 參與免疫及炎癥過程的信息傳遞,促進血管生成和腫瘤生長、轉移,而較高濃度的NO則會誘導腫瘤細胞凋亡,具有抗腫瘤作用[9];在免疫系統中,較低濃度的NO 能抑制T 細胞增殖,起抗炎作用,較高濃度的NO 則會在病原體存在時引起強烈的炎癥反應[10]。大量研究表明,NO濃度失調與一些致命疾病密切相關,如青光眼、免疫紊亂、急慢性炎癥、內皮功能障礙、神經退行性疾病、動脈粥樣硬化、感染性休克和癌癥等[11-13]。因此,體內動態檢測NO對于研究其在生命活動中的生理機制,以及多種疾病及腫瘤的臨床診斷具有非常重要的意義[14]。
與化學發光法、電化學法、電子順磁共振光譜法或紫外可見吸收光譜法等分析方法相比,熒光探針技術具有靈敏度高、響應快速和抗干擾能力強等優點,是動態檢測活細胞及活體中NO 的重要手段[15-17]。例如,Kumar課題組[18]設計并合成了一種溶酶體靶向探針LyNP-NO,可選擇性檢測活細胞中的NO,用于動態監測大鼠腦組織中的內源性NO 水平。Xu 等[3]設計了一種智能NO 探針PYSNO,該探針對外源性和內源性NO 均表現出快速反應,還可用于跟蹤和研究動物組織中NO 的產生。但現有的檢測NO 的熒光探針仍存在靈敏度不高、選擇性差及信號易受干擾等問題。因此,亟需開發靈敏度高、專一性好的熒光探針提高NO檢測的準確度和可靠度。
2,1,3-苯并噻二唑(Benzothiadiazole,BTD)是一種缺電子雜環結構熒光受體,具有優良的化學和光學性能,如斯托克斯位移大、吸電子能力強、光穩定性好等特性。本文將BTD 稠合鄰苯二胺獲得的[c][1,2,5]噻二唑-5,6-二胺([c][1,2,5]Benzothiadiazole-5,6-diamine,BTN)衍生物,作為NO 的特異性識別基團和電子受體,通過與NO 間的特異性反應識別NO。芴衍生物是一種重要的熒光分子,通過C9 位官能團的修飾可調控熒光性能。將芴衍生物作為給電子基團,噻吩作為π 橋與BTN 共價結合,構建了供體-受體-供體(D-A-D)型熒光探針4,7-雙(5-(9,9-二辛基-9H-芴-2-基)噻吩-2-基)苯并[c][1,2,5]噻二唑-5,6-二胺(4,7-Bis(5-(9,9-dioctyl-9H-fluoren-2-yl)thiophen-2-yl)benzo[c][1,2,5]thiadiazole-5,6-diamine,BTBTN)。此探針結構中鄰苯二胺與NO 反應后形成苯并三氮唑結構,分子內電荷轉移(ICT)效應增強,吸收光譜明顯紅移,熒光探針在紅光波段處熒光減弱,而在近紅外波段處熒光增強,可實現NO 的比率計量檢測。相較于傳統的增強型或猝滅型NO 熒光探針,該探針通過比率計量熒光可實現背景熒光低、抗干擾能力強的NO近紅外熒光分析和檢測。
1 實驗部分
1.1 試劑與儀器
賴氨酸、甘氨酸和抗壞血酸購于上海阿拉丁生化科技股份有限公司;DL-同型半胱氨酸、L-半胱氨酸、9,9-二辛基-2-溴芴、N-乙酰-L-半胱氨酸和丙酮醛購于上海麥克林生化科技有限公司;4,7-二溴-2,1,3-苯并噻二唑、谷胱甘肽和一氧化氮供體鹽(2-(N,N-二乙基氨基)-二氮烯-2-氧鈉鹽水合物)購于Sigma-Aldrich西格瑪奧德里奇(上海)貿易有限公司;其他試劑購于國藥集團化學試劑有限公司;實驗所用試劑均為分析純。溶液用二次水配制。
核磁共振碳譜(13C-NMR)、核磁共振氫譜(1H-NMR)測試實驗采用Bruker Avance III HD 400 MHz超導核磁共振儀。高分辨率質譜儀(HRMS)采用美國Thermo Fisher Scientific 公司生產的Orbitrap Fusion Lumos。紫外吸收光譜實驗采用日本島津公司生產的UV-1900型紫外可見光譜儀。熒光光譜實驗采用英國愛丁堡公司生產的FS-5型熒光光譜儀。
1.2 熒光探針(BTBTN)的合成與表征
1.2.1 化合物BTBTN的合成路線將4,7-二溴-2,1,3-苯并噻二唑(C6H2N2SBr2)與濃硝酸、三氟甲烷磺酸(CF3SO3H)等原料在一定條件下反應生成化合物1(C6O4N4SBr2);將2-(三丁基錫)噻吩(C16H30SnS)、化合物1、四(三苯基膦)鈀[Pd(PPh3)4]在一定條件下反應生成化合物2(C14H6O4N4S3);將化合物2 溶解于N,N-二甲基甲酰胺(C3H7ON)和乙腈混合溶劑中,分次加入N-溴代琥珀酰亞胺(C4H4NO2Br)和微量溴化氫反應完成后,得到橘紅色化合物3(C14H4O4N4S3Br2);將9,9-二辛基-2-溴芴(C19H41Br)、聯硼酸頻那醇酯(C12H24O4B2)、無水醋酸鉀及[1,1’-雙(二苯基膦)二茂鐵]二氯化鈀二氯甲烷絡合物[PdCl2(dppf)2CH2Cl2]等試劑反應得到化合物4(C35H53O2B);利用Suzuki 偶聯反應將化合物4 偶聯到化合物3,再投入含有甲醇、K2CO3溶液、Pd(PPh3)4的四氫呋喃溶液中反應得到化合物5(C72H86O4N4S3);將化合物5、鐵粉、乙酸加入密封反應容器中反應得到化合物BTBTN(C72H90N4S3),制備路線如圖1所示。
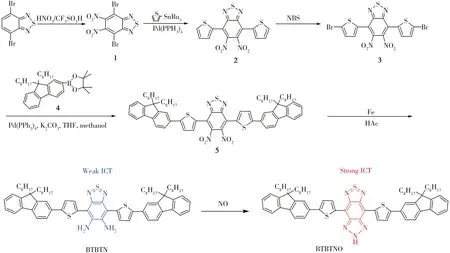
圖1 探針BTBTN的合成路線及與NO反應可能的機理Fig.1 Synthesis procedures of probe BTBTN and possible reaction mechanism with NO
1.2.2 探針BTBTN 的核磁共振光譜結果1H NMR(400 MHz,CDCl3)δ 7.76-7.66(m,6H),7.64(s,2H),7.52(d,J=3.7 Hz,2H),7.40(d,J=3.7 Hz,2H),7.37-7.29(m,6H),2.06-1.96(m,8H),1.35-0.93(m,44H),0.81(t,J = 7.1 Hz,12H),0.65(d,J = 7.8 Hz,8H)。13C NMR(101 MHz,CDCl3)δ 151.70(s),150.99(d,J = 14.3 Hz),147.08(s),141.16(s),140.73(s),139.39(s),134.32(s),132.99(s),129.85(s),127.33(s),126.97(s),124.94(s),123.28(s),123.01(s),120.32(d,J = 18.5 Hz),119.88(s),107.51(s),55.35(s),40.59(s),31.93(s),30.19(s),29.38(s),23.93(s),22.74(s),14.23(s),0.14(s)。
1H-NMR和13C-NMR的實驗結果表明所得產物為目標化合物BTBTN。
1.3 溶液的配制
BTBTN 儲備液的配制:準確稱量一定質量的BTBTN 樣品,溶解于四氫呋喃(THF)中,配制質量濃度為5 mg/mL的BTBTN貯備液,于4 ℃下避光保存。
HEPES 緩沖液(0.01mol/L,pH 7.4)的配制:準確稱取1.1915 g C8H18N2O4S(4-羥乙基哌嗪乙磺酸)固體,向其中加0.5 L 水,超聲、攪拌至完全溶解,得到0.01 mol/L HEPES 酸液。準確稱取0.4 g NaOH溶于10 mL水中,配制1 mol/L NaOH 溶液作為堿液。將上述酸液和堿液按照一定比例混合,配制不同pH值的緩沖液。
樣品溶液的配制:在比色皿中加入0.665μL HEPES 緩沖液和1.335μL THF,再取2.3μL 探針母液,用1 mL移液槍吹打均勻,制備探針濃度為5μmol/L的樣品溶液,總體積為2 mL左右。
NO 溶液的配制:準確稱取一定量的NO 供體鹽,在一定量的水中加入適量NO,配制質量濃度為5 mg/mL的NO溶液,立即冷凍在-20 ℃冰箱中,現取現用。
1.4 紫外吸收光譜實驗
將上述探針溶液(5μmol/L)及HEPES緩沖液(0.01 mol/L,pH 7.4)分別加入到兩個樣品池中,進行紫外吸收光譜測試。為了消除溶劑誤差,待初始工作基線穩定后再開始樣品的測試。測試BTBTN 與NO響應實驗時,在測試液中加入適量濃度的NO儲備液(最終濃度50μmol/L)。充分反應后,記錄熒光探針紫外吸收峰強度的變化。
1.5 熒光光譜實驗
以410 nm 作為樣品的激發光波長,狹縫寬度2 nm,向石英比色皿中加入HEPES 緩沖液和樣品溶液,使得配制的熒光探針BTBTN 的最終濃度為5μmol/L。測試BTBTN 與NO 響應實驗時,在測試液中分別加入適量濃度的NO 儲備液(最終濃度為50μmol/L)。充分反應至信號不再變化時,記錄熒光探針的最大發射峰強度。
2 結果與討論
2.1 熒光探針與NO作用的光譜研究
為了考察探針BTBTN 對NO 的響應情況,測定了BTBTN 與NO 反應前后的紫外吸收光譜和熒光光譜。結果如圖2A 所示,BTBTN 的紫外光譜(曲線a)在355 nm 處有1 較強吸收峰,在410 nm 處有1 弱吸收峰。加入NO 后(曲線b)顯示355 nm 處的吸收峰消失,而410 nm 處的吸收峰明顯增強,同時在660 nm 處產生1 新吸收峰,表明BTBTN 與NO 發生了化學反應,有新物質生成,且溶液由紅色變為藍色(如圖2A插圖)。
圖2B 為探針BTBTN 與NO 作用前后的熒光光譜,如曲線a 所示,BTBTN 在410 nm 激發光輻射下,只在640 nm 處有發射峰,且熒光強度較弱。加入NO 后,640 nm 處的發射峰明顯降低,且在775 nm 處出現1 明顯的發射峰,這可能是由于BTBTN 分子中鄰苯二胺的兩個氨基基團與NO 發生反應生成了新物質,ICT 效應增強使探針在775 nm 處發出近紅外熒光。圖2B 插圖表明,探針BTBTN 與NO 作用后產生明顯的顏色變化,進一步證明BTBTN 與NO 反應產生了新的熒光物質。上述實驗結果表明探針BTBTN可用于NO的檢測。
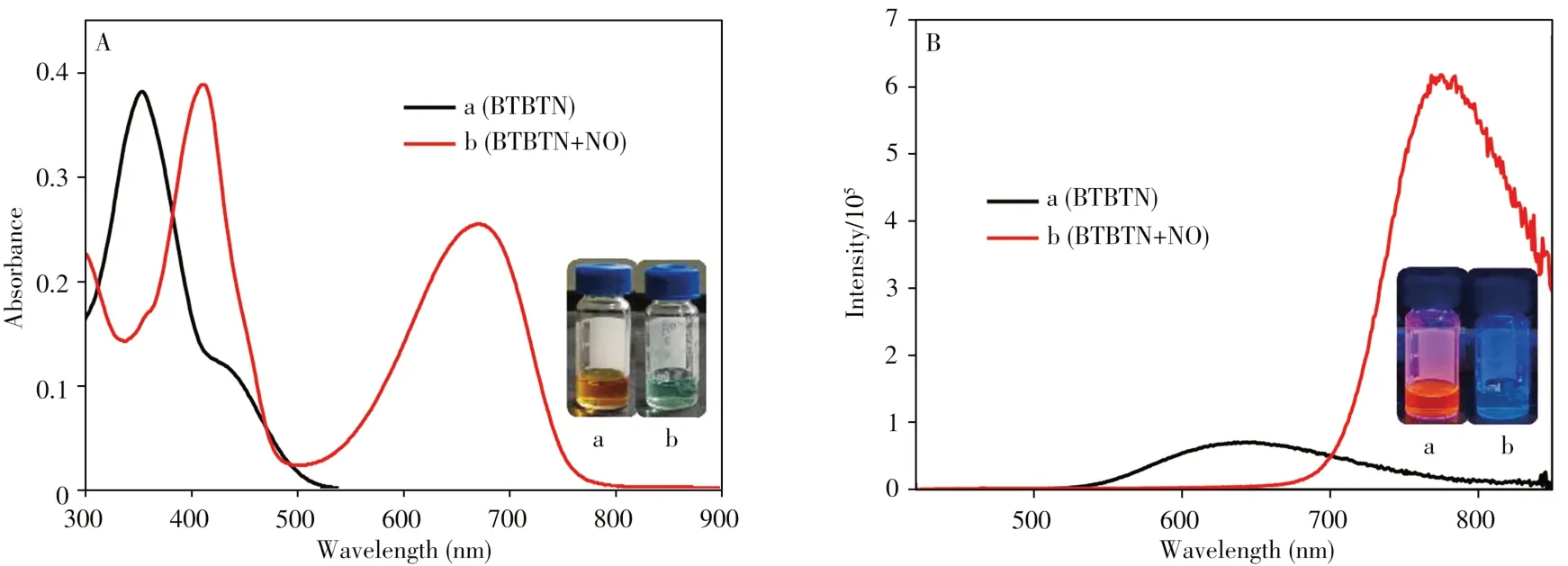
圖2 探針BTBTN與NO作用前后的紫外吸收光譜(A)及熒光光譜(B)Fig.2 UV-Vis absorption spectra(A)and fluorescence spectra(B)of probe BTBTN in the absence and presence of NO HEPES buffer-THF/H2O(2∶1),pH 7.4;concentration of BTBTN:5μmol/L;λex=410 nm
2.2 熒光探針對NO的檢測機理研究
熒光探針BTBTN 是以鄰苯二胺修飾的[c][1,2,5]噻二唑-5,6-二胺作為NO 識別基團和電子受體,基于BTBTN 與NO 反應前后的光譜變化,推測BTBTN 上的鄰苯二胺基團與NO 發生環化反應,生成苯并三氮唑結構的產物。為了證實這一推斷,考察了BTBTN 與NO 反應前后的高分辨質譜,結果如圖3所示。在正離子模式下,BTBTN 在m/z=1107.6 處有1 強的分子離子峰。當探針BTBTN 與NO 反應后,在負離子模式下,m/z=1116.6處出現1新的強分子離子峰(圖3B),該數值與化合物BTBTNO的理論相對分子質量(m/z=1117.6)相對應,符合BTBTNO 的三氮唑在質譜中失去了單質子H,表明探針確實被NO還原成化合物BTBTNO,從而驗證了圖1提出的探針BTBTN與NO反應的機理推測。當探針與NO結合,二氨基苯并-(1,2,5-噻二唑)部分的弱電子受體將轉化為具有強吸電子能力的三唑并稠合苯并-(1,2,5-噻二唑),然后生成產物BTBTNO,并由增強的ICT效應開啟近紅外熒光。
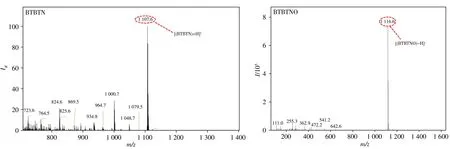
圖3 BTBTN(A)及BTBTN與NO反應后(B)的質譜圖Fig.3 MS spectra of BTBTN(A)and its reactant after BTBTNO treating with NO(B)BTBTN:Calc. for C72H90N4S3:1106.6328. Found:1107.57[MA+H]+;BTBTNO:Calc. for C72H87N5S3:1117.6124. Found:1116.6[MB-H]-)
2.3 實驗條件的優化
為獲得最佳的檢測靈敏度,分別對溶劑THF配比、反應時間和溶液pH值進行優化。如圖4A所示,隨著溶劑中THF 含量的增大,BTBTN 的熒光強度呈先升高后降低現象,當溶劑THF 和水的體積比為2∶1時,BTBTN對NO的響應能力最強。
為了探究反應時間對探針熒光強度的影響,考察了探針BTBTN分別與不同濃度(8、16、70μmol/L)NO混合后,其熒光強度隨時間的變化情況。結果顯示,BTBTN與NO在3 min內反應即達到平衡,表明BTBTN可快速與NO結合并產生熒光響應,因此,選擇3 min作為探針與NO的反應時間。
pH 值對熒光強度的影響如圖4B所示,在pH 6.0~8.0范圍內,探針BTBTN 對NO 具有較穩定的熒光響應,表明BTBTN 適用于生理pH 范圍內NO 的檢測。因此,選擇pH 7.4 為HEPES 緩沖液(HEPES buffer-THF/H2O(2∶1))的最佳pH值。
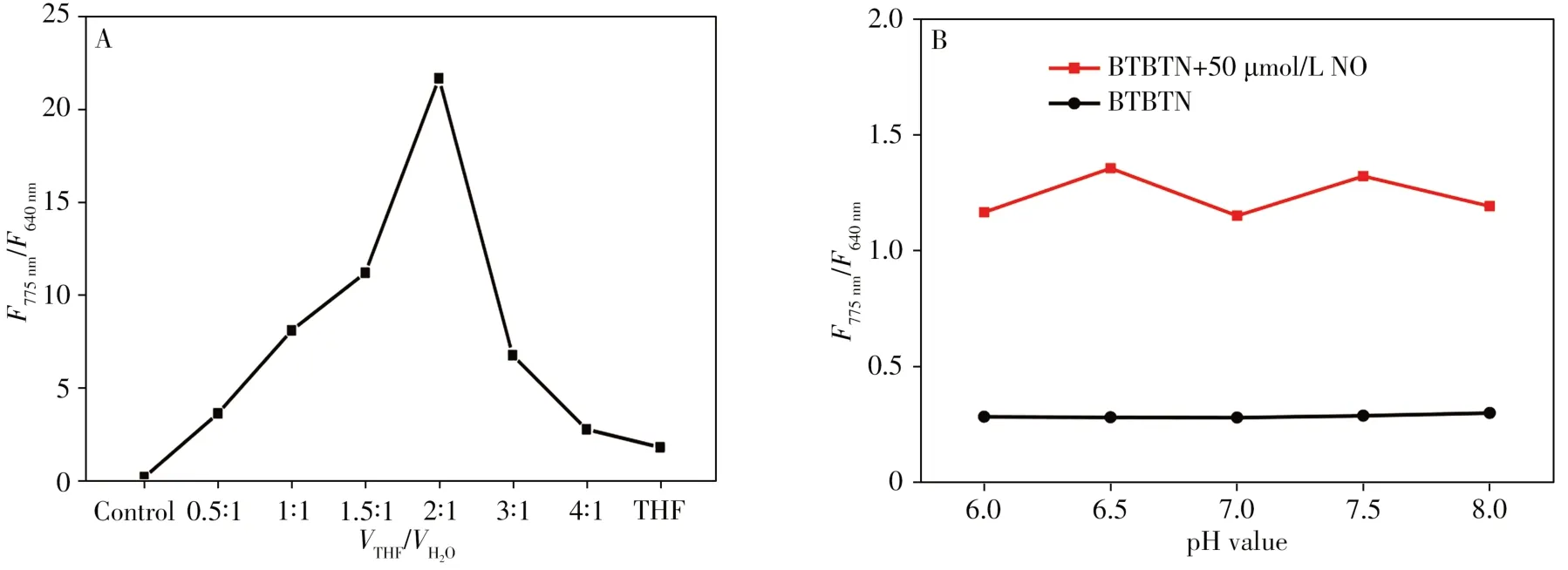
圖4 溶劑配比(A)及pH值(B)對熒光強度的影響Fig.4 Effects of volume ratios of THF to water(A)and pH value(B)on fluorescence systems of BTBTN HEPES buffer:0.01 mol/L,BTBTN:5μmol/L
2.4 標準曲線、線性范圍與檢出限
為了探究熒光探針對NO 的檢測靈敏度,測試了BTBTN 與不同濃度(0~50μmol/L)NO 在HEPESTHF 緩沖液(pH 7.4)中的熒光光譜。從圖5 可知,探針的熒光強度隨著NO 濃度的增加而增加,且BTBTN 在775 nm/640 nm 的熒光強度比值F775nm/F640nm與NO 的濃度在0~10μmol/L 范圍內呈良好的線性關系,線性方程為Y=0.2792+0.3282×[NO](r2=0.9939),式中[NO]為NO 的濃度(μmol/L),Y為F775nm/F640nm的比值。根據檢出限的計算公式(LOD=3σ/k,σ為空白樣品連續測定3次的標準偏差,k為標準曲線斜率),測得方法對NO的檢出限為28.88 nmol/L。

圖5 探針BTBTN 與不同濃度NO 作用后的熒光光譜Fig.5 Fluorescence spectra of BTBTN upon addition of different concentrations of NOBTBTN:5μmol/L,HEPES buffer-THF/H2O(2∶1),pH 7.4;inset:relationship between NO concentration and fluorescence intensity(F775 nm/F640 nm)
與文獻報道的其他NO 探針的檢測結果相比(表1),探針BTBTN 對NO 具有較低的檢出限。基于本方法對NO響應速度快、檢測靈敏度高的特點,可實現對體外NO含量的快速、靈敏的熒光定量檢測。
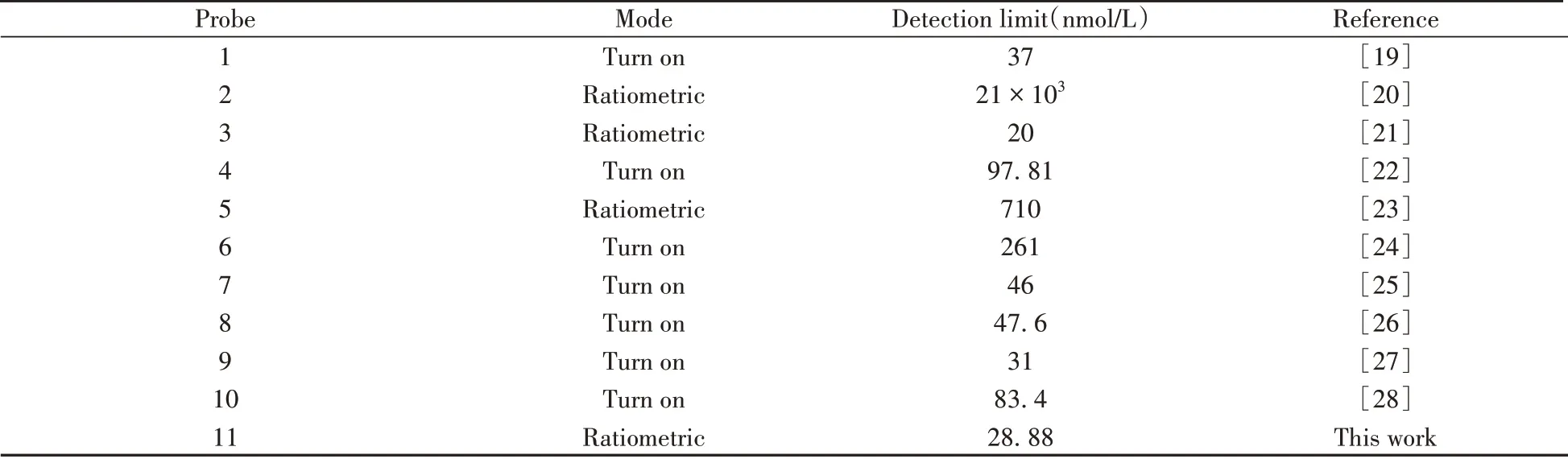
表1 本方法與文獻報道的檢測NO熒光探針的檢出限比較Table 1 Comparison of detection limits of the method with the other fluorescent probes for NO
2.5 選擇性實驗
為了考察探針BTBTN 對NO 檢測的選擇性和抗干擾能力,以常見的不同種類分析物作為干擾物,測試了BTBTN 的熒光光譜。檢測對象包括:6 種氨基酸(Hcy、GSH、L-Cys、L-Lys、Gly、NAC,濃度均為5.0 mmol/L)、2 種生物小分子(丙酮醛、抗壞血酸,濃度均為50μmol/L)、6 種金屬離子(Na+、Ca+、Mg2+、Fe2+、Fe3+、Zn2+,濃度均為1.0 mmol/L)、5 種陰離子、Br-、I-,濃度均為1.0 mmol/L)、5種活性氧及活性氮物種(·OH、1O2、ClO-、H2O2、ONOO-,濃度為100μmol/L)。當向5μmol/L BTBTN溶液中加入30μmol/L NO后,其熒光強度比值(F775nm/F640nm)迅速增大。將上述干擾物加入到熒光探針溶液中充分反應后,未觀察到F775nm/F640nm的明顯變化,表明上述測試物中,只有NO 能觸發BTBTN 探針的近紅外熒光,表明BTBTN 對NO 檢測具有較好的選擇性和抗干擾能力,可滿足生物樣品中NO的檢測要求。
3 結論
本文以鄰苯二胺修飾的苯并噻二唑衍生物作為NO 識別基團和電子受體,以芴的衍生物作為供電子熒光基團,設計并合成了一種新型近紅外比率型熒光分子探針BTBTN。該探針與NO 反應后生成苯并三氮唑結構,分子內電荷轉移(ICT)效應增強,熒光發射光譜明顯紅移,探針在紅光區的熒光發射減弱,而在近紅外區的熒光明顯增強,通過兩者間的熒光變化可實現NO 的比率計量檢測。探針BTBTN對NO 的熒光檢測具有響應快速(3 min)、檢出限低(28.88 nmol/L)及在生理pH 范圍內穩定性好和選擇性高的特征,有望用于復雜細胞和活體環境中NO的定量檢測。

