表現類似腦淀粉樣血管病相關性炎癥的孤立皮質靜脈血栓形成1例及文獻復習
賀忠延, 朱旭貞, 陳 靜, 任永富
顱內靜脈血栓形成(cerebral venous thrombosis,CVT)較動脈源性腦梗死相對少見,約占所有腦血管病的0.5%~1%[1],包括硬腦膜竇血栓形成、深靜脈血栓形成和皮質靜脈血栓形成。但最近研究表明,隨著影像技術的進展,它比既往估計的更常見。皮質靜脈血栓形成(cortical vein thrombosis,CoVT)是大腦淺靜脈血栓,通常伴隨靜脈竇血栓發生,而不伴隨靜脈竇血栓的孤立皮質靜脈血栓形成(isolated cortical vein thrombosis,ICoVT)臨床少見,約占CVT的6%[2],僅見單病例或小系列報道,對其特征仍缺乏足夠認識,使其診斷上存在誤診、漏診情況。
本文結合我科的1例ICoVT和既往文獻報道對ICoVT病因和臨床表現、臨床影像學特征以及治療和預后進行文獻回顧,旨在為本病早期診治提供依據。
1 臨床資料
患者,女性,84歲,主因“突發精神行為異常2 d”于2021年7月25日入院。患者家屬訴患者2 d前出現精神亢奮,持續自發言語,語聲高亢,辱罵丈夫,情緒急躁,尖酸刻薄,易激惹,晝夜不眠,無主動進食需求。曾就診于當地醫院急診,頭部CT提示左側頂葉異常病灶,轉入我院。既往2021年7月4日曾因“突發右側肢體抽搐伴活動不利1 h”就診于當地,診斷為“癲癇持續狀態Todd麻痹”,予左乙拉西坦0.5 g qdpo、吡侖帕奈 2 mg qnpo抗癲癇。神經內科查體:煩躁不安,查體欠配合,聲音嘶啞,自言自語,余無殊。輔助檢查:頭部CT(2021年7月24日):左側頂葉大片低密度灶(見圖1B)。凝血功能:D-二聚體 0.67 mg/L(正常值0~0.55 mg/L);血常規、甲狀腺類、腫瘤標記物、糖化血紅蛋白、生化檢查、傳染病4項、抗核抗體譜測定+抗中性粒細胞漿抗體、抗心磷脂抗體全套均無殊。初步診斷:器質性精神障礙:顱內占位性病變?腦梗死?自身免疫性腦炎?顱內靜脈血栓形成?治療:奧氮平2.5 mg qnpo、喹硫平12.5 mg qdpo改善精神癥狀;左乙拉西坦0.5g qdpo、丙戊酸鈉緩釋片 0.5 g qnpo抗癲癇。7月26日腰椎穿刺壓力100 mmH2O,腦脊液常規檢查:紅細胞2×106/L,白細胞1×106/L;腦脊液生化:腦脊液蛋白577.40 mg/L(正常值0500 mg/L),墨汁染色、抗酸染色、細菌涂片及培養均陰性。患者家屬補充影像資料:頭部CT(2021年7月4日):未見異常(見圖1A)。頭部MRI平掃(2021年7月6日):左側頂葉片狀異常,呈T1WI等信號,T2WI高信號,FLAIR高信號,ADC高信號,DWI未見彌散受限(見圖2A~C)。頭部MRI增強(2021年7月日9):左側頂葉病灶基本同前(7月6日),T1增強未見強化。患者前后兩次頭部CT間隔20 d,新增左側頂葉皮質下片狀低密度灶,未累及皮質,不符合典型動脈供血區,頭部DWI彌散不受限,基本排除動脈源性腦梗死。病灶短期內快速出現,不符合常規腫瘤影像表現,頭部MRI增強無明顯強化,基本排除腫瘤性病變。修正診斷:器質性精神障礙?自身免疫性腦炎? 顱內靜脈血栓形成? 調整治療予以甲強龍500 mg靜滴沖擊治療。7月28日頭部MRI增強:左側頂葉片狀異常信號較前(7月6日)明顯增大,累及左側側腦室后角,呈T1WI低信號,T2WI高信號,FLAIR高信號,ADC高信號,DWI未見彌散受限,增強腦回樣強化,DWI可見左側額頂葉旁條索狀等高信號(見圖2D~F)。頭部CTA:未見明顯血管狹窄。1.5腦靜脈(MRV):左側乙狀竇及橫竇未見顯影(見圖3A、B)。腦電圖:未見明顯癇樣活動。自免免疫性腦炎8項抗體(腦脊液和血清)陰性,副腫瘤綜合征11項抗體(血清)陰性。頭部CTP:左側頂葉TTP、MTT較對側明顯延長,CBF、CBV對側明顯降低(見圖3C~E)。患者老年女性,急性起病,以精神行為異常、癲癇等高級皮質異常為主癥,病灶短期內出現并逐漸進展,由皮質下白質向腦室旁白質進展,影像呈血管源性水腫,病灶位于上矢狀竇引流區,但MRV上矢狀竇通暢,需考慮孤立皮質靜脈血栓形成。此外從患者臨床特征及影像表現需要鑒別腦淀粉樣血管病相關炎癥,擬進一步完善SWI。因自勉腦抗體均陰性予減停甲潑尼龍。7月31日頭部MRI+SWI:SWI可見皮質靜脈血栓形成、靜脈代償擴張及微出血,余同前(7月28日)(見圖2G、H)。蛋白C測定 77.0%(正常值70%~140%),蛋白S測定41.6%(正常值59%~118%)。考慮患者微出血相對局限,僅位于病灶內,且SWI可見血管低密度信號條索征提示靜脈血栓形成,明確診斷:孤立皮質靜脈血栓形成,易栓癥(蛋白S活血缺乏),予克賽4000 U ihbid(2021年7月31日-8月17日),后改予口服利伐沙班15 mg qdpo抗凝治療。8月9日復查頭部CT提示左側頂葉病變較前明顯消退(見圖1C)。12月6日患者未再出現癲癇發作,無明顯精神行為異常,復查頭部MRI+SWI提示左側頂、側腦室后角異常信號基本消退,T1WI可見皮質高信號,考慮皮質層狀壞死,SWI仍可見條索狀低信號,代償擴張靜脈影較前減少(見圖2 I~L)。
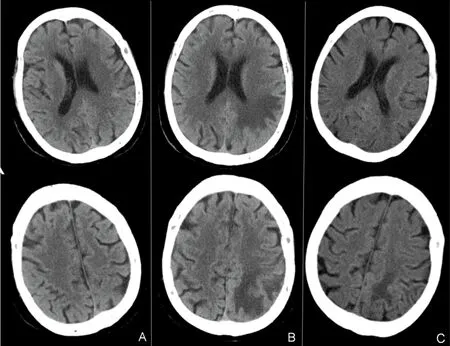
圖1 頭部CT影像。A:2021年7月4日;B:2021年7月24日;C:2021年8月9日
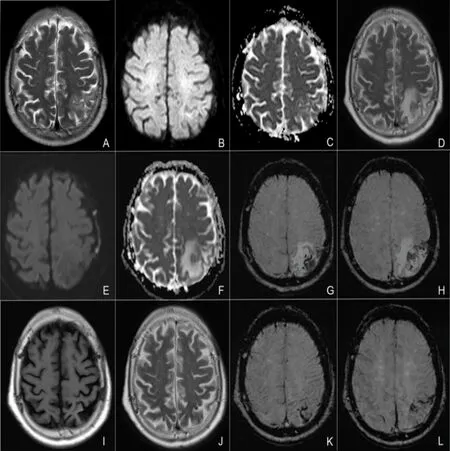
圖2 頭部MRI影像。A~C:2021年7月6日,A:T2WI;B:DWI;C:ADC;D~F:2021年7月28日;D:T2WI;E:DWI;F:ADC;G、H:2021年7月31日,SWI;I~L:2021年12月6日,I:T1WI,J:T2WI,K、L:SWI
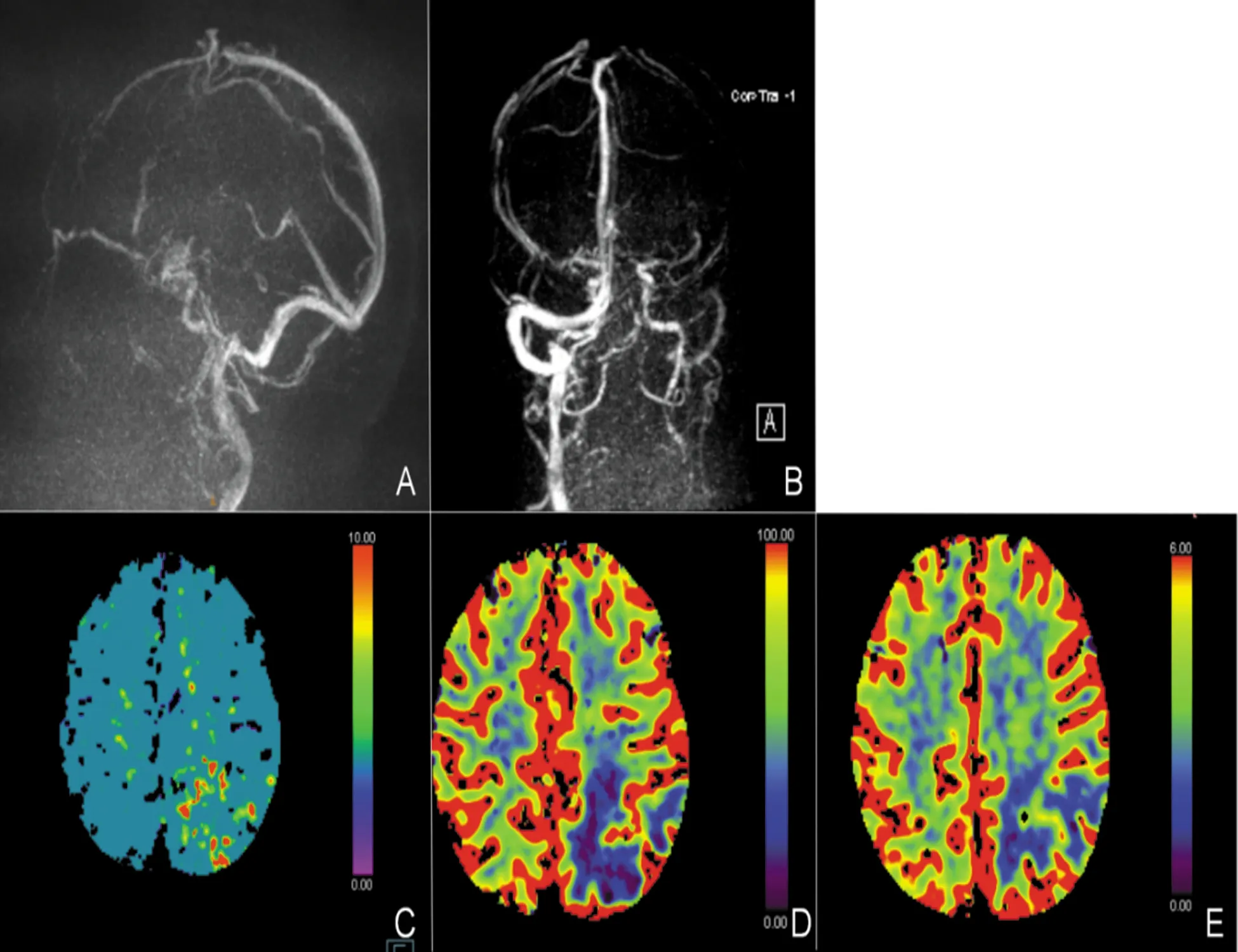
圖3 A、B :頭部MRV;C~E:頭部CTP;C:MTT,D:CBF,E:CBV
2 討 論
由于ICoVT臨床特征、影像表現缺乏特異性,易出現漏診誤診,造成不可逆的神經功能殘障。本患者以急性精神行為異常為突出表現的ICoVT,患者入院前20 d曾因癲癇就診于外院,診斷為“癲癇持續狀態”,未進行進一步病因診斷。通過對患者入院前后影像表現(近皮質腦實質異常)動態變化及其他輔助檢查,最終將診斷縮小在孤立皮質靜脈血栓形成(ICoVT)和腦淀粉樣血管病相關性炎癥(cerebral amyloid angiopathy-related inflammation,CAA-I),最終經磁敏感加權成像(susceptibility weighted imaging,SWI)明確診斷ICoVT。
2.1 ICoVT病因 許多局灶或全身性因素可導致孤立性皮質靜脈血栓形成,如感染、妊娠或產褥期、脫水、口服避孕藥、腰椎穿刺、凝血功能障礙和自身免疫性疾病、惡性腫瘤、外科手術、低顱壓、創傷和藥物治療等[3,4],但仍有20%~35%病因是不明的[5]。一項病例報道分析了51例ICoVT,排在前3位病因凝血功能異常(44.2%)、低顱壓(23.3%)和感染(14%)[4]。相關病因對ICoVT具有提示意義,且病因的識別決定抗凝治療療程。
2.2 ICoVT臨床表現 臨床表現取決于血栓形成的位置和程度,以及功能性側支循環的存在。在一項大規模研究中[3],ICoVT從癥狀出現到明確診斷的中位時間間隔為7 d(平均23 d),71%的患者出現頭痛,58%出現癲癇發作,62%的患者存在局灶性神經功能缺損,包括運動和感覺障礙、失語、閱讀障礙等。另一篇文獻報道ICoVT主要臨床表現為癲癇(66.7%)和頭痛(64.7%)[4],而CVT臨床表現主要以頭痛為主(約90%),其次為癲癇(約40%)[6],與CVT靜脈竇阻塞常引起顱內壓增高有關。既往文獻報告還可見精神障礙[7]等。雖然孤立皮質靜脈血栓形成較少產生顱內壓升高的癥狀,但若診斷及治療不及時可表現為明顯占位效應導致顱高壓癥狀[8]。雖然不同研究中臨床癥狀占比有所不同,但最常見的癥狀都是頭痛、癲癇和局灶性神經功能缺損[9],要提高此類非特異性癥狀警惕性,注意識別ICoVT可能。
2.3 ICoVT影像特征 早期診斷和治療可以有效逆轉ICoVT的疾病進程,并顯著降低急性并發癥和長期后遺癥的風險,因此,對ICoVT的早期識別至關重要。診斷是基于皮質靜脈血栓形成的識別,沒有靜脈竇和深靜脈受累。ICoVT的影像表現可以分為直接征象和間接征象。影像檢查可直接顯示皮質靜脈內血栓形成,稱為直接征象,但它的出現與時間(從血栓形成到影像學檢查)直接相關。在CT上可表現為條帶狀高密度或“條索征”,只有大約5%的病例可以看到這種征象[10],并在1 w~2 w內消失[11]。MRI上的信號特點取決于成像時血栓的期齡,信號演變同血腫相似,急性期(0~5 d)可表現為T1WI等信號、T2WI低信號,與正常靜脈留空影相似,亞急性期(6~15 d)T1WI和T2WI均為高信號,而慢性期(>15 d) T1WI和T2WI均為低信號,因此,亞急性期影像特征較易識別[12],若病程為急性期,至亞急性期復查影像可提到診斷率。但單純依賴頭部MRI平掃(T1WI、T2WI)、MRV成像診斷ICoVT存在困難,主要原因有以下幾個方面:(1)皮質靜脈數量、大小和位置解剖變異較大;(2)通過常規MRI很難在皮質層面發現閉塞的小靜脈;(3)只有閉塞大的靜脈或累及靜脈竇才可在MRV中發現[12]。當MRI、MRV不能識別ICoVT時,進一步通過數字減影血管造影(Digital subtraction angiography,DSA)來確認血管異常。但DSA在診斷單純皮質靜脈血栓形成不具有明顯的優勢[2]。
綜上所述,常規MRI在ICoVT急性期較難做出診斷,如何在早期選擇恰當的影像檢查手段對診斷ICoVT尤為重要。彌散加權成像(Diffusion-weighted images,DWI)可觀察到靜脈腔內“血栓高信號”及血栓臨近部位“血栓磁敏感信號”[13]。血栓高信號多發生在超急性期和亞急性晚期[14],約41%的亞急性期 CVT患者在DWI上可觀察到靜脈腔內的高信號血栓[15]。而血栓磁敏感信號,多發生于急性-亞急性早期。因此,血栓高信號和血栓磁敏感信號同時評估,近80%的CoVT可能出現DWI陽性發現,這是對常規序列的重要補充[13]。其中,SWI對急性期CoVT的診斷敏感度最高,皮質靜脈血栓形成時,局部還原型血紅蛋白濃度增加,在磁敏感成像上表現為受累靜脈較為特征性的低信號改變,特別是在血栓形成的早期階段[16]。此外SWI還可顯示病灶內周圍代償擴張的靜脈(早期)和微出血(中晚期),提高ICoVT診斷率。因此,SWI是目前診斷ICVT最敏感的成像技術[17]。此患者復查的頭部DWI可觀察到“血栓高信號”,但是在明確診斷ICoVT后復習影像時才注意到,因此,ICoVT“直接”影像征象建立在臨床懷疑或診斷的基礎上更容易發現,故要保持ICoVT警惕性。
皮質靜脈血栓形成可導致靜脈高壓、水腫、梗死或出血等繼發性改變,稱為間接征象,通常位于皮質下,不符合典型的動脈供血區,符合相應的靜脈引流區。這些征象往往是首先被觀察到的或者是唯一的發現,CoVT腦實質性改變發生率大于CVT(84.3% vs 63%)[6]。CT可見腦溝消失、彌漫性腦實質水腫、灰白界限模糊、出血或腦室受壓[18]。腦實質的改變在MRI上更容易觀察,影像特征往往不符合典型動脈供血區,此外,輕微的瘀點出血,通常在CT上隱匿,往往在SWI更容易顯現。
與動脈源性腦梗死相比,許多繼發于靜脈閉塞的實質異常是可逆的。皮質靜脈梗死導致回流受阻,靜脈內壓力升高,形成血管源性水腫(ADC值升高),嚴重時可導致動脈灌注減低造成細胞毒性水腫(ADC值降低)[19]。血管源性水腫(ADC值升高)區域隨靜脈閉塞再通或側支開放往往是可逆的。然而,細胞毒性水腫(ADC值降低)區域,可殘留后遺病灶,也可能是可逆的,這與動脈源性梗死不同,其可能原因是由于腦血流減少、神經元腫脹和膜泵衰竭而沒有神經元死亡[20]。同動脈源性梗死一樣,可以利用CT perfusion(CTP)評估顱內靜脈閉塞腦實質病變區域灌注情況,病理生理學特征是灌注異常(MTT延長,CBF正常或降低,CBV增高、正常或降低)導致腦組織功能紊亂,而MRI、DWI可無異常腦實質發現[21]。雖然間接征象不具有特異性,但其異常的影像特征卻是首先引起關注的,它提示我們需要重視并積極尋找皮質和(或)靜脈竇血栓直接征象[11]。影像的動態變化與顱內靜脈血栓形成病理生理相關,由靜脈高壓到水腫到出血,影像表現為近皮質逐漸進展的白質血管源性水腫,合并腦出血或微出血。影像記錄了此患者發病整個過程,可以看到血管源性水腫、低灌注、微出血,以及治療后血管源性水腫逐漸消退。此患者CTP提示MTT延長,CBF降低,CBV降低,但對癥治療后患者頭部MRI除遺留部分皮質層狀壞死外基本完全回復,提示靜脈源性梗死與動脈源性梗死差異較大,預后較好,大多數情況下病灶可逆。
基于ICoVT的神經放射學表現的鑒別診斷包括動脈源性腦梗死、腦腫瘤、進行性多灶性白質腦病、可逆性后部腦病綜合征、可逆性腦血管收縮綜合征、原發性中樞神經系統血管炎、腦淀粉樣血管病相關性炎癥(CAA-I)等。因CAA-I和ICoVT在臨床表現和影像特征具有諸多相似性,尤其需要注意鑒別。CAA-I是血管壁對β淀粉樣蛋白(amyloid β-protein,Aβ)的炎性反應,Aβ沉積可引起血管內炎癥、血管周圍炎癥。以急性或亞急性精神狀態或行為異常、局灶性神經功能缺損、癲癇發作和頭痛為主要臨床表現。影像表現為MRI可見單發或多發白質高信號并延伸至皮質下白質,SWI皮質、皮質下出血性病灶(腦微出血、腦出血、皮質表面鐵沉積)[22]。雖然SWI對皮質靜脈血栓形成具有重要的診斷價值[23],但ICoVT和CAA-I影像表現上有存在相似性,包括近皮質白質病變、微出血、凸面蛛網膜下腔出血、低灌注,且皮質靜脈血栓“條索征”和蛛網膜下腔出血在SWI影像表現相似[24]。考慮到CAA-I往往需要大劑量類固醇激素沖擊治療[25],而激素是靜脈血栓形成危險因素[26],對于顱內靜脈血栓形成非治療基礎疾病的激素使用往往是無益的[27],同樣皮質靜脈血栓形成需要抗凝,而抗凝是CAA-I出血的危險因素[28]。然而有文獻指出CAA是靜脈血栓形成危險因素可存在共病[29]。此患者此次住院以精神行為異常為主要特征,除SWI外影像特征基本符合CAA-I,最終經SWI診斷為ICoVT,經抗凝治療后復查影像病灶消退,進一步支持ICoVT。
2.4 ICoVT治療和預后 根據CVT的治療指南[30],CoVT急性期推薦使用治療劑量的肝素或低分子肝素進行抗凝。急性期抗凝治療后,一般應繼續口服抗凝藥物,常用藥物為華法林,新型口服抗凝藥達比加群的療效和安全性與華法林類似,但比華法林使用方便[2]。抗凝治療的持續時間取決于病因學,對于可去除的誘發CVT抗凝3~6個月,對于危險因素不明CVT抗凝6-12個月,復發CVT或伴有嚴重遺傳性血栓形成的CVT考慮長期抗凝[2]。除抗凝治療外,潛在的病因也應進行篩查和管理。抗癲癇藥物不應常規給予預防,但如果癲癇發作應迅速開始[2]。ICoVT未見血管內治療報道[3],但CoVT合并靜脈竇血栓形成有血管內治療報道[9],部分ICoVT出現明顯占位性、顱高壓癥狀可去骨瓣減壓[3]。通常的總體預后良好,79%的ICoVT患者完全恢復[6],及時診斷和治療可能是良好預后和預防并發癥的關鍵。
綜上,ICoVT病因多為凝血功能異常,顱高壓癥狀在皮質靜脈血栓形成中不常見,多表現為癲癇、頭痛、精神行為異常等非特異性癥狀。明確的診斷通常是基于臨床懷疑,通過影像學證實。影像學SWI可見血栓低信號影、病灶內微出血及代償擴張靜脈影,DWI可見血栓高信號影,尤其是SWI對于皮質靜脈血栓形成診斷具有重要意義。尤其強調頭部MRI動態復查對于ICoVT亦具有重要指導意義,因皮質靜脈血栓形成靜脈壓增高致血管源性水腫,病灶呈動態進展:由皮質下白質向深部白質,抗凝治療后或血栓再通后血管源性水腫逐漸消退,如同“潮漲潮落”。因此,對于非特異性臨床表現,如癲癇、精神行為異常、認知障礙等,顱內病灶不符合經典動脈供血區并累及皮質,多種影像手段評估是必要的,尤其是SWI,有利于早期識別ICoVT。

