伴麻痹性癡呆的神經梅毒患者的臨床特征及診斷指標分析
丁琦超, 陸 悅, 孫 旭, 畢曉瑩
神經梅毒是由蒼白密螺旋體侵入神經系統造成的疾病,可以發生在梅毒的各個時期,晚期更加多見。其臨床表現多樣[1],按照受累部位分為間質性神經梅毒和實質性神經梅毒,前者包括腦膜血管型神經梅毒、腦膜炎型神經梅毒,后者主要包括GPI、脊髓癆等。目前大部分研究單純歸納GPI患者的臨床特征、影像學數據等,還有一些研究關注于GPI與其他類型癡呆的對比[2,3],但據了解,少有研究關注和探索有助于臨床醫師識別伴GPI神經梅毒患者的生物學標記物及影像學特征。本研究通過比較GPI患者與不伴GPI神經梅毒患者的臨床特征、實驗室及影像檢查結果,尋找有助于診斷伴GPI的神經梅毒患者的血清學指標,降低GPI在神經梅毒患者中的漏診率以及誤診率,實現早期診斷和治療。
1 對象與研究方法
1.1 本研究納入了2010年1月1日-2021年6月1日年間就診于海軍軍醫大學第一附屬醫院確診的104例神經梅毒患者的人口學資料、臨床癥狀、實驗室檢驗結果、影像學數據等,納入標準:(1)首先入組患者需符合神經梅毒的診斷標準:①CSF FTA-ABS(熒光梅毒螺旋體抗體吸收試驗)和/或VDRL(性病研究實驗室試驗)陽性,無法開展以上檢查時,可用TPPA(梅毒螺旋體明膠顆粒凝聚試驗)和TRUST(甲苯胺紅不加熱血清試驗)替代;②腦脊液中蛋白含量大于450 mg/L,白細胞數值大于5×106/L,且排除會造成以上指標異常的其他疾病[4]。(2)GPI患者符合以上神經梅毒的診斷,同時有認知功能受損和/或精神行為異常的臨床表現,使用蒙特利爾認知量表評估認知功能(Montreal Cognitive Assessment,MoCA)。排除標準:(1)患有其他可能影響認知功能的疾病,例如血管性癡呆、阿爾茲海默癥等;(2)患有其他精神障礙,例如精神分裂癥、抑郁癥等;(3)合并有艾滋病的患者。
1.2 研究分組 根據以上納排標準,將患者分為神經梅毒伴GPI患者組(n=59)與神經梅毒不伴GPI患者組(n=45)。
1.3 評估標準 利用MoCA量表評估患者的認知功能,主要包括:視空間與執行能力(5分)、命名能力(3分)、注意力與計算力(6分)、語言能力評定(3分)、抽象能力(2分)、延遲回憶(5分)及定向力(6分),如果受教育年限<12 y加1分,得分<26的患者被認定為存在認知功能障礙。
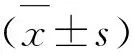
2 結 果
2.1 兩組患者的基本資料 兩組患者的年齡、性別、BMI、不潔性生活史、腦梗病史、高血壓病、糖尿病及高脂血癥等基本資料比較,差異均無統計學意義(P>0.05)(見表1)。

表1 兩組患者的基本資料比較(n=104)


表2 兩組患者的臨床表現對比(n=104)
2.3 兩組患者的實驗室檢驗結果 與不伴GPI組相比,伴GPI組患者外周血的中性粒細胞數、NLR、腦脊液蛋白含量更高,差異具有統計學意義(t中性粒細胞=-2.6,P中性粒細胞數=0.009,tNLR=-3.09,PNLR<0.001,t腦脊液蛋白=-2.73,P腦脊液蛋白含量=0.006)兩組患者外周血的紅細胞數目、白細胞數目、血小板、中性粒細胞數、淋巴細胞數、HDL、LDL、總膽固醇、肌酐、尿素、尿酸、腦脊液有核細胞數、腦脊液壓力等指標比較,差異無統計學意義(P>0.05)(見表3)。

表3 兩組患者的實驗室檢驗指標比較
2.4 兩組患者的頭部影像學特征 本研究納入的104例患者中,由于各種原因,最終有75例患者配合完成了頭部MRI的檢查,其中兩組患者影像學上最常見的表現是缺血性卒中(49例),但是伴GPI組缺血性卒中的類型以腔隙性腦梗死為主(23/26,88.46%),主要分布在額葉皮質下、基底節區、顳葉,而提示新發腦梗死的僅3例,梗死部位為側腦室旁(2例)、頂葉(1例);不伴GPI組MRI表現為缺血性卒中的患者以新發腦梗死為主(18/23,78.26%),梗死部位主要為側腦室旁(5例),基底節區(4例),顳葉(4例),腦干(4例),頂葉(2例),額葉(2例),枕葉(2例),小腦(1例)(見表4)。

表4 兩組患者頭部MRI表現
2.5 ROC曲線分析顯示血清中性粒細胞數的AUC值為0.679(95%CI0.56~0.79,P<0.05),NLR的AUC值為0.697(95%CI0.58~0.81,P<0.05),腦脊液蛋白的AUC值為0.648(95%CI0.52~0.77,P<0.05)(見圖1)。血清中性粒細胞診斷神經梅毒伴GPI的最佳界值為≥5.2×109/L,靈敏度50%,靈敏度81.1%,NLR的最佳界值為≥2.8,此時靈敏度為60.4%,特異度78.4%,腦脊液蛋白量的最佳界值為≥755 mg/L,靈敏度為54.2%,特異度為78.4%。我們分別將分類變量NLR≥2.8,腦脊液蛋白≥755 mg/L,臨床表現有無肢體無力作為自變量納入二元Logistic回歸方程[由于中性粒細胞的界值無明顯診斷意義(靈敏度50%),故未納入],得到兩變量(NLR+腦脊液蛋白含量)的預測模型的AUC可以達到0.746(95%CI0.64~0.85,P<0.001);另一兩變量(NLR+臨床表現有無肢體無力)預測模型的AUC值可以達到0.766(95%CI0.67~0.87,P<0.001);三變量(NLR+腦脊液蛋白含量+臨床表現有無肢體無力)的AUC值可以達到0.83(95%CI0.74~0.92,P<0.001)(見圖2)。

圖1 圖中為NLR,腦脊液蛋白含量,血清中性粒細胞數的ROC曲線

圖2 圖中為分類變量NLR≥2.8,腦脊液蛋白≥755 mg/L,臨床表現有無肢體無力,以及兩變量(NLR+腦脊液蛋白含量)的預測模型、兩變量(腦脊液蛋白含量+臨床表現有無肢體無力)、三變量(NLR+腦脊液蛋白含量+臨床表現有無肢體無力)的ROC曲線
3 討 論
GPI是神經梅毒晚期最常見的并發癥之一,約占神經梅毒病例的38.9%~49%,主要表現為進行性的認知障礙,常伴有精神行為異常[5]。但由于當今抗生素的廣泛使用,GPI的臨床癥狀越來越不典型,呈現多樣化,給臨床醫師的鑒別診斷工作增加困難,早期易被誤診為精神分裂癥、病毒性腦炎、情緒障礙等,有研究報道誤診率可達63.53%[6],大大增加了患者的醫療負擔,也不利于患者的預后。
本次研究發現不伴GPI組患者表現為肢體無力癥狀的比例顯著高于GPI組患者,納入二元Logistic回歸得到有無肢體無力的臨床表現可以作為伴GPI神經梅毒患者的獨立預測因素(OR=4.86,95%CI1.93-12.2)。結合兩組部分患者頭部MRI,不伴GPI組表現為新發腦梗死的患者顯著多于GPI組,且梗死部位多位于側腦室旁、基底節區、顳葉等大腦中動脈供血區,這與腦膜血管神經梅毒的特征影像學表現相符[7]。該區域受累較容易出現肢體無力、偏身感覺障礙等癥狀。從病理生理機制上講,腦膜血管型梅毒通常在感染梅毒螺旋體的早期(1~10 y)發病[8],由于蒼白螺旋體侵入患者腦膜,促使血管周圍淋巴漿細胞浸潤,造成局灶性動脈內膜炎,易發生腦卒中事件,大腦中動脈是最常見的受累動脈,發生率為66%[9]。而GPI則主要由于病原體入侵腦實質造成,其主要的病理改變是神經纖維損害和神經元的數量減少,常在感染梅毒螺旋體的晚期10~20 y發生[10],且發展為晚期神經梅毒的患者不一定出現過早期神經梅毒的臨床癥狀。兩組患者在心血管疾病風險因素上(高血壓、糖尿病、血脂、年齡、既往腦梗病史等)均不存在差異,所以我們推測這是兩組患者血管本身存在的病理生理狀態造成的。
根據我們的研究,神經梅毒患者腦脊液蛋白≥755 mg/L時,其伴發GPI的風險是腦脊液蛋白<755 mg的患者的5.02倍,而當NLR≥2.8時,伴發GPI的風險則是NLR<2.8的患者的4.31倍,但是這兩項指標預測神經梅毒患者伴發GPI的概率的AUC分別為0.66、0.68,預測價值較低,于是我們將兩項指標同時納入預測模型,得到雙變量模型的AUC為0.75(95%CI 0.64~0.85,P<0.001),有良好的預測價值,進一步將臨床表現有無肢體無力作為變量納入二元Logistic模型,最終得到的三變量模型(NLR+腦脊液蛋白含量+臨床表現有無肢體無力)的AUC可以達到0.831 (95%CI0.74~0.92,P<0.001),取得了更好的預測價值。GPI組患者的腦脊液蛋白含量要高于認知正常組,可能與GPI患者的腦(脊)膜中產生的炎癥反應更為劇烈[11],或者血腦屏障破壞的較為嚴重相關[12]。NLR是一種獲取容易,價格低廉的評價人體炎癥反應程度的指標,而且與中性粒細胞數目這單一指標相比,NLR不大容易受到體液失衡(如脫水)的影響,有研究發現NLR的水平與阿爾茲海默癥(AD)呈正相關[13,14],還與患MCI的風險增加呈正相關,且當NLR≥2.07時MCI的風險會比NLR<2.07的人群高6倍[15],還有研究發現NLR與情緒、精神障礙同樣存在相關[16],作為一種外周的血清學指標,它如何與認知損害相聯系還尚未研究清楚,有的假說認為NLR較高的患者的血管內皮損害更嚴重,加重動脈粥樣硬化,從而使得大腦內小動脈更容易產生梗死,引起腦白質的變性[17],較高水平的血清中性粒細胞數目,提示著人體內免疫系統的較高程度的激活,活化的中性粒細胞通過釋放多種細胞因子,激活其他免疫細胞,誘導其穿透血管內皮細胞,遷移至炎癥部位,啟動炎癥因子瀑布[18]。在這些機制作用下,GPI患者的中樞神經系統內促炎因子相對增多,進而誘發了大腦中免疫系統的異常激活,以及氧化應激反應,雖然這是機體的自身保護,但是也對顱內血管,大腦實質造成了損害[19,20]。
GPI的治療目前以青霉素為主,經過規范化治療,這種因梅毒螺旋體感染造成的“可逆性認知下降”往往可以得到改善。為了更好提高患者的遠期預后以及對治療的依從性,有研究指出在規范化驅梅治療的前提下,使用頭孢曲松鈉與阿立哌唑聯合治療在改善患者精神癥狀方面取得了良好的效果[21],GPI早期使用多奈哌齊也能通過抑制小膠質細胞的活化,增加乙酰膽堿的含量,來改善患者認知功能[22],由此看來,早期診斷GPI,并早期介入干預治療,可以使患者的治療效果大大提高。
本研究的限制:首先,最大的限制在于本研究是一項橫斷面研究,樣本量偏小,不同醫師對患者進行的臨床評估未能達到統一,且頭部MRI的數據缺失較多。其次,此次研究未能納入炎癥因子(如IL-1、IL-8、TNF-α等)數據進行進一步研究,而根據此次研究的結果,我們發現炎癥在GPI患者認知功能下降,精神情緒異常的發展進程中起著重要的作用,對炎癥因子的研究或許可以更好的揭示其中的關系。
本研究,最終我們總結出當神經梅毒患者血清中NLR≥2.8,腦脊液蛋白含量≥755 mg/L,且臨床表現不存在肢體無力時,我們應該警惕其伴發GPI的可能,早期對患者進行認知,精神行為量表的評估,及時施加藥物及非藥物干預,改善患者癥狀,以獲得更好的預后。此次研究我們發現GPI似乎與外周炎癥水平相關,而認知、情緒障礙與人體內炎癥水平的相關性已經在許多研究中得到驗證[23],未來仍有待對GPI患者的炎癥因子(IL-1、IL-8、TNF-α等)等指標進行分析,有利于尋找更有效、更有針對性的藥物。如今影像學飛速進展,利用靜息態功能磁共振(rsfMRI)、動脈自旋標記灌注成像(ASL)、PET/SPECT等成像技術的研究越來越多,利用這些影像技術研究GPI患者與其他神經梅毒患者,或者其他癡呆類型的患者的差異,可能也將會是未來研究的方向。

