黃芩莖葉-桑白皮配伍對脂多糖致急性肺炎大鼠TRPV1信號蛋白的影響
趙博,段廣靖,屈新亮,衛培峰,王斌,李敏(陜西中醫藥大學藥學院,陜西 咸陽 712046)
急性肺炎(acute pneumonia)是嬰幼兒多發的呼吸系統疾病,具有致病因素復雜、發病迅速、治療難度大和易引起機體呼吸功能衰竭等特點。急性肺炎與感染后難以控制的炎癥反應關系密切,預后極差,病理表現為肺組織炎癥、氧化損傷和細胞凋亡等,病死率高,占發病率半數以上,可發展為重癥肺炎,嚴重威脅患兒生命安全[1]。目前,國內外臨床上治療急性肺炎還是以抗菌藥物和激素為主,而長期濫用上述藥物會產生耐藥性,治療效果降低,且會產生不良反應[2]。因此,研究出安全系數高、不良反應少及臨床療效顯著的藥物是臨床治療的迫切需求。
中醫藥在急性肺炎治療方面優勢突出、療效確切。炎癥反應在急性肺炎的治療中備受重視,近年來有研究證實瞬時受體電位香草酸亞型1(transient receptor potential vanilloid 1,TRPV1)受體通道激活是誘發炎癥導致疼痛、咳嗽敏感性增高的重要機制之一[3]。本研究從急性肺炎的證型出發,基于中醫整體觀念和辨證論治的思想,選用黃芩莖葉-桑白皮配伍來考察對脂多糖(LPS)致急性肺炎大鼠的抗炎作用、量效關系和對TRPV1 熱敏感蛋白的影響。
黃芩莖葉味苦、性寒,主要成分為黃酮類,具有較好的抗炎、抗菌、抗病毒和解熱鎮痛的藥理作用;桑白皮味甘、性寒,具有宣肺平喘、利水消腫和止痛的功效,臨床上常以兩者配伍來增強黃芩清肺、瀉肺和平喘止咳的功效,用于肺熱壅盛、氣逆咳喘、咯痰黃稠等癥。現代藥物研究采用傅里葉中紅外光譜法、粉末X 射線衍射等方法對比了黃芩莖葉和桑白皮配伍前后主要藥效物質黃芩苷和雙香豆素的含量變化,并結合黃芩苷、雙香豆素及兩者結合物的溶解曲線,說明通過等比例混煎的方式,黃芩苷和雙香豆素可實現更高效地提取,藥效能夠充分發揮,闡述了兩者配伍的合理性[4]。目前尚無關于黃芩莖葉-桑白皮配伍治療急性肺炎的研究報道,故本研究選用已經成熟且易復制的LPS 誘導建立大鼠急性肺炎模型,探究不同劑量組黃芩莖葉-桑白皮配伍對大鼠急性肺炎的保護作用的可行性、量效關系和作用機制,為臨床急性肺炎提供新的治療方案和理論依據。
1 材料
1.1 實驗動物
健康SPF 級SD 雄性大鼠60 只,4 ~6 周齡,雄性,體質量(130±20)g [成都達碩實驗動物有限公司,許可證號:SCXK(川)2020-030]。
1.2 試藥
黃芩莖葉、桑白皮(亳州市京皖中藥飲片廠,批號:201102,經陜西中醫藥大學中藥鑒定教研室王繼濤教授鑒定為唇形科黃芩屬植物黃芩Scutellaria baicalensisGeorgi.的干燥莖葉和桑科植物桑Morus albaL.的干燥根皮)。LPS(美國Sigma 公司,批號:078M4040V);腫瘤壞死因子(TNF-α)試劑盒(批號:20210215)、白介素1β(IL-1β)試劑盒(批號:20210114)(上海酶聯生物科技有限公司);TRPV1 抗體(武漢博士德生物科技有限公司,批號:CX0125);BCA 蛋白濃度測定試劑盒(批號:WB0123)、ECL 超敏發光試劑盒(批號:WB0164)、SDS-PAGE 凝膠配置試劑盒(批號:WB0130)、一抗稀釋液(批號:WB0158)、二抗稀釋液(批號:WB0159)(上海威奧生物科技有限公司)。
1.3 儀器
ELX808 全自動酶標儀、電泳儀和轉膜儀(美國Bio-Tek 公司);高速臺式離心機(上海安亭科學儀器廠,型號:TGL-16B);小型垂直電泳槽(Bio-Rad 伯樂公司,型號:165-8001);電子分析天平(日本島津公司,型號:TE124S);FRESCO 21 高速冷凍離心機(美國Thermo Fisher Scientific公司);BX51 光學顯微鏡(日本OLYMPUS 公司);全波長酶標儀(ThermoFisher 公司,型號:Mutiskan GO);熒光定量PCR 儀(Roche 公司,型號:Roche480II);組織勻漿機(北京鼎昊源公司,型號:TL-1010S)。
2 方法
2.1 藥物制備
稱取干燥黃芩莖葉、桑白皮各50 g,混勻后加入1000 mL 純凈水浸泡30 min,武火加熱沸騰后,文火煎煮40 min,過濾后再加800 mL 純凈水文火煎煮30 min,合并兩次濾液,旋轉蒸發儀70℃濃縮至100 mL,過濾,制成含生藥量1 g·mL-1的濃縮液,4℃冷藏備用[5]。
2.2 分組、給藥及造模
大鼠適應性飼養4 d [飼養環境室溫(24±2)℃,自由攝食和飲水,相對濕度40%~50%,晝夜交替]后,按體質量隨機分為6 組:空白組,模型組,陽性組(阿莫西林克拉維酸鉀片,85 mg·kg-1),黃芩莖葉-桑白皮配伍高、中、低劑量組(16、8、4 g·kg-1,給藥濃度1 g·mL-1),每組10 只。空白組和模型組灌胃生理鹽水(10 mL·kg-1),連續灌胃10 d,1 次·d-1。末次給藥2 h 后,除空白組外其余各組均于大鼠尾靜脈注射LPS(6 mg·kg-1)建立急性肺炎模型[6]。
2.3 動物處理
造模6 h 后采用乙醚麻醉,仰臥位固定大鼠,分離腹主動脈取血,3000 r·min-1離心15 min后,用移液槍吸取血清于-20℃冷藏保存;剪開頸部暴露氣管,剪開胸腔用止血鉗夾住右主支氣管,用5 mL 注射器吸取3 mL 磷酸鹽緩沖液(PBS)進行左支氣管肺泡灌洗,灌洗兩次,每次停留30 s,合并兩次肺泡灌洗液(BALF),3000 r·min-1離心10 min 后分離上清液和沉淀物待測;灌洗結束后,斷離右肺,計算濕/干質量比值;采集大鼠肺組織進行后續檢測。
2.4 大鼠右肺組織濕/干質量(W/D)比值測定
將斷離的右肺清除表面粘連組織,用生理鹽水漂洗,濾紙吸干肺表面液體,稱濕質量,后置于60 ℃烘箱72 h 至恒重,取出稱干質量,計算濕/干質量(W/D)比值,判斷肺組織水腫程度。
2.5 大鼠BALF 中蛋白含量和中性粒細胞數測定
將BALF 離心后,分離上清液并取0.5 mL,按BCA 蛋白濃度測定試劑盒說明書操作進行蛋白含量測定;沉淀物用生理鹽水稀釋至3 mL,4℃1500 r·min-1離心10 min,用移液槍吸取45 μL細胞懸浮液于涂片上固定,干燥后瑞氏染色[7],置200 倍倒置顯微鏡下進行中性粒細胞計數。
2.6 酶聯免疫吸附法(ELISA)法測定BALF 中IL-1β、TNF-α 炎癥因子水平
取離心后的BALF 上清液,用ELISA 法按照試劑盒說明書操作步驟進行IL-1β、TNF-α含量的測定。
2.7 ELISA 法測定血清中IL-1β、TNF-α 炎癥因子水平
取離心后的血清,用ELISA 法按照試劑盒說明書操作步驟進行IL-1β、TNF-α含量的測定。
2.8 肺組織病理半定量分析
大鼠剪開胸腔,取肺組織,于4%多聚甲醛中固定48 h,脫水,石蠟包埋,切片(片厚4 μm),經HE 染色,中性樹膠封片后在光學顯微鏡下觀察肺組織周圍炎癥細胞浸潤狀況、腔內有無滲出物和肺間質炎癥等病理改變。參考文獻[8]的肺組織評分指標(肺泡充血程度、出血、肺間質中性粒細胞浸潤、肺泡細胞壁增厚)進行評分(0 分:極輕度損傷;1 分:輕度損傷;2 分:中度損傷;3:重度損傷;4 分:嚴重損傷)。將4項指標的5 個等級得分加和作為總分。由3 名病理科醫師分別對每組肺組織損傷程度進行評分,取其平均值。
2.9 RT-PCR 法檢測肺組織中TRPV1 的mRNA表達水平
加入1 mL Trizol 試劑提取大鼠肺組織總RNA,反轉錄進行cDNA 合成,以β-actin 為內參,檢測大鼠TRPV1 的mRNA 表達水平。引物由NCBI Primer-blast 公司設計,蘇州金唯智生物科技有限公司合成,引物序列:TRPV1 上游:5'-AGCGAGTTCAAAGACCCAGA-3',下游:5'-GTGTCATTCTGCCCATTGTG-3';β-actin 上游:5'-CTAAGGCCAACCGTGAAAAG-3',下游:5'-TACATGGCTGGGGTGTTGA-3';反應條件:95℃預變性2 min;95℃變性5 s,60℃退火10 s,共45 個循環。擴增完畢后進行溶解曲線分析,按2-△△Ct法計算TRPV1基因的相對表達量。
2.10 Western blot 法檢測肺組織中TRPV1 的蛋白表達
取大鼠肺組織加入RIPA 組織裂解液,充分研磨制備勻漿后(12 000 r·min-1,4℃)離心5 min,分離上清液,按BCA 蛋白濃度測定試劑盒說明書操作步驟測定蛋白含量。配制10%分離膠10 mL 和5%濃縮膠5 mL,上樣后進行SDS 聚丙烯酰胺凝膠電泳,先用70 V 恒壓電泳,約30 min后當指示劑溴酚藍進入分離膠后改用90 V 恒壓電泳。電泳結束后,將電泳儀置于冰水條件下200 mA 恒流轉膜70 min,將蛋白轉至PVDF 膜上,放入5% BSA 室溫封閉2 h,TBST 潤洗3 次后,與一抗結合,4℃孵育過夜,洗膜,加入二抗室溫孵育2 h,洗膜后采用增強型ECL 化學發光法顯色,掃描灰度值,計算TRPV1 蛋白相對表達量。
2.11 統計學處理
采用SPSS 24.0 軟件包進行統計學處理,實驗數據以x±s表示,用單因素方差分析進行組間比較檢驗,LSD 法進行檢驗后多重比較,P<0.05 表示差異具有統計學意義。
3 結果
3.1 對大鼠右肺組織W/D 比值的影響
結果如表1 所示,與空白組相比,模型組大鼠的右肺組織W/D 比值顯著升高(P<0.01),表明急性肺炎造模成功,肺水腫程度加劇。與模型組相比,陽性組W/D 顯著性降低(P<0.01),預給藥黃芩莖葉-桑白皮配伍不同劑量組能不同程度改善肺水腫狀態,其中高、中劑量組降低更為明顯(P<0.01),且表現出對急性肺炎的保護作用呈劑量依賴性關系。
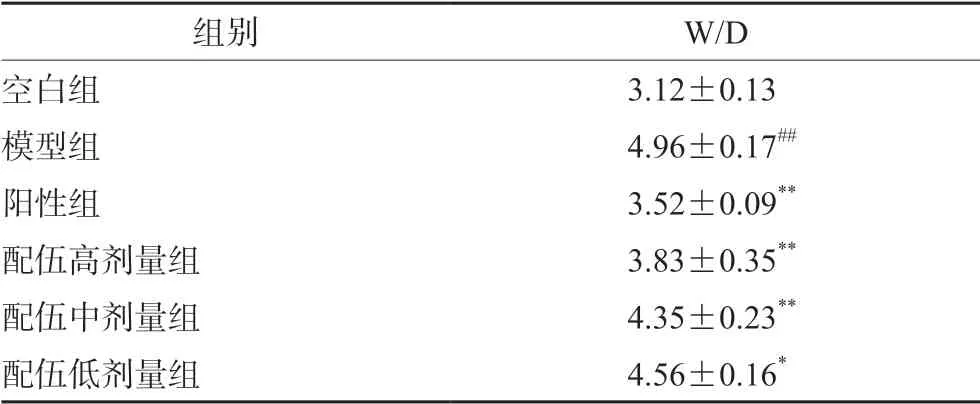
表1 大鼠右肺組織的W/D 比值 (n =10,x±s)Tab 1 W/D value of the right lung tissue in rats (n =10,x±s)
3.2 對大鼠BALF 中蛋白含量與中性粒細胞數的影響
結果見表2,與空白組相比,模型組大鼠靜脈注射LPS 后BALF 中的蛋白含量和中性粒細胞數顯著增加(P<0.01),表現出急性炎癥反應,說明造模理想;與模型組相比,陽性組能顯著降低BALF 中蛋白含量和中性粒細胞數(P<0.01),黃芩莖葉-桑白皮配伍各劑量組均能不同程度降低BALF 中的蛋白含量和中性粒細胞數,其中高、中劑量組效果顯著(P<0.01 或P<0.05)。
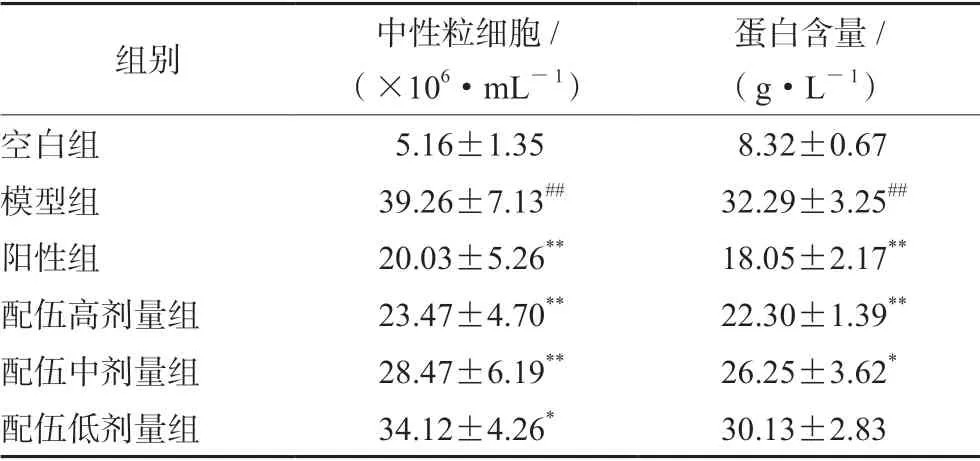
表2 BALF 中蛋白含量和中性粒細胞數(n =10,x±s)Tab 2 Protein content and neutrophil count in BALF (n =10,x±s)
3.3 對BALF 中IL-1β、TNF-α 炎癥因子水平的影響
如表3所示,與空白組相比,模型組BALF 中IL-1β、TNF-α炎癥因子含量顯著增加(P<0.01)。與模型組相比,黃芩莖葉-桑白皮配伍各劑量組TNF-α含量均不同程度降低(P<0.01),黃芩莖葉配伍高、中劑量組IL-1β含量顯著降低,且表現出對急性肺炎的保護作用呈劑量依賴性關系;陽性組IL-1β、TNF-α炎癥因子水平顯著降低(P<0.01)。
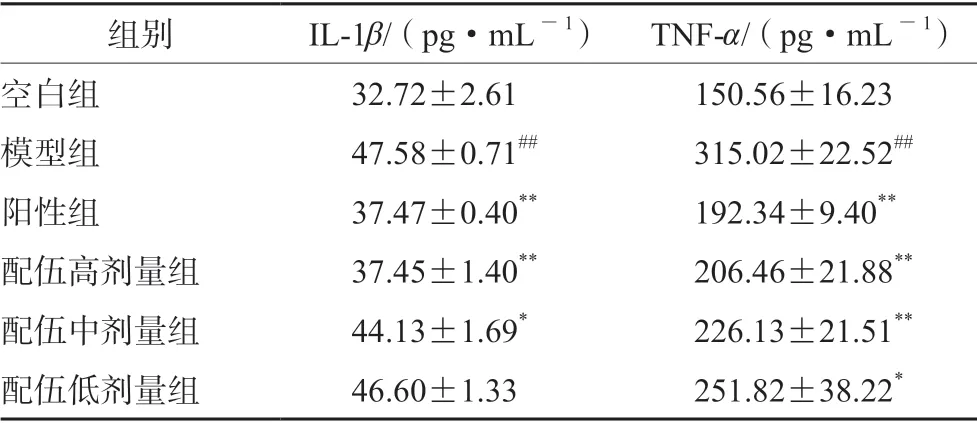
表3 BALF 中IL-1β、TNF-α 炎癥因子水平(n =10,x±s)Tab 3 IL-1β and TNF-α inflammatory factors in BALF (n =10,x±s)
3.4 對血清中IL-1β、TNF-α 炎癥因子含量的影響
如表4 所示,與空白組相比,模型組血清中IL-1β、TNF-α炎癥因子含量顯著升高(P<0.01);與模型組相比,陽性組和黃芩莖葉-桑白皮配伍高、中劑量組IL-1β和TNF-α含量顯著降低(P<0.01)。

表4 血清中IL-1β、TNF-α 炎癥因子水平 (n =10,x±s)Tab 4 IL-1β and TNF-α inflammation factor levels in the serum(n =10,x±s)
3.5 肺組織病理變化
空白組大鼠肺組織結構完整,肺泡腔清晰可見,無炎性細胞滲出和肺泡壁增厚等病理變化。相較于空白組,LPS 誘導的急性肺炎模型組大鼠肺泡腔結構不清晰,腔內有大量紅細胞、中性粒細胞滲出、肺間質水腫明顯和肺泡壁明顯增厚等病理學變化。與模型組相比,陽性組明顯改善肺組織病變程度,中性粒細胞等炎性細胞滲出減少、肺間質水腫明顯減輕。預給藥黃芩莖葉-桑白皮配伍各劑量組對大鼠肺組織的病理損傷均有不同程度的改善,高劑量組肺泡腔結構清晰、腔內基本無紅細胞和中性粒細胞滲出,肺泡間質水腫、增生明顯改善;中劑量組對肺組織損傷有改善作用,肺組織結構完整,腔內無紅細胞和中性粒細胞滲出,肺泡間質水腫減輕;低劑量組肺組織肺泡腔中可見少許中性粒細胞和紅細胞滲出,肺間質水腫、增生略有減輕[9]。肺組織病理變化見圖1,各組肺組織病理半定量評分見圖2。
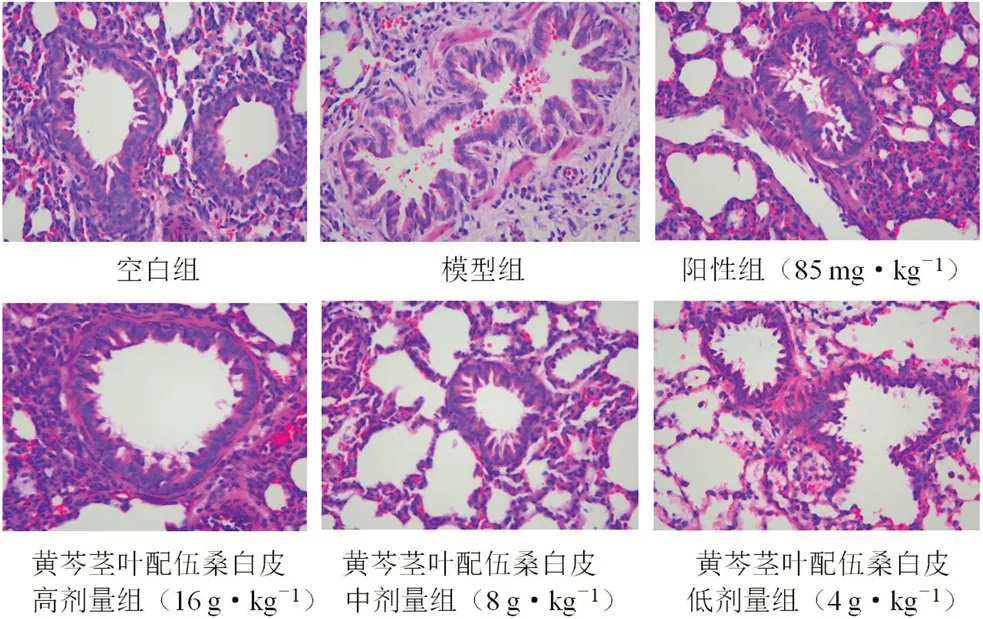
圖1 大鼠肺組織病理形態學變化(HE,×400)Fig 1 Pathomorphological changes in the lung tissue of rats(HE,×400)
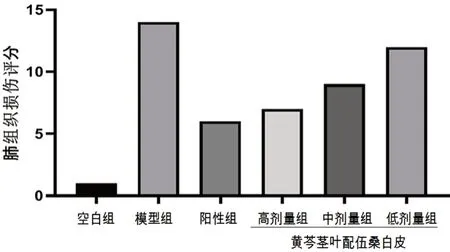
圖2 各組大鼠肺組織病理評分Fig 2 Pathological scores of lung tissues of rats in each group
3.6 大鼠肺組織TRPV1 mRNA 表達的影響
如圖3 所示,與空白組相比,LPS 致急性肺炎模型組大鼠肺組織中TRPV1 mRNA 的含量差異具有統計學意義(P<0.01);與模型組相比,陽性組肺組織中的TRPV1 mRNA 表達受到抑制,各劑量黃芩莖葉-桑白皮配伍給藥組大鼠肺組織TRPV1 mRNA 表達不同程度得到抑制,含量差異具有統計學意義(P<0.01 和P<0.05)。

圖3 大鼠肺組織中TRPV1 mRNA 表達的影響Fig 3 TRPV1 mRNA expression in the lung tissue of rats
3.7 大鼠肺組織中TRPV1 蛋白表達水平的影響
如圖4所示,相較于空白組,LPS 致急性肺炎大鼠肺組織中TRPV1 蛋白表達水平升高(P<0.01)。與模型組相比,陽性組能顯著降低TRPV1 蛋白的表達(P<0.01),黃芩莖葉-桑白皮配伍各劑量組均能不同程度抑制TRPV1 的表達,其中高、中劑量組降低TRPV1 蛋白具有顯著性(P<0.01)。
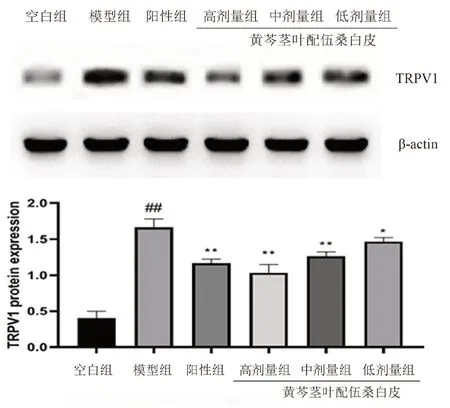
圖4 大鼠肺組織中TRPV1 的蛋白表達Fig 4 Protein expression of TRPV1 in the lung tissue of rats
4 討論
急性肺炎是小兒時期常見的一種呼吸道疾病,治療不及時轉為重癥肺炎在嬰幼兒死亡中占有很大比例。LPS 是革蘭氏陰性菌細胞壁的主要成分,用LPS 尾靜脈注射誘導建立的急性肺炎大鼠模型能夠誘發機體炎性細胞浸潤、炎性因子釋放和肺組織正常生理結構改變等病理變化,引起肺組織急性炎癥損傷。研究表明IL-1β、TNF-α炎性因子是巨噬細胞活化的生物標志物,作為急性炎癥反應過程中的重要因子,在LPS 誘導的急性肺炎發病機制中起著重要作用[10]。IL-1β是一種關鍵的促炎細胞因子,廣泛參與自身免疫性炎癥反應和多種細胞活動,在病毒、細菌、真菌和寄生蟲感染的患者體內含量激增,可以促進β防御素-4 的生成,是炎癥和宿主對感染反應最重要的介質之一[11];TNF-α是一種多向性的促炎細胞因子,主要由巨噬細胞、NK 細胞和T 細胞產生,參與局部炎癥并通過TNFR1 和TNFR2 兩種受體傳遞信號[12]。臨床上包括糖皮質激素在內的多種治療手段對于急性肺炎的治療中都未能顯現出較強優勢,從而凸顯了確定新的藥物靶點和開發新的治療藥物的必要性[13]。TRPV1 是瞬時受體電位家族(TRP)的重要成員之一,在呼吸系統的下氣道、肺實質和氣道上皮細胞間隙或氣道黏膜基底均有分布,外源性刺激因素和內源性炎癥因子可直接或間接導致TRPV1 的激活[14]。研究還表明TRPV1 激活是急性肺炎臨床表現的關鍵調節因子,抑制TRPV1蛋白有助于控制大鼠急性肺炎的發病進程[15]。現代研究證實,TRPV1 蛋白在急性炎癥中的保護作用機制可能涉及多條通路,在介導炎癥性熱敏感中發揮核心作用[16]。目前廣泛認同的機制有兩種:一是TRPV1 激活后可能直接作用于炎性介質,TRPV1基因敲除會使炎性反應失控[17];二是TRPV1 的激活會促進降鈣素基因相關肽(CGRP)和P 物質等與炎癥反應相關的神經肽的釋放,而炎癥反應的持續是由神經遞質介導釋放的,從而起到抑制炎癥的作用[18]。急性肺炎模型中存在TRPV1 的激活,這一假說在實驗中也得到證實。近些年研究證實TRPV1蛋白中的Ser-502 和Ser-800 是蛋白激酶C(protein kinase C,PKC)特異性磷酸化位點[19],PKC 對TRPV1 的特異性磷酸化表現在既能促進辣椒素引起的反應,也能降低炎癥熱刺激導致TRPV1 激活的閾值[20]。實驗中尾靜脈注射LPS 后,肺組織易受炎癥損傷產生促炎細胞因子IL-1β通過G 蛋白偶聯受體引發細胞內級聯反應,激活PKC 進而使Ser-800 特異性磷酸化,磷酸化后的TRPV1 受體被激活,細胞Ca2+內流產生去極化進而導致炎性反應引起的熱痛覺過敏[21]。為進一步研究TRPV1 對LPS 誘導的急性肺炎大鼠炎癥作用及可能的作用方式,本文采用RT-PCR 和Western blot 分別從基因和蛋白層面檢測了各組大鼠肺組織中的TRPV1 mRNA 相對表達量和TRPV1 蛋白表達的變化。結果顯示正常組大鼠肺組織中的TRPV1 mRNA 和蛋白表達不明顯,表明TRPV1 在正常情況下可能不參與機體炎性反應調節。LPS 致急性肺炎引起肺組織中TRPV1 mRNA和蛋白表達量顯著升高,黃芩莖葉-桑白皮配伍各劑量組能不同程度抑制TRPV1 信號通道,使神經元所受刺激信號減少,進而使TRPV1 mRNA 和蛋白表達量減少[22]。本研究結果還顯示黃芩莖葉-桑白皮配伍可以降低BALF 和血清中促炎因子IL-1β、TNF-α的水平,減少巨噬細胞、中性粒細胞數等炎性細胞數量,這有力表明了黃芩莖葉-桑白皮配伍對急性肺炎具有保護作用。
綜上所述,TRPV1 通過調節促炎因子的表達,在急性肺炎的發病機制中發揮重要作用。此外,課題組還發現黃芩莖葉-桑白皮配伍可通過抑制TRPV1 對LPS 誘導的急性肺炎具有保護作用。在下一步研究中,將通過對急性肺炎中TRPV1 調控的下游分子進行鑒定[23],會有助于更好地理解TRPV1 調控急性炎癥反應的準確機制,抑制TRPV1 或下游重要靶點將會為急性肺炎提供新的、有效治療途徑。

