羥基紅花紅色素A抑制氧化應激和細胞凋亡改善OGD/R誘導的HT22細胞損傷
袁美玲,張云,王艷,汪寧*(1.安徽中醫藥大學藥學院,合肥 230012;2.安徽省中藥研究與開發重點實驗室,合肥 230012;3.安徽省中醫科學院中藥藥效與安全性評價研究所,合肥 230012)
腦卒中又稱中風,是一種急性腦血管疾病,主要包括缺血性卒中和出血性卒中,其中缺血性卒中約占所有卒中發病率的80%以上。缺血性卒中是指腦部血管阻塞或破裂,腦組織血流量減少,致使神經功能受損,引起腦部病變,常見于中老年人群中,具有高致殘、高復發、高致死的特點,且近年來發病率逐年提升[1]。目前,組織型纖溶酶原激活劑(tPA)進行溶栓治療效果顯著,但由于治療時間窗的存在,使得及時進行溶栓治療受到限制[2]。在現代研究中,缺血性腦損傷涉及的病理機制十分復雜,涉及多種生物活性分子及細胞內信號轉導通路,如大量神經細胞程序性死亡、腦組織能量代謝障礙、細胞內鈣超載,活性氧大爆發、氧化應激等[3]。因此,抑制神經細胞凋亡、抗氧化應激對于防治缺血性卒中具有重要意義。
缺血性卒中屬于中醫“中風”范疇,“腦脈”阻塞,血凝脈內之瘀血是缺血性中風的主要病機之一,故究其本質仍屬血瘀證。活血化瘀是血瘀證的特有治法。運用活血化瘀藥祛除瘀血、疏通血脈、暢通血流,可改善血液循環、止血和促進血液吸收及改善神經營養等作用;促進血腫吸收和側支循環建立,減輕及恢復損傷的神經功能,對缺血性中風的治療有極其重要的意義。中藥紅花被用于治療心腦血管疾病100 多年,并且正式列入《中國藥典》。羥基紅花黃色素A(HSYA)既是中藥紅花藥理功效的最有效水溶性部位,也是紅花活血化瘀的有效成分,具有活血化瘀,改善血液循環的功效。已有研究表明,HSYA 的神經保護作用與減輕氧化應激有關[4]。課題組前期研究表明,HSYA 能夠透過血腦屏障進入腦脊液中,并且對氧糖剝奪/復糖復氧(OGD/R)損傷的腦微血管內皮細胞具有一定的保護作用[5]。目前公認的模擬體內缺血缺氧模型為對細胞進行OGD/R 處理[6],因此在缺血性卒中發病機制的研究中多采用HT22 細胞的體外OGD/R 模型,從而為缺血性卒中的治療提供一定的理論依據。
1 材料
1.1 試藥
小鼠海馬神經元HT22 細胞(中科院上海細胞生物所),HSYA(成都德斯特,純度≥98%,結構式見圖1);LDH 毒性檢測試劑盒、超氧化物歧化酶(SOD)活性檢測試劑盒、總谷胱甘肽(GSH)試劑盒、丙二醛(MDA)試劑盒(Beyotime);增強型細胞增殖毒性檢測(CCK-8)試劑盒、一氧化氮(NO)試劑盒、活性氧(ROS)(碧云天);小鼠細胞色素C(CytC)酶聯免疫分析試劑盒(江萊生物,JL13261),Hoechst 33258 染色試劑(美國Sigma 公司,B2833);FITC Annexin V 細胞凋亡檢測試劑盒(美國 BD Biosciences 公司,7312712);cleaved-caspase3、Bax、Bcl-2(ZENBIO);HRP 標記山羊抗小鼠 IgG、HRP 標記山羊抗兔IgG(Spark-Jade);DMEM 培養基(Gibco,8121278);胎牛血清(FBS,BI,04-001-1ACS);青霉素和鏈霉素(Beyotime,C0222);TRIZOL 試劑(Thermo Fisher,15596026);ReverTra Ace Q-PCRT Master Mix、SYBR Green Realtime PCR Master Mix(TOYOBO)。
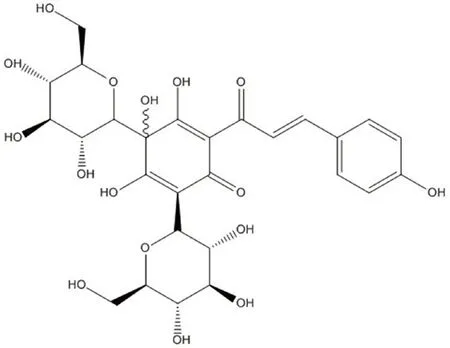
圖1 HSYA 分子結構式Fig 1 Molecular formula of HSYA
1.2 儀器
371 型CO2培養箱、Heracell VIOS160i 型CO2培養箱、1500 型全波長酶標儀(美國 Thermo Scientific 公司);TDL-5 型飛鴿臺式離心機(上海安亭科學儀器廠);Countstar 型細胞計數儀(艾利特國際有限公司);倒置顯微鏡(日本Olympus 公司);熒光顯微鏡(德國Leica 公司);電泳儀和轉膜儀(美國 Bio-Rad 公司);凝膠成像系統(美國General Electric 公司);流式細胞儀(美國Beckman 公司)。
2 方法
2.1 HT22 細胞的培養
采用常規細胞培養方法復蘇HT22 細胞,后用含10%胎牛血清的DMEM 高糖培養基將細胞稀釋至一定密度后置于37 ℃、5%CO2恒溫培養箱中培養。約2 ~3 d 傳代一次,取對數生長期細胞進行后續實驗。
2.2 OGD/R 損傷HT22 模型的建立[7]
胰酶消化正常狀態的HT22 細胞種板,細胞貼壁后,吸出培養液,用PBS 輕輕搖晃潤洗細胞3 次,加入無糖培養液,將細胞轉移到缺氧小室(95%N2和5%CO2)中氧糖剝奪6 h,棄去無糖培養液,用PBS 洗3 次后加入完全培養液,于常規培養箱(37 ℃、5% CO2)中培養12 h。
2.3 HSYA 對OGD/R 損傷HT22 的濃度篩選
取正常狀態的HT22 細胞接種于96 孔板中,密度為1×105個·mL-1,細胞貼壁后,吸出培養液,PBS 潤洗3 次,隨機分組,正常組加入新的完全培養液,常規培養;OGD/R 組和給藥組加入無糖培養液,氧糖剝奪6 h,吸出無糖培養液,OGD/R 組加入完全培養液,給藥組分別加入不同濃度的HSYA(5、10、20、40、60、80、100、120、140 μmol·L-1),在37℃、5%CO2培養箱中培養12 h 后,加入10 μL CCK-8 溶液,繼續培養1 h,避光下,用酶標儀測定450 nm 處各孔吸光度值,計算細胞增殖活力。
2.4 分組及給藥
將細胞隨機分為5 組:正常組,模型組(OGD/R),HSYA 低、中、高劑量(40、60、80 μmol·L-1)組,模型組造模6 h 后加入完全培養液培養12 h,給藥組造模6 h 后分別加入不同濃度的HSYA(40、60、80 μmol·L-1)培養12 h,正常組在常規培養箱培養相同時間后加入相應培養液。
2.5 倒置顯微鏡觀察HT22 細胞形態學變化
將細胞以每孔3×105個細胞接種到6孔板中,根據分組分別造模和給藥后,用倒置顯微鏡觀察各組細胞形態。
2.6 HT22 細胞上清液中LDH、NO 含量的檢測
將細胞以每孔1×105個接種到96 孔板中,根據分組分別造模和給藥后,收集細胞上清液,根據LDH、NO 試劑盒說明,檢測細胞上清液中LDH、NO 的含量。
2.7 SOD 活性、GSH 活性、MDA 水平
將細胞以每孔1×105個接種到96 孔板中,根據分組分別造模和給藥后,吸棄各孔細胞上清液。根據各試劑盒說明,檢測SOD 活性、GSH活性、MDA 水平。
2.8 熒光倒置顯微鏡觀察細胞內ROS 熒光強度
將細胞以每孔3×105個接種到6 孔板中,根據分組分別造模和給藥后,吸棄各孔細胞上清液。加入適量DCFH-DA 10 μmol·L-1覆蓋各孔細胞的體積,常規孵育20 min 后PBS 漂洗細胞2次,充分洗凈未與細胞結合的DCFH-DA 后,采用熒光倒置顯微鏡觀察各組細胞熒光強弱。
2.9 Hoechst33258 染色檢測細胞凋亡
將細胞以每孔3×105個接種到6 孔板中,根據分組分別造模和給藥后,室溫下加入多聚甲醛固定20 min,移去多聚甲醛后PBS 潤洗3 次后加入Hoechst 33258 染液孵育15 min,最后用熒光倒置顯微鏡觀察細胞。
2.10 流式細胞術檢測細胞凋亡率
將細胞以每孔1×106個接種到6 孔板中,根據分組分別造模和給藥后,根據Annexin V-FITC細胞凋亡檢測說明書進行操作,用流式細胞儀上機測定,并通過Flow Jo7.6 計算各組細胞凋亡率。
2.11 ELISA 法檢測細胞胞漿中CytC 的釋放
細胞前處理同“2.7”項下。依據酶聯免疫試劑盒,450 nm 波長下測各孔吸光度值,通過標準曲線計算CytC 的含量。
2.12 Western blot 檢測Bax、Bcl-2 和cleavedcaspase-3 的蛋白表達
根據實驗分組分別處理細胞后,采用 BCA 法定量并調整各組細胞蛋白濃度。隨后通過 SDSPAGE 電泳,并轉移到PVDF 膜上。5%脫脂奶粉在室溫下封閉2 h 后,分別與對應的一抗孵育過夜,次日將膜漂洗并與 HRP 標記的二抗(1∶10 000)在室溫下孵育2 h。最后TBST 漂洗3次,使用凝膠成像系統,用顯影液進行信號檢測,并通過AlphaVIEW SA 軟件分析蛋白質條帶。
2.13 qRT-PCR 檢測Bax 和Bcl-2 的mRNA 含量
用Trizol 試劑處理HT22 細胞,提取總RNA。使用ReverTra Ace Q-PCRT Master Mix 試劑盒將RNA 反轉錄成cDNA,再根據SYBR Green Realtime PCR Master Mix 使用PCR 儀器(Stratagene,San Diego,CA,USA,MX3000P)定量mRNA含量。用2-ΔΔCt法計算相對基因表達水平。
Bax:Forward,GTCGCCCTTTTCTACTTCGC;Reverse,ATGGTGAGTGAGACGGTGAG;
Bcl-2:Forward,TCGCAGAGATGTCCAGTCAG;Reverse,ATCTCCCTGTTGACGCTCTC;
β-actin:Forward,AACAGTCCGCCTAGACC;Reverse,CGTTGACATCCGTAAAGACC.
2.14 統計學分析
實驗結果以均數±標準差(±s)表示,采用單因素方差分析(ANOVA)進行組間均數比較,所有數據分析采用SPSS 23.0 處理,P<0.05表明差異有統計學意義。
3 結果
3.1 OGD/R 不同時間點對HT22 細胞增殖活力的影響
為觀察OGD/R 損傷HT22 細胞模型的具體效應,實驗選取OGD 處理6 h 復糖復氧3、6、12、24、48 h 5 個時間點,采用CCK8 法檢測細胞存活率。結果如圖2 所示,OGD 處理6 h 后,細胞存活率下降。復糖復氧0 ~48 h,OGD/R 組細胞存活率顯著降低(P<0.01),在0 ~12 h 呈下降趨勢,并于12 h 達到最低。所以后續實驗選擇復糖復氧12 h。
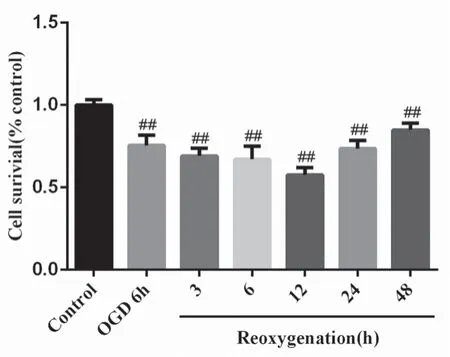
圖2 OGD/R 最佳造模時間篩選(x ±s,n =6)Fig 2 Optimal molding time of OGD/R(x ±s,n =6)
3.2 HSYA 對OGD/R 損傷HT22 細胞的有效濃度篩選
結果如圖3 所示,與正常組相比,OGD/R 組細胞存活率顯著降低(P<0.01);與OGD/R 組相比,HSYA 各濃度組(20、40、60、80、100 μmol·L-1)可提升細胞存活率(P<0.05,P<0.01)。綜合結果,選擇40、60、80 μmol·L-1分別作為HSYA的低、中、高劑量組。
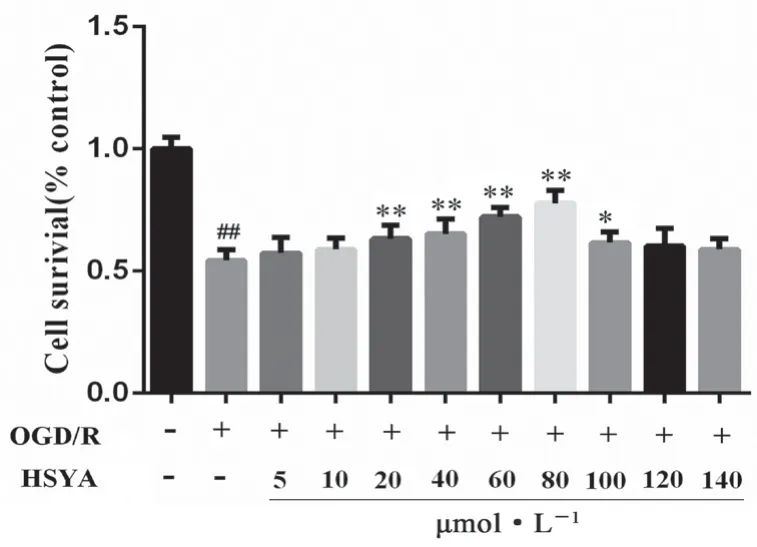
圖3 HSYA 有效濃度篩選(x±s,n =6)Fig 3 Effective concentration screening of HSYA( x ±s,n =6)
3.3 HSYA 對OGD/R 損傷HT22 細胞LDH 釋放的影響
結果如圖4 所示,與正常組相比,OGD/R 組LDH 的釋放量顯著增加(P<0.01);HSYA 各劑量組細胞上清液中的LDH 釋放量均低于OGD/R 組(P<0.01)。
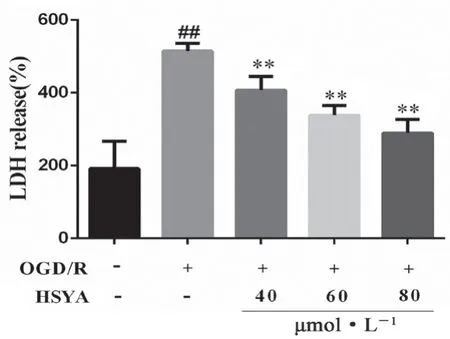
圖4 HSYA 對OGD/R 損傷HT22中LDH 釋放的影響(x± s,n=6)Fig 4 Effect of HSYA on LDH release in HT22 cells after OGD/R injury(x ±s,n =6)
3.4 HSYA 對OGD/R 誘導的 HT22 細胞形態的影響
正常組HT22 細胞呈長梭形,較為飽滿,貼壁狀態較好;OGD/R 組細胞變圓、皺縮,稀疏脫落;HSYA 作用后HT22 細胞貼壁數目增多,折光性增強,見圖5。
3.5 HSYA 對OGD/R 損傷HT22 細胞NO、MDA、SOD、GSH 含量的影響
與正常組相比,OGD/R 組HT22 細胞NO、MDA含量顯著增多,GSH、SOD 活性降低(P<0.01);而與OGD/R 組相比,HSYA 各劑量組中NO、MDA的含量顯著降低,GSH、SOD 活性升高(P<0.05,P<0.01),提示HSYA 可有效改善細胞氧化應激損傷,如圖6 所示。

圖6 HSYA 對OGD/R 損傷HT22 細胞中NO、MDA、SOD 及GSH 含量的影響(x ±s,n =6)Fig 6 Effect of HSYA on the content of NO,MDA,SOD and GSH in HT22 cells damaged by OGD/R(x ±s,n =6)
3.6 HSYA 對OGD/R 損傷HT22 細胞ROS 熒光強度的影響
如圖7 所示,與正常組相比,OGD/R 組細胞產生較強的綠色熒光,說明造模后HT22 細胞內ROS 的水平升高;與OGD/R 組相比,HSYA 各劑量組細胞熒光強度逐漸減弱,由此可知HSYA可有效的降低細胞內ROS 的水平。
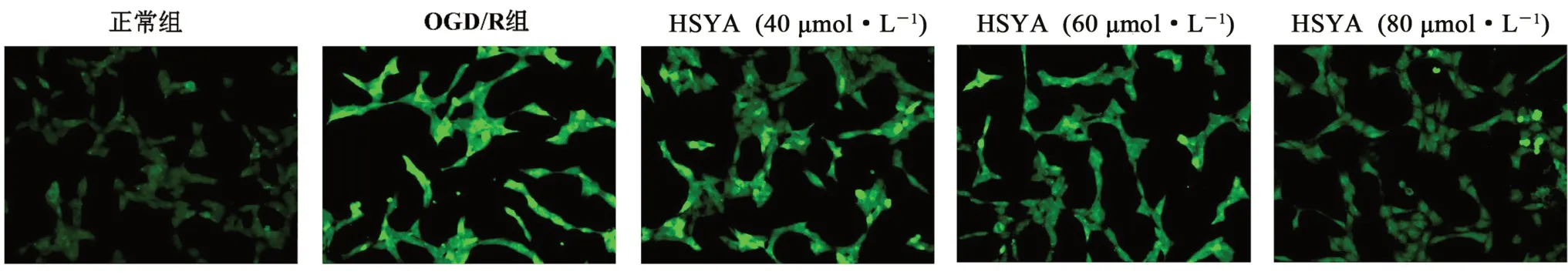
圖7 HSYA 對OGD/R 損傷HT22 細胞ROS 熒光強度的影響(×400)Fig 7 Effect of HSYA on ROS fluorescence intensity of OGD/R damaged HT22 cells(×400)
3.7 HSYA 對OGD/R 損傷HT22 細胞胞漿CytC釋放的影響
如圖8 所示,與正常組相比,OGD/R 組細胞胞漿CytC 含量顯著性升高(P<0.01);與OGD/R 組相比,HSYA 各劑量組細胞胞漿CytC顯著性降低(P<0.01),表明HSYA 抑制了CytC 從線粒體到胞漿中的釋放。
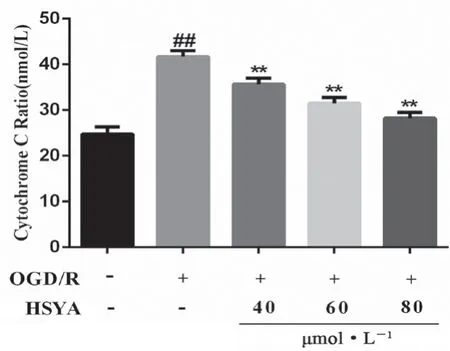
圖8 HSYA 對OGD/R 損傷HT22 細胞胞漿CytC 釋放的影響(x ±s,n =6)Fig 8 Effect of HSYA on the cytoplasmic CytC release of OGD/R damaged HT22 cells(x ±s,n =6)
3.8 HSYA 對OGD/R 損傷HT22 細胞凋亡的影響
如圖9 所示,正常組細胞形態較為飽滿,可見微弱藍色熒光,OGD/R 組細胞核固縮,呈亮藍色熒光。HSYA 各劑量組與OGD/R 組相比,核變圓變大,細胞核藍色熒光強度明顯減弱。隨后定量檢測HSYA 給藥組對OGD/R 損傷HT22 細胞凋亡影響,結果顯示,與正常組相比,OGD/R 組細胞的凋亡率為44.81%;HSYA 低、中、高給藥組可顯著降低細胞凋亡率至26.23%、17.78%、8.67%(P<0.01)。
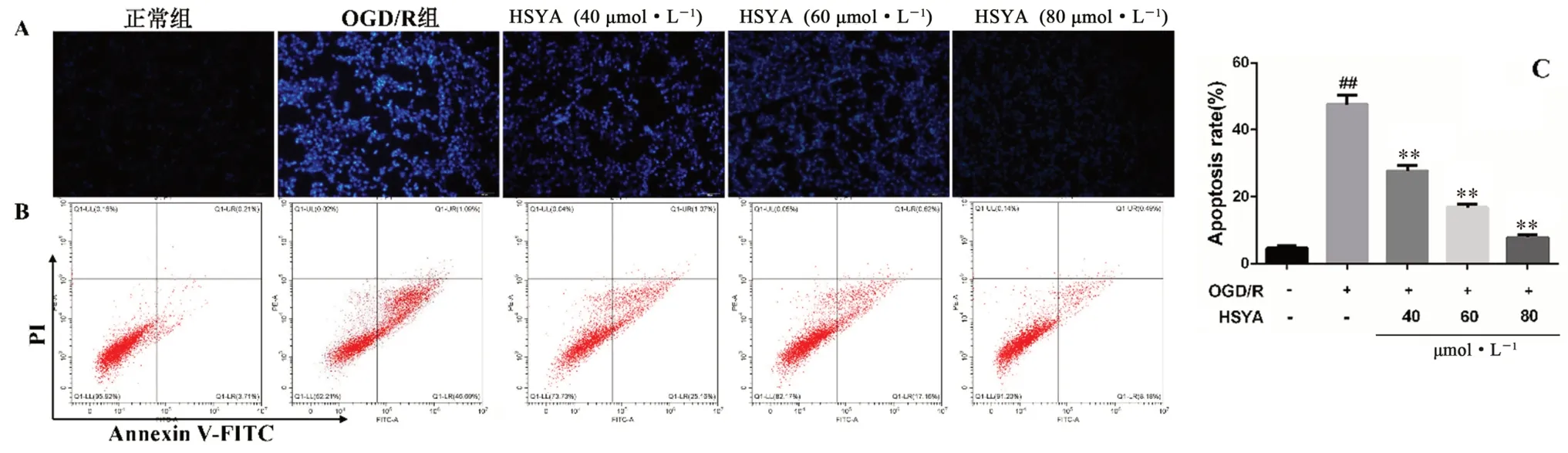
圖9 HSYA 對OGD/R 損傷HT22 細胞凋亡的影響(x ±s,n =3)Fig 9 Effect of HSYA on the apoptosis of OGD/R damaged HT22 cells(x ±s,n =3)
3.9 HSYA 對OGD/R 損傷HT22 細胞中Bax、Bcl-2和cleaved-caspase-3 蛋白表達的影響
如圖10 所示,與正常組相比,OGD/R 組Bax/Bcl-2 和cleaved-caspase-3 蛋白表達量顯著增加(P<0.01)。而相對于OGD/R 組,經HSYA處理后,Bax/Bcl-2 和cleaved-caspase-3 蛋白表達量顯著降低(P<0.05,P<0.01)。

圖10 HSYA 對OGD/R 損傷HT22 細胞中Bax、Bcl-2 和cleaved-caspase3 蛋白表達的影響(x ±s,n =3)Fig 10 Effect of HSYA on the expression of Bax,Bcl-2 and cleaved-caspase3 in OGD/R damaged HT22 cells(x ±s,n =3)
3.10 HSYA 對OGD/R 損傷HT22 細胞中Bax 和Bcl-2 mRNA 含量的影響
如圖11 所示,與正常組相比,OGD/R 組Bax 的mRNA 表達量顯著增加,Bcl-2 mRNA 表達量顯著降低(P<0.01)。而相對于OGD/R 組,經HSYA 處理后,Bax 的mRNA 表達量顯著降低,Bcl-2 mRNA 表達量顯著增加(P<0.01)。
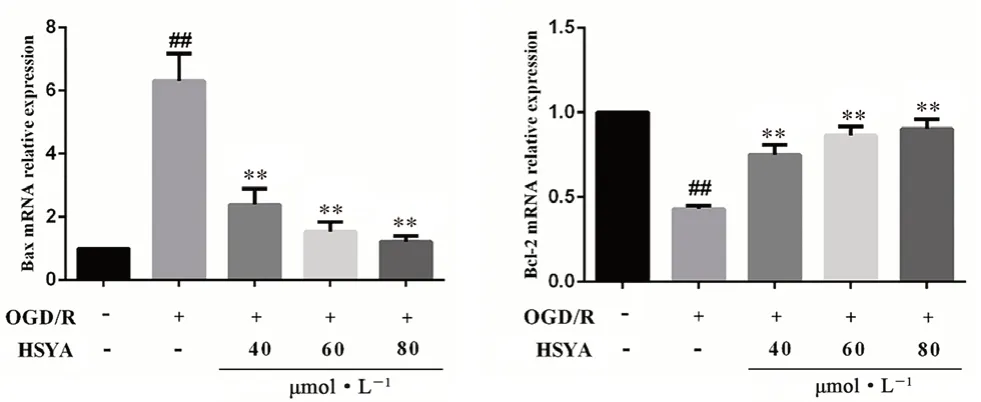
圖11 HSYA 對OGD/R 損傷HT22 細胞中Bax 和Bcl-2 mRNA 含量的影響(x ±s,n =3)Fig 11 Effect of HSYA on the mRNA content of Bax and Bcl-2 in OGD/ R-damaged HT22 cells(x ±s,n =3)
4 討論
缺血性卒中致死率很高。目前,主要治療藥物是治療靶點單一的神經保護性藥物,中藥以其多途徑、多靶點、不良反應少的特點在缺血性卒中的康復治療中展現出巨大優勢。因此,探討中藥治療缺血性卒中的潛在機制,對其康復治療具有重大意義。HT22 細胞體外腦缺血模型(氧糖剝奪,OGD)與在體實驗模型具相似的生理學特性,且相比于在體實驗,體外實驗能夠更好地模擬和確定在體腦缺血的治療靶點和策略[8]。
細胞凋亡是缺血性卒中發病過程中神經元損傷的一種形式。缺血缺氧后,腦梗死病灶中同時存在細胞壞死與細胞凋亡,缺血中心區域以細胞壞死為主,而梗死灶周圍缺血半暗帶中細胞死亡的一種主要形式則為細胞凋亡[9]。腦缺血時有多種caspase 表達,caspase3 在缺血性神經元細胞凋亡過程中起重要作用[10]。研究顯示,缺血時能量代謝出現障礙,線粒體跨膜電位消失,其通透性轉變孔(mPTP)開放,CytC 可與凋亡蛋白酶活化因子1(Apaf-1)形成凋亡體,激活下游的caspase 通路誘導細胞凋亡[11]。另一方面,Bax和Bcl-2 是線粒體內源性途徑凋亡過程中的關鍵調節蛋白,Bax 和Bcl-2 的比值升高可以進一步誘導細胞發生凋亡[12]。本研究結果顯示缺血性卒中發生過程中Bax/Bcl-2、cleaved-caspase3 的蛋白表達和mRNA 含量都增強,而HSYA 治療可以逆轉這一趨勢。CytC 釋放至胞漿是線粒體介導的細胞凋亡途徑的關鍵步驟[13],ELISA 結果顯示HSYA 抑制了CytC 從線粒體到胞漿中的釋放。Hoechst 染色和AV-PI 流式細胞術染色是檢測細胞凋亡的金指標,本研究結果表明,HSYA 各給藥組細胞凋亡率降低,表明HSYA 抑制神經細胞凋亡減輕OGD/R 誘導的HT22 細胞損傷。
氧化應激是指細胞或機體收到刺激后自由基的產生和抗氧化防御嚴重失衡,從而引起的一系列細胞毒性反應。缺血性卒中的主要發病機制包括氧化應激在內的缺血級聯反應,一般情況下,SOD 和GSH 等都具有清除自由基的作用。除此之外,ROS 是氧化應激中至關重要的調節因子,在氧化應激和細胞生長過程中起著舉足輕重的作用[14]。本研究結果表明,當缺血性卒中發生時細胞內NO、LDH、MDA 及ROS 水平顯著升高,SOD 和GSH 水平顯著降低,而給予HSYA 治療后,可以顯著改善這一現象,提示HSYA 可通過抑制氧化應激減輕OGD/R 誘導的HT22 細胞損傷。
綜上所述,HSYA 對OGD/R 誘導的HT22 細胞具有保護作用,這種保護作用可能與抑制氧化應激和神經元細胞凋亡有關。

