斜帶石斑魚BAG-1基因克隆及表達分析
李 星,吳子杰,溫依銘,劉結紅,蔡 佳*,簡紀常*
(1廣東海洋大學水產學院,廣東湛江 524088;2廣東省水產經濟動物病原生物學及流行病學重點實驗室,廣東湛江 524088;3廣東省水產經濟動物病害控制重點實驗室,廣東湛江 524088)
0 引言
【研究意義】斜帶石斑魚()是我國南方沿海地區及東南亞各國的名貴海水養殖魚類之一,其經濟價值極高(王大鵬等,2012;張濤等,2018)。近年來,隨著斜帶石斑魚高密度、集約化養殖規模的不斷擴大,養殖環境日趨惡化,斜帶石斑魚養殖過程中細菌病和病毒病頻繁發生,且病原感染能誘導產生多種細胞死亡,其形式包括凋亡、自噬和壞死(Georgiadis et al.,2001;Qin et al.,2003,2006;陳大瑋等,2011)。BAG-1是篩選Bcl-2結合蛋白(Bcl-2-associated athanogene,BAG)時鑒定獲得的第一個蛋白,其C端含有BAG結構域,能介導BAG家族蛋白的抗凋亡活性(Doukhanina et al.,2006)。因此,研究基因在斜帶石斑魚各器官組織中的表達特征,有助于了解斜帶石斑魚在病原感染后的免疫防御機制,為其病害防治提供新的策略。【前人研究進展】BAG-1可能參與魚類應對病原入侵的免疫反應。細胞凋亡作為細胞程序性死亡的一種主要形式,已被證實在個體發育、損傷修復及病原清除等過程中扮演著重要角色(Yu et al.,2015),其過程主要受Bcl-2家族及相關蛋白的調控(Danial and Korsmeyer,2004)。BAG是一類抗凋亡蛋白家族,通過與Bcl-2相互作用而顯著增強Bcl-2的抗凋亡作用,促進細胞存活(Takayama et al.,1995)。BAG-1可通過與Raf-1絲氨酸/蘇氨酸激酶或Hsc70/Hsp70結合,促進細胞增殖(Pennell and Lamb,1997;Brive et al.,2001),且有研究證實外源刺激誘導的Hsp70表達可與Raf-1競爭性結合BAG-1,削弱Raf-1信號轉導,從而抑制細胞增殖(Song et al.,2001);BAG-1還可作為Hsc70/Hsp70 的核苷酸交換因子(NEF)刺激Hsc70 ATP水解,調節細胞的應激反應、凋亡、增生和遷移(Knee et al.,2001;李穎等,2009),并參與蛋白酶體降解途徑與自噬間的切換,調節蛋白酶穩態(Minoia et al.,2014;Liu et al.,2020)。BAG-1的中心泛素樣結構域(UBL)與26S蛋白酶體(Knee et al.,2001)可直接相互作用,促進蛋白酶體降解靶蛋白,還能與具有E3泛素連接酶活性的CHIP(carboxy ter‐minus of Hsp70 interacting protein)及Hsp70形成三元復合物降解靶蛋白,同時BAG-1通過依賴于CHIP的泛素化參與蛋白酶體調控,在此過程中BAG-1的泛素樣結構域區可增強CHIP靶向蛋白的作用(魏瑞敏等,2016)。此外,人類巨細胞病毒(HCMV)感染胚胎肺細胞后,基因表達上調,而干擾基因表達能抑制HCMV的抗凋亡活性(Li et al.,2015),說明BAG-1在宿主抗病毒感染的免疫反應中發揮著重要作用;BAG-1在非小細胞肺癌組織中的陽性表達率明顯高于肺臟良性病變組織,對于細胞病變也有一定的抑制作用(馬家寶等,2009)。凋亡調控基因-1蛋白是基因的表達產物,與腫瘤的發生發展存在一定關聯(陳小波和鄭定容,2016)。Kermer等(2015)研究發現,過表達基因可顯著降低α突觸核蛋白突變體瞬時過表達對人類神經母瘤細胞產生的毒性效應。【本研究切入點】BAG-1作為抗細胞凋亡蛋白家族的成員之一,在細胞發育、增殖、分化及應激中發揮重要作用(Hückelhoven,2004;Watanabe and Lam,2006),但目前針對基因功能的研究主要集中在人類和高等脊椎動物,關于魚類細胞死亡調控因子在病毒感染中發揮作用的報道相對較少,對魚類基因的功能也知之甚少。【擬解決的關鍵問題】克隆斜帶石斑魚基因()并對其結構特征、組織表達分布及在脂多糖(LPS)和聚肌胞苷酸(PolyI:C)刺激后的表達變化進行分析,進一步揭示魚類BAG-1在病原感染中的作用機制,也為了解魚類的抗病免疫提供參考依據。
1 材料與方法
1.1 試驗材料
供試斜帶石斑魚購自湛江市東風水產市場,試驗前1周暫養于實驗室循環水系統中,活力良好,體表無傷。LPS和PolyI:C購自美國Sigma公司,Bio.analyzer 2100生物分析儀購自美國Agilent Technologies公司,PrimeSTAR HS DNA高保真聚合酶、Trans-Zol Up Plus RNA Kit、大腸桿菌DH5α感受態細胞及pMD18-T載體購自TaKaRa公司。
1.2 EcBAG-1基因克隆
1.2.1 引物設計與合成 通過對轉錄組數據篩選獲得基因EST序列,利用Primer Primer 5.0設計特異性引物(表1),并委托生工生物工程(上海)股份有限公司合成。
1.2.2 總RNA提取及cDNA合成 根據TransZol Up Plus RNA Kit說明,分別提取斜帶石斑魚脾臟、肝臟、胸腺、頭腎、鰓、皮膚、肌肉、大腦、外周血淋巴細胞和心臟等10種組織的總RNA,使用1.0%凝膠電泳檢測其完整性,并以Bio.analyzer 2100生物分析儀檢測總RNA濃度。參照反轉錄試劑盒說明反轉錄合成cDNA模板。
1.2.3基因克隆及載體構建 根據斜帶石斑魚轉錄組數據,通過引物EcBAG-1-F/EcBAG1-R(表1)克隆基因,按PrimeSTAR HS DNA高保真聚合酶說明構建PCR反應體系50.0 μL:5×PrimeSTAR Buffer(MgPlus)10.0 μL,dNTP Mix‐ture 4.0 μL,上、下游引物(2.5 mmol/L)各2.5 μL,cDNA模板2.5 μL,PrimeSTAR HS DNA高保真聚合酶0.5 μL,ddHO 28.0 μL。擴增程序:98 ℃預變性5 min;98 ℃10 s,55 ℃5 s,72 ℃15 s,進行10個循環;98 ℃10 s,55 ℃5 s,72 ℃5 min,進行23個循環;72 ℃延伸10 min。擴增產物用1.0%瓊脂凝膠電泳進行檢測,目的條帶使用凝膠回收試劑盒純化回收,與pMD18-T載體連接后轉化DH5α感受態細胞,37 ℃下倒置恒溫振蕩培養過夜,菌液PCR檢測呈陽性的克隆送至廣州生工生物科技有限公司測序。
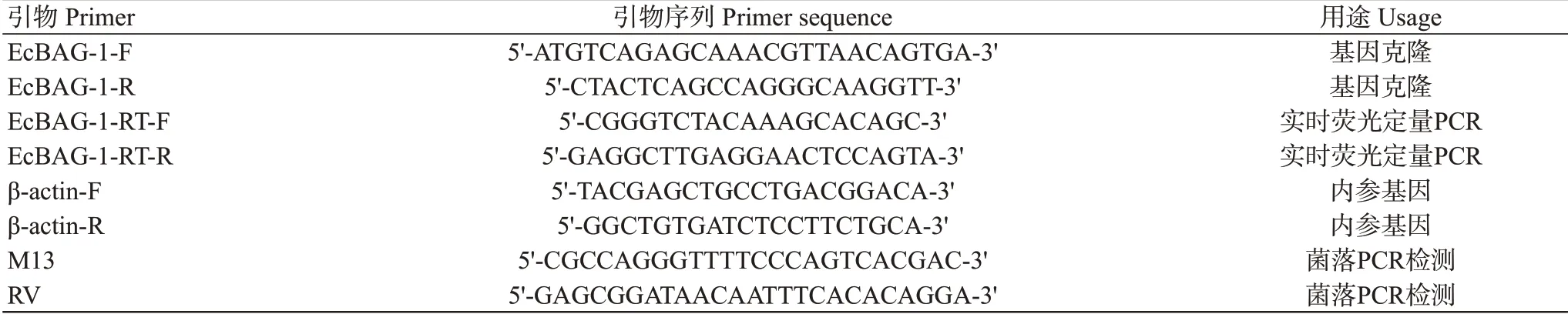
表1 EcBAG-1基因克隆及實時熒光定量PCR擴增引物序列信息Table 1 Information of primer sequence used in the cloning and real-time fluorescent PCR of EcBAG-1 gene
1.3 生物信息學分析
利用ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder/)查找基因開放閱讀框(ORF)及其推導氨基酸序列;使用SMART(http://smart.embl-hei‐delberg.de/)獲取基因結構域;運用TMHMM Server v.2.0預測EcBAG-1蛋白跨膜結構域;通過SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/interactive)分別進行EcBAG-1蛋白二、三維結構預測;采用ExPASy(http://web.expasy.org/protparam/)預 測EcBAG-1 蛋 白 理論等電點(pI)、分子量及親水性參數等;在NCBI的Protein BLAST數據庫中搜索與EcBAG-1氨基酸序列相似性較高的BAG-1氨基酸序列,使用ClustalX和MEGA 5.0進行多序列比對,并通過MEGA 6.0中的鄰接法(Neighbor-joining,NJ)構建系統發育進化樹;運用PSORT Prediction(http://psort.hgc.jp/form.html)對EcBAG-1蛋白進行亞細胞定位預測分析。
1.4 LPS和PolyI:C刺激斜帶石斑魚
取暫養1周的健康斜帶石斑魚,采用腹腔注射法分別注射LPS(10 μg/mL)和PolyI:C(1 μg/mL),注射劑量0.1 mL/尾(Wei et al.,2017),對照組注射等量的PBS。注射0、6、12、24和48 h后分別從各處理組中隨機采集5尾斜帶石斑魚的脾臟,提取RAN后反轉錄合成cDNA(方法同1.2.2),液氮速凍后-80 ℃保存備用。
1.5 EcBAG-1基因表達分析
通過實時熒光定量PCR對健康斜帶石斑魚各組織中的基因進行檢測,以EcBAG-1-RT-F和EcBAG-1-RT-R為擴增引物,以為內參基因(表1)。實時熒光定量PCR反應體系10.0 μL:cDNA模板0.5 μL,正、反向引物(10 μmol/L)各0.5 μL,2×SYBR Green Mix(Roche)5.0 μL,雙蒸水3.5 μL。擴增程序:95 ℃預變性10 s;95 ℃5 s,58 ℃15 s,72 ℃20 s,進行33個循環。每個樣品設5個復孔,采用2法換算基因相對表達量(Livak and Schmittgen,2001),并以SPSS 20.0進行統計學分析。
2 結果與分析
2.1 EcBAG-1基因ORF序列分析結果
從斜帶石斑魚轉錄組數據中篩選獲得基因EST序列,設計引物進行PCR擴增,經測序比對后得到基因ORF序列長624 bp,共編碼207個氨基酸殘基(圖1)。EcBAG-1蛋白分子量為49.84 kD,pI為5.18,總平均疏水性為0.866,即EcBAG-1蛋白為疏水性蛋白。據SMART 4.0預測結果(圖2)顯示,EcBAG-1蛋白含有1個典型的家族結構域(BAG)和1個泛素結構域(UBQ)。TMHMM 2.0跨膜結構域預測結果表明,EcBAG-1蛋白不含跨膜結構域。通過PSITE對EcBAG-1蛋白進行功能位點預測,結果顯示該蛋白含有1個酰胺化位點、2個異戊二烯基結合位點、3個微體C端靶向信號、4個蛋白激酶C磷酸化位點、5個酪蛋白激酶Ⅱ磷酸化位點、5個N-肉豆蔻酰化位點及1個真核硫醇蛋白酶組氨酸活性位點。EcBAG-1蛋白主要分布在細胞質和細胞核。

圖1 EcBAG-1基因ORF序列及其推導氨基酸序列Fig.1 ORF and amino acid sequence induction of EcBAG-1 gene
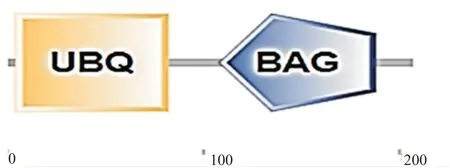
圖2 EcBAG-1蛋白結構域示意圖Fig.2 EcBAG-1 protein domain diagram
2.2 EcBAG-1蛋白二、三級結構預測結果
SOPMA預測結果顯示,EcBAG-1蛋白二級結構中α-螺旋(藍色)占65.22%、延伸鏈(紅色)占10.63%、無規則卷曲(紫色)占20.29%、β-轉角(綠色)僅占3.86%(圖3)。利用SWISS-MODEL對EcBAG-1蛋白三級結構進行預測,結果(圖4)發現該蛋白氨基酸序列與人類的BAG-1氨基酸序列具有較高的相似性,故推測EcBAG-1具有類似的生物學功能。
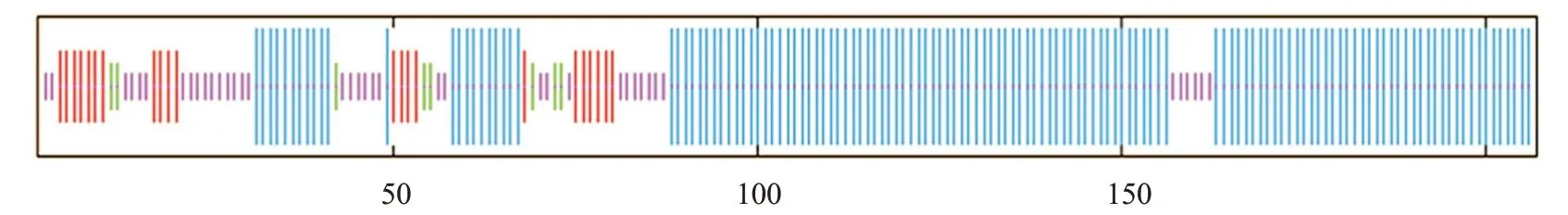
圖3 EcBAG-1蛋白二級結構預測結果Fig.3 Secondary structure prediction of EcBAG-1 protein
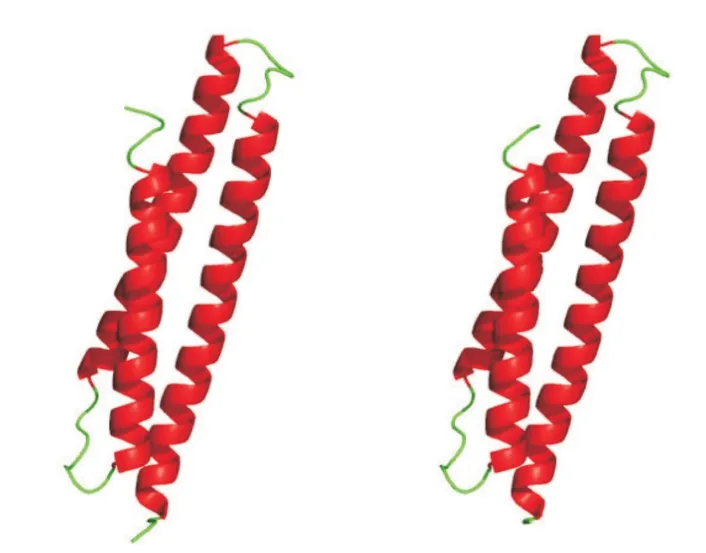
圖4 人類BAG-1蛋白(左)與EcBAG-1蛋白(右)三級結構的比較Fig.4 Tertiary structure comparison of BAG-1 protein in human(left)and EcBAG-1 protein(right)
2.3 EcBAG-1氨基酸序列比對分析結果
使用ClustalX對EcBAG-1氨基酸序列與大黃魚()、斑馬擬麗魚()、尼羅羅非魚()、牙鲆()、紅鰭東方鲀()、紅鮭魚()、斑馬魚()、熱帶爪蛙()、人類()等物種的BAG-1氨基酸序列進行比對分析,結果(圖5)顯示,EcBAG-1氨基酸序列與大黃魚的BAG-1氨基酸序列相似性最高(96.62%),與熱帶爪蛙的相似性最低(57.50%)。結合SMART及NCBI發現,以上物種氨基酸序列均含有BAG保守結構域,即BAG-1蛋白在以上物種中具有高度保守性。

圖5 EcBAG-1氨基酸序列與其他物種BAG-1氨基酸序列的對比分析Fig.5 Comparative analysis of amino EcBAG-1 acid sequence with BAG-1 acid sequence in other species
2.4 系統發育進化樹分析結果
基于BAG-1氨基酸序列相似性,通過MEGA 6.0中的NJ法構建系統發育進化樹,結果(圖6)顯示,魚類全部聚為一支,哺乳類聚為一支,而原雞和熱帶爪蛙聚為一支。其中,斜帶石斑魚與大黃魚(XP_019113087.1)的分類地位最近,其BAG-1氨基酸序列相似性達96.62%;與斑馬擬麗魚(XP_004542998.1)、尼羅羅非魚(XP_003438109.1)、牙鲆(XP_0199666 54.1)、紅鰭東方鲀(XP_003975493.1)、紅鮭魚(XP_029504482.1)、斑馬魚(NP_001092206.1)的親緣關系較近,對應的BAG-1氨基酸序列相似性分別為89.86%、89.37%、89.86%、85.89%、82.61%和82.13%;與原雞(NP_001103162.1)和熱帶爪蛙(XP_0029395 43.2)的親緣關系相對較遠,對應的BAG-1氨基酸序列相似性分別為58.45%和57.50%。

圖6 基于BAG-1氨基酸序列相似性構建的系統發育進化樹Fig.6 Phylogenetic tree based on BAG-1 amino acid sequences similarity
2.5 EcBAG-1基因組織表達分析結果
采用實時熒光定量PCR檢測健康斜帶石斑魚肝臟、胸腺、脾臟、頭腎、鰓、皮膚、肌肉、大腦、外周血淋巴細胞及心臟等組織中的基因表達情況,結果(圖7)表明,基因在以上組織中均有表達,且以在大腦中的相對表達量顯著高于在其他組織中的相對表達量(<0.05,下同)。

圖7 EcBAG-1基因在斜帶石斑魚不同組織中的表達情況Fig.7 Expression of EcBAG-1 gene of E.coioides in different tissues
2.6 EcBAG-1基因在病原感染后的組織表達特征
經LPS和PolyI:C感染刺激后,選取斜帶石斑魚脾臟組織進行進行基因表達檢測分析,結果(圖8)顯示,2種刺激對基因在斜帶石斑魚脾臟中的表達均具有時效性。經LPS刺激6、24和48 h后,基因相對表達量均呈上調趨勢,至刺激24 h時其相對表達量達最大值,但在刺激12 h時其相對表達量略有下調。經PolyI:C刺激6、12、24和48 h后,基因相對表達量均呈上調趨勢,同樣以刺激24 h時的上調幅度最大;與LPS刺激后的基因相對表達量相比,PolyI:C 刺激后基因相對表達量無明顯的下調趨勢。可以確定的是,在LPS和PolyI:C刺激24 h后斜帶石斑魚脾臟中的基因相對表達量顯著上調。
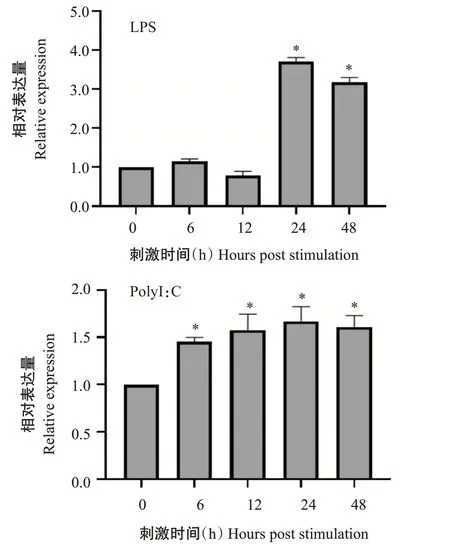
圖8 LPS和PolyI:C刺激后EcBAG-1基因在斜帶石斑魚脾臟中的表達情況Fig.8 Expression of EcBAG-1 in spleen of E.coioides after LPS and PolyI:C stimulation
3 討論
本研究從本課題組前期構建的斜帶石斑魚轉錄組數據(張海艷等,2018)中篩選獲得基因EST序列,利用Primer Primer 5.0設計特異性引物并成功擴增獲得基因。基因共編碼207個氨基酸殘基,其編碼蛋白含有BAG-1蛋白家族典型的BAG結構域和UBQ結構域,與已報道的BAG-1蛋白結構相同。通過BAG結構域,BAG-1能與絲氨酸/蘇氨酸激酶Raf-1或Hsc70/Hsp70競爭性結合,BAG-1與Raf-1的結合可激活Raf-1及其介導的信號通路,從而促進細胞生長;Hsp70與BAG-1的結合則削弱Raf-1活化和信號轉導,并抑制細胞生長(Doong et al.,2002);UBQ結構域有利于BAG-1連接Hsc70/Hsp70與蛋白酶體,促進蛋白酶酶體降解多聚泛素化蛋白(Lüders et al.,2000),最終影響細胞的應激、生長及凋亡。PSORT Prediction預測結果顯示,EcBAG-1蛋白主要分布在細胞質,故推測該蛋白具有調控細胞死亡與胞內信號轉導的作用。氨基酸序列比對分析結果也顯示,EcBAG-1氨基酸序列與其他物種的BAG-1氨基酸序列高度相似,說明EcBAG-1蛋白可能具有相似的生物學功能。在基于BAG-1氨基酸序列相似性構建的系統發育進化樹中,斜帶石斑魚與其他魚類聚為一支,尤其與大黃魚的親緣關系最近。
在健康斜帶石斑魚體內,基因在檢測的各組織均有表達分布,其中在大腦中的相對表達量最高,顯著高于在其他組織中的相對表達量。哺乳動物基因功能研究顯示,基因表達與創傷性腦損傷相關(Hayashi et al.,2000;Xu et al.,2012),還能調控神經元前體細胞增殖(Elliott and Ginzburg,2009),暗示基因可能具有類似的功能。經LPS和PolyI:C刺激后,斜帶石斑魚脾臟中的基因表達顯著上調,表明該基因參與斜帶石斑魚抗病原感染的免疫反應。目前,有關的功能研究主要集中在人類和高等脊椎動物。由于BAG-1的表達水平與腫瘤分期及腫瘤細胞活性關聯,因此可作為胃癌、乳腺癌等多種惡性腫瘤的生物標志物(Sauerbrei and Haeussler,2018),還可增強增殖和存活的主要調控因子——核激素受體活性(Ozfiliz et al.,2015);利用原核表達獲得的緩殖子特異性蛋白BAG-1建立間接ELISA,可實現對弓形蟲慢性感染豬進行鑒別診斷(熊冰清,2012)。然而,針對魚類基因的功能尚無研究報道。哺乳動物的基因研究發現,經LPS刺激后BAG-1與Hsp70的結合能介導核因子κB(NF-κB)p56亞單位的降解,從而抑制細菌感染引起的炎癥反應(Tanaka et al.,2014);在人類巨細胞病毒感染后基因表達上調,進而抑制該病毒誘導的細胞凋亡(Li et al.,2015);在衣原體的感染中基因也具有相似作用(Du et al.,2013)。基因過表達還能激活人類多瘤性病毒JC病毒(Human polyomavirus JC virus)早期基因啟動子的轉錄活性(Devireddy et al.,2000)。然而,近期有研究表明鋸緣青蟹基因沉默能抑制對蝦白斑病毒(White spot syndrome virus)的增殖及促進病毒感染誘導的細胞凋亡(Ma et al.,2019),說明基因可通過調控細胞死亡而參與宿主的抗病原感染免疫反應,因此推測基因也是通過類似的方式發揮作用,但具體原理有待進一步探究。
4 結論
EcBAG-1 蛋白含有BAG-1 蛋白家族典型的BAG結構域和UBQ結構域,具有與哺乳動物BAG-1相似的生物學功能,即基因在斜帶石斑魚抵御細菌/病毒感染的過程中發揮重要作用,為深入了解魚類的抗感染機理拓寬了思路。

