重復經顱磁刺激通過抑制線粒體凋亡途徑對缺血再灌注大鼠腦組織損傷的干預作用▲
方增焜 黃 永 李昌柳 黃東挺 江文宇 董 奎
(1 廣西中醫藥大學附屬國際壯醫醫院康復醫學科,南寧市 530000; 廣西壯族自治區江濱醫院2 物理治療科,3 科教部,4 神經康復科,南寧市 530000)
缺血性腦卒中是導致人類死亡和殘疾的主要原因,老年人受到的影響尤為嚴重[1]。缺血性腦卒中是由于腦血管系統閉塞,導致流向大腦某一區域的血液減少或停止,從而引起腦組織缺氧和壞死。腦組織缺血再灌注后,線粒體產生過量的活性氧,進一步損害腦細胞;同時,膠質細胞被激活后釋放炎癥細胞因子,并在梗死核心周圍形成瘢痕。梗死核心周圍是被稱為“半暗帶”的危險組織區域,是缺血性腦卒中研究的主要目標[2]。
經顱磁刺激是利用脈沖磁場作用于大腦中樞神經系統,在大腦的特定區域內誘導電流,通過改變刺激頻率可達到興奮或抑制局部大腦皮質的作用。這種感應電流可以抑制較低頻率的神經活動,同時可以刺激較高頻率的神經活動[3]。近年來,重復經顱磁刺激(repetitive transcranial magnetic stimulation,rTMS)在成癮性疾病、抑郁癥、帕金森病、精神分裂癥和腦卒中等疾病中的治療潛力逐漸受到重視[4]。研究表明,腦卒中患者經rTMS治療后運動功能得到顯著改善[5],這為腦卒中患者的康復帶來了希望。然而,rTMS治療的細胞和分子學作用機制仍不清楚。本研究建立大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)大鼠模型,探討rTMS對缺血性腦卒中的作用機制。
1 材料與方法
1.1 實驗動物 18只雄性健康SD大鼠購于廣西醫科大學實驗動物中心(動物生產許可證號:SCXK桂2014-0001),體重220~250 g,7~8周齡,適應性飼養1周,室溫(25±2) ℃,濕度40%~60%,自由飲水進食。將大鼠按照隨機數字表法分為假手術組、缺血再灌注組、缺血再灌注+rTMS組,每組6只。
1.2 試劑和儀器 主要試劑:原位細胞死亡檢測試劑盒(Roche Applied Science公司,批號:11684817910),二喹啉甲酸試劑盒(北京普利萊基因技術有限公司,批號:2500T),GAPDH抗體(Santa Cruz公司,批號:sc-25778),Caspase-9抗體(武漢博士德生物工程有限公司,批號 :A00080-7),細胞色素C(cytochrome C,CytC)抗體(Thermo Fisher Scientific公司,批號:45-6100),B細胞淋巴瘤2相關X蛋白(B-cell lymphoma-2-associated X protein,Bax)抗體(武漢博士德生物工程有限公司,批號:A00183),小鼠抗免IgG二抗(武漢博士德生物工程有限公司,批號 :BM2020)。主要儀器:磁場刺激儀(依瑞德集團,YRDCCY-Ⅰ型),透射電子顯微鏡(日本Hitachi公司,型號:H-9500),電泳儀(Bio-Rad公司,型號:1645050)。
1.3 大鼠MCAO模型的建立 通過腹腔注射氯胺酮(40 mg/kg)和甲苯噻嗪(10 mg/kg)進行麻醉,觀察無夾爪反射即可進行后續手術操作,術中維持麻醉時上述藥物濃度減半,圍術期監測大鼠的體溫、呼吸頻率。常規備皮、消毒后,行頸中線垂直切口,顯露右側頸總動脈,分離頸內動脈,使用動脈夾夾閉頸總動脈和頸內動脈。然后分離頸外動脈,雙線結扎頸外動脈并剪斷(留3~4 mm),在距頸總動脈分叉約5 mm處,剪一斜行45°小口剪口,插入單絲尼龍縫合線栓,松開頸總動脈動脈夾,至頸總動脈分叉口后將頸外動脈和線栓逆時針旋轉,使線栓進入頸內動脈,松開頸內動脈動脈夾,繼續進線至大腦中動脈,當感覺到阻力時停止插入,插入深度約為19 mm。閉塞2 h后拔出線栓再灌注,最后結扎切口,縫合皮膚。假手術組大鼠除不插線栓外,其他操作均一致。在整個手術、閉塞和再灌注過程中,用直腸體溫計監測大鼠體溫,并通過平板熱墊維持在大鼠體溫在36.0 ℃~38.0 ℃之間。待大鼠麻醉蘇醒后,將其送回籠中,自由獲得食物、水。
1.4 干預方法 (1)缺血再灌注+rTMS組:使用帶有70 mm 8字形線圈的磁場刺激儀,對大鼠進行rTMS。線圈位于大鼠眼睛和耳朵之間的背中央,線圈手柄垂直于大鼠的身體軸,在手術結束后2 h即進行第1次治療,刺激頻率為0.5 Hz,強度為70%最大輸出強度,連續刺激20次為1組,2組/d,于大鼠處死前1日結束治療。(2)假手術和缺血再灌注組:將線圈放置在靠近大鼠頭部且背對大鼠頭部的位置,以確保聽覺條件相似,但不進行電磁刺激,余處理同缺血再灌注+rTMS治療組。
1.5 運動功能評估 分別于術后第1、3、7天,采用改良神經功能缺損評分(modified Neurological Severity Score,mNSS)[6]評估各組大鼠的運動功能。mNSS包括運動試驗、感覺試驗、平衡木試驗、反射缺失和異常運動。總分18分,評分越高,神經功能損害越嚴重。
1.6 腦組織病理學改變 在術后第7天,各組隨機取3只大鼠,斷頸法處死后立刻取出腦組織,利用冷凍切片機制作8 μm厚的冠狀切片。切片經蘇木精染色5 min后,1%鹽酸乙醇分化5 s,將切片置于氨水中10 s,伊紅染色3 min,脫水,用乙醇和二甲苯清除,最后用中性香脂密封。顯微鏡下觀察大鼠缺血腦組織的病理學改變。
1.7 透射電鏡觀察缺血周圍皮層組織中的線粒體結構 在術后第7天,斷頸法處死各組剩余3只大鼠,取出大腦,解剖右側部分大腦缺血周圍皮層組織(假手術組取相應區域的腦組織),用1%四氧化鋨和1%亞鐵氰化物固定90 min,經磷酸緩沖鹽溶液洗滌后,采用乙醇和丙酮分級脫水,然后用樹脂包埋。制備超薄切片,醋酸鈾酰和檸檬酸鉛染色。在透射電子顯微鏡下觀察皮層組織的線粒體超微結構。
1.8 檢測細胞凋亡 取1.7中右側剩余缺血周圍皮層組織制作冷凍切片,使用原位細胞死亡檢測試劑盒進行末端脫氧核苷酸轉移酶介導的dUTP缺口末端標記(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)染色,以評估神經元凋亡情況。先用10%福爾馬林固定冷凍切片24 h,然后用TBS沖洗3次,每次5 min;用2% H2O2孵育切片10 min,用TBS洗滌3次,每次5 min,與TUNEL反應混合物酶反應,然后將切片放于37 ℃的濕盒子孵育1 h,用TBS沖洗3次,每次5 min。最后,將新鮮制備的3,3-二氨基聯苯胺溶液直接加入組織切片中,使用蘇木精進行復染。最后,用DM2500型熒光顯微鏡(Leica公司)觀察細胞凋亡情況。腦組織細胞凋亡率(%)=(陽性細胞數/總細胞數)×100%。
1.9 Western blot檢測相關蛋白的表達 取1.7中缺血腦組織進行勻漿并溶解在含有1 mmol/L苯甲基磺酰氟、2%蛋白酶和磷酸酶抑制劑混合物的冰冷RIPA裂解緩沖液中。采用二喹啉甲酸法測量蛋白濃度。通過10%~15%的SDS-PAGE分離等量(20~40 μg)的蛋白后,進行電轉印將蛋白轉至PVDF膜上,再用含脫脂牛奶的TBS封閉PVDF膜(pH值7.4)1 h,然后一抗4 ℃孵育過夜,抗體稀釋比例如下:GAPDH為1 ∶2 000,Caspase-9、Bax為1 ∶500,CytC為1 ∶1 000。用TBST沖洗PVDF膜3次(5 min/次)后,用相應的二抗(1 ∶5 000)在室溫下孵育90 min。最后用TBST洗膜3次(5 min/次)后,利用ECL發光液(普利萊公司,批號:P1020),進行X膠片曝光,最后用ImageJ軟件檢測相關蛋白的相對表達量。
1.10 統計學分析 采用GraphPad Prism 8軟件進行統計分析和作圖。正態分布的計量資料以(x±s)表示,多組間的比較采用方差分析(兩兩比較采用LSD-t檢驗),重復測量資料的比較采用重復測量方差分析;非正態分布的計量資料以M(Q)表示,組間比較采用秩和檢驗。以P<0.05為差異具有統計學意義。
2 結 果
2.1 3組大鼠的運動功能變化 3組間的mNSS差異有統計學意義(F組間=539.843,P組間<0.001),術后各時間點其余兩組的mNSS均高于假手術組,而第7天缺血再灌注+rTMS組mNSS低于缺血再灌注組(P<0.05);3組的mNSS均有隨時間下降的趨勢(F時間=230.515,P時間<0.001);分組與時間有交互效應(F交互=8.118,P交互<0.001)。見表1。

表1 3組大鼠mNSS的比較(x±s,分)
2.2 3組大鼠腦組織的病理學改變 缺血再灌注組大鼠出現較大的腦缺血梗死面積,而缺血再灌注+rTMS組大鼠的梗死區域較缺血再灌注組明顯縮小,見圖1A。此外,HE染色結果顯示,假手術組大鼠腦組織結構、細胞形態正常,缺血再灌注組大鼠腦組織出現組織疏松、細胞稀疏、腫脹等異常表現,而缺血再灌注+rTMS組大鼠腦組織上述異常表現減輕,見圖1B。

圖1 3組大鼠腦組織大體和鏡下病理表現(HE染色,×40)
2.3 3組大鼠腦缺血周圍皮層組織中的線粒體結構 假手術組大鼠大腦神經細胞出現含高致密基質的線粒體,線粒體結構完整而且外膜光滑無腫脹;缺血再灌注組大鼠的大部分大腦神經細胞線粒體腫脹伴低致密基質,結構破壞明顯,數目顯著減少,棘突排列紊亂,線粒體膜破損嚴重,呈現線粒體空泡化的趨勢;而缺血再灌注+rTMS組大鼠的線粒體異常形態表現較缺血再灌注組減輕。見圖2。
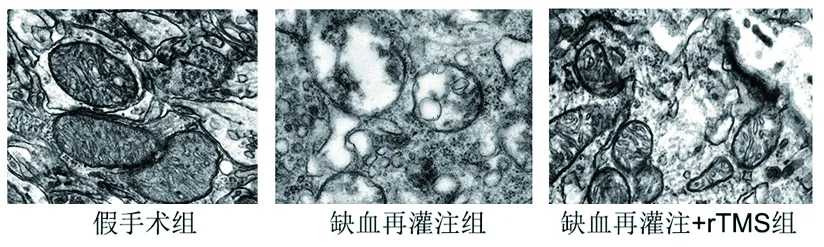
圖2 3組大鼠缺血周圍皮層組織中的線粒體結構
2.4 3組大鼠腦缺血周圍皮層組織中神經細胞凋亡情況 假手術組僅可見個別凋亡神經細胞,缺血再灌注組的神經細胞凋亡明顯增多,而缺血再灌注+rTMS組的神經細胞凋亡情況較缺血再灌注組減輕,見圖3。假手術組、缺血再灌注組、缺血再灌注+rTMS組的腦組織細胞凋亡率分別為0.65(1.33)%,75.45(17.03)%,51.40(18.43)%,組間差異有統計學意義(H=14.360,P=0.001),其中缺血再灌注組的細胞凋亡率高于假手術組,而缺血再灌注+rTMS組的細胞凋亡率低于缺血再灌注組(均P<0.05)。
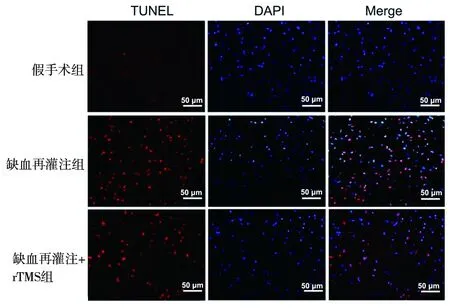
圖3 3組大鼠神經細胞凋亡情況
2.5 3組大鼠缺血腦組織中線粒體凋亡通路關鍵蛋白的表達情況 缺血再灌注組大鼠缺血腦組織的Caspase-9、CytC、Bax的蛋白表達量均高于假手術組(均P<0.05);缺血再灌注+rTMS組大鼠缺血腦組織的CytC、Bax的蛋白表達量均低于缺血再灌注組(均P<0.05),但兩組間Caspase-9的蛋白表達量差異無統計學意義(P>0.05)。見圖4和表2。
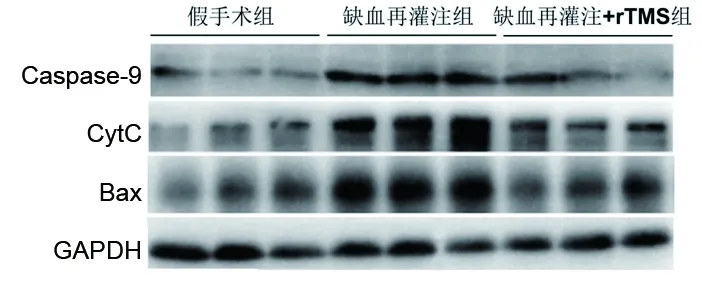
圖4 3組Caspase-9、CytC、Bax蛋白表達情況
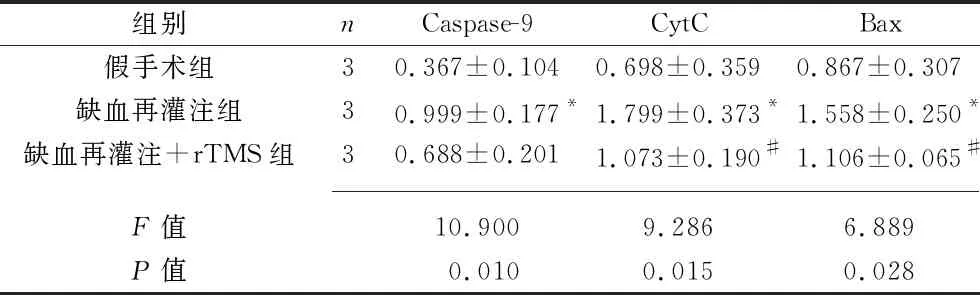
表2 3組大鼠Caspase-9、CytC、Bax蛋白相對表達量的比較(x±s)
3 討 論
缺血性腦卒中是導致我國中老年人身體殘疾的主要原因,腦卒中后偏癱降低了患者的生活質量,給家庭和社會造成了重大的經濟負擔。目前康復治療是治療腦卒中所致神經功能障礙的主要方法[7]。本研究采用MCAO法建立缺血再灌注大鼠模型,術后缺血再灌注組大鼠的mNSS高于假手術組(P<0.05),并出現較大的腦缺血梗死面積,這提示建模成功;而與缺血再灌注組相比,缺血再灌注+rTMS組大鼠術后第7天的mNSS降低(P<0.05),腦缺血梗死面積減小,組織疏松、細胞稀疏、腫脹等異常表現減輕,這提示rTMS對腦缺血再灌注損傷具有治療作用,能夠減小腦組織的缺血面積,改善神經功能缺損,這與既往針對慢性腦卒中患者的研究結果[5]相似。
發生缺血再灌注損傷時,線粒體是細胞存活的關鍵調節器,線粒體功能障礙可通過各種分子機制加重缺血性神經元損傷,因此靶向干預線粒體可能是治療缺血再灌注損傷的有效方案[8]。Andrabi等[9]給予缺血再灌注損傷大鼠普拉克索進行干預,發現其可通過抑制CytC從線粒體向細胞質的轉移,從而抑制線粒體膜通透性,從而促進缺血再灌注損傷大鼠的神經功能恢復。已有研究報告,rTMS可通過增強腦源性神經營養因子/原肌球蛋白相關激酶B信號通路的表達,以及抗凋亡機制,促進運動功能的恢復[10-11]。本研究從線粒體凋亡途徑探討rTMS治療腦缺血再灌注損傷的可能機制,結果顯示,缺血再灌注組大鼠腦缺血周圍皮層組織中的細胞凋亡率升高,大部分線粒體腫脹伴低致密基質,結構破壞明顯,數目顯著減少,棘突排列紊亂,線粒體膜破損嚴重,呈現線粒體空泡化的趨勢,而缺血再灌注+rTMS組大鼠腦缺血周圍皮層組織中的細胞凋亡率降低,上述異常表現均明顯減輕。這提示rTMS可以逆轉缺血再灌注損傷導致的腦組織線粒體結構破壞與凋亡,這為rTMS在缺血性腦卒中的應用提供了理論支持。
腦神經細胞凋亡是腦缺血基本病理過程,其中Caspase-9、CytC、Bax是經典的凋亡標志分子。B細胞淋巴瘤(B-cell lymphoma,Bcl)-2蛋白家族成員可調控蛋白質從線粒體內外膜間隙釋放到胞質。Bcl-2家族中的促凋亡蛋白Bax通常定位于胞質或松散地附著于線粒體,在缺血時發生構象變化,導致其移位、寡聚并插入線粒體外膜。這些Bcl-2相關蛋白(Bcl-2、Bcl-2L1、Bax和Bcl-2拮抗/殺傷因子1)在缺血再灌注導致的神經元死亡中調節線粒體外膜的通透性,并且刺激線粒體釋放CytC,CytC通過凋亡蛋白酶激活因子-1的多聚化與Caspase-9形成凋亡小體,導致下游胱天蛋白酶的級聯反應[12-13]。本研究通過Western blot發現,缺血再灌注可促進凋亡蛋白Bax、CytC、Caspases-9的表達升高,而rTMS可降低CytC、Bax蛋白的表達(P<0.05)。這進一步印證了rTMS可以通過抑制線粒體凋亡途徑實現對缺血再灌注損傷的干預作用。
總之,rTMS能夠改善缺血再灌注引起的大鼠神經功能缺損,其可能通過抗線粒體凋亡而發揮作用,這為rTMS在腦卒中治療中的作用提供了理論依據。然而,本文只從線粒體凋亡途徑探索其內在機制,而rTMS廣泛刺激顱腦,無特定靶向性[14],因此rTMS的神經保護作用可能是多機制共同作用的結果,后續研究可以探索更多的潛在治療機制,發現新的治療靶點,拓展rTMS在顱腦神經損傷方面的應用。

