11份蜜環菌種質rDNA-IGS序列分析及液體培養基優化
莫盛龍 夏宗元 李 繼 侯正科 劉紅昌* 黃明進
(1貴州大學農學院/石斛研究院,貴州貴陽 550025;2福泉市華源生態農業發展有限公司,貴州福泉 551608;3貴州省藥用植物繁育與種植重點實驗室,貴州貴陽 550025)
蜜環菌Armillaria mellea,隸屬于擔子菌亞門Basiaiomycotina 傘菌目Agaricales泡頭菌科Physalacriaceae 蜜環菌屬Armillaria(Fr.)Staude,是傳統的藥食兩用大型真菌,具有重要的經濟價值。蜜環菌是天麻生長所必需的共生真菌,為無法進行光合作用的天麻提供生長繁殖所需營養物質,對天麻品質及產量的影響較大[1-5]。在藥理上蜜環菌有與天麻相似的功效,人工液體發酵生產的蜜環菌菌絲體或菌球及其發酵液制成的蜜環菌制劑主要用于治療神經衰弱、失眠、耳鳴、眩暈、四肢麻木及癲癇等疾病[6-8]。
核糖體基因被認為是最能反映物種間遺傳關系的指標之一,核糖體基因間隔區可分為內轉錄間隔區(Internal Transcribed Spacer,ITS)和基因內間隔區(Intergenic Spacer,IGS)2 種。IGS 區域相對于ITS區域而言是比較低的保守基因區間,可進一步對相近的物種進行區分[9]。液體發酵技術生產蜜環菌,發酵周期短,生產效率高,為可連續的工業化生產。筆者對11份蜜環菌種質的rDNA-IGS區段進行序列測定,利用DNAMAN 軟件對其進行分類及特征序列比對;并在相對一致的液體培養條件下對其進行培養,選擇優勢蜜環菌菌株,采用三因素三水平正交試驗,對其培養基進行優化,以期為蜜環菌種質資源的分類、鑒別及液體培養提供參考。
1 材料與方法
1.1 材料
供試菌株于 2020 年 6 月收集,M-01—M-07 均來自貴州大學農學院,M-08購自貴州省都勻市勻洞鎮馬場村峻康生態農業發展有限公司,M-09購自黔東南興昌菌業科技有限公司,M-10購自湖北省宜昌市裕禾菌業有限公司,M-11為貴州省福泉市仙橋鄉月塘村野生蜜環菌子實體分離純化菌株,共11份蜜環菌種質。經貴州省藥用植物繁育與種植重點實驗室鑒定,均為蜜環菌屬Armillaria(Fr.)Staude種質,其中 M-01、M-02、M-04、M-05、M-08、M-09、M-10 為高盧族高盧蜜環菌Armillaria gallica,M-06、M-07為蜜環菌族蜜環菌Armillaria mellea,M-03、M-11為高盧族芥黃蜜環菌Armillaria sinapina。
1.2 培養基配制
分離純化培養基:PDA 培養基,按照說明書方法使用,倒入500 mL的錐形瓶中,每瓶200 mL。
活化培養基:馬鈴薯200 g,葡萄糖10 g,蔗糖10 g,蛋白胨2 g,磷酸二氫鉀1 g,七水硫酸鎂0.5 g,瓊脂粉12 g,pH6.0;馬鈴薯去皮切丁,加入適量的清水煮沸,持續沸騰期間用鐵勺搗碎,單層紗布過濾3次,濾液加水至1 L 后,加入其他原料,攪拌煮沸,倒入50 mL的試管中,每支30 mL。
優勢蜜環菌的篩選培養基:玉米淀粉8 g,黃豆粉8 g,葡萄糖20 g,蛋白胨6 g,酵母浸膏2 g,磷酸二氫鉀2 g,七水硫酸鎂1 g,VB11 g;先將玉米淀粉(1.2 g)和黃豆粉(1.2 g)按比例稱量,倒入200 mL 的培養瓶中,再將葡萄糖、蛋白胨、酵母浸膏、磷酸二氫鉀、七水硫酸鎂、維生素B1溶于1 L 的水中,加熱煮沸充分溶解,按每瓶150 mL倒入培養瓶中。
1.3 蜜環菌分離純化與活化
蜜環菌的分離:將野外采集到的蜜環菌子實體在超凈工作臺上用75%的酒精棉球擦拭菌蓋表面,迅速用無菌水沖洗菌蓋,再用無菌棉球擦干菌蓋上的水,用鑷子撕去菌蓋表皮,在菌柄與菌蓋交接處切取0.3~0.5 cm2的組織塊,接種于PDA 培養基上,置25 ℃的恒溫培養箱避光培養30 d,并與搜集的蜜環菌原種,存放于4~8 ℃環境中保存備用。蜜環菌的活化:將分離純化和收集的原種菌絲或菌塊接種于活化培養基中,置25 ℃的培養室內避光培養15 d,置4~8 ℃環境中保存備用。
1.4 蜜環菌rDNA-IGS序列分析
蜜環菌原種活化后,各取一支試管取出菌絲,清除培養基后,用液氮速凍,磨成粉狀,DNA 提取按照真菌基因組DNA 提取試劑盒操作。引物的選擇與合成采用間隔區基因的引物5SA/CNL12[10]。5SA堿基序列為5'-CAGAGTCCTATGGCCGTGGAT-3',CNL12堿基序列為5'-CTGAACGCCTCTAAGTCAG-3',由北京擎科生物科技有限公司重慶分公司合成。rDNA-IGS 序列擴增:PCR 反應體積為 30 μL,其中金牌Mix(green)26 μL,上下游引物各1 μL,DNA 模板2μL。反應條件:94 ℃預變性2 min后,94 ℃變性40 s,58.9 ℃退火40 s,72 ℃延伸100 s,共35個循環;72 ℃延伸 10 min,4 ℃保存。取 2.5 μLPCR 產物用1.0%瓊脂糖凝膠進行電泳分析以便了解擴增情況,其余擴增產物送北京擎科生物科技有限公司重慶分公司進行雙向測序和拼接。采用DNAMAN 6.0軟件構建聚類圖及序列比對分析。
1.5 優勢蜜環菌菌株篩選
在超凈工作臺中取出試管中已活化的新生菌絲,刮除殘留在菌絲上的培養基,切成1 cm 的小段,接種于優勢蜜環菌篩選培養基中。每150 mL 搖瓶接種1 小段,每份蜜環菌接種3 瓶,在25 ℃、黑暗及150 r/min的條件下搖瓶培養15 d。將菌球取出清水清洗,統計菌球個數,在黑暗環境下觀察菌球熒光,每瓶選4顆較大的菌球,測量其直徑,所有菌球放在單層紗布上濾水過夜,稱鮮重,60 ℃烘干,稱干重,計算折干率。
1.6 優勢蜜環菌液體培養基篩選
采用L(934)正交試驗,試驗因素為磷酸二氫鉀(A)、七水硫酸鎂(B)、VB(1C)。磷酸二氫鉀水平分別為 1.5 g/L、2.0 g/L、2.5 g/L;七水硫酸鎂水平分別為 0.5 g/L、1.0 g/L、1.5 g/L;VB1水平分別為 0.1 g/L、0.5 g/L、1.0 g/L。接種及培養方式同1.5。
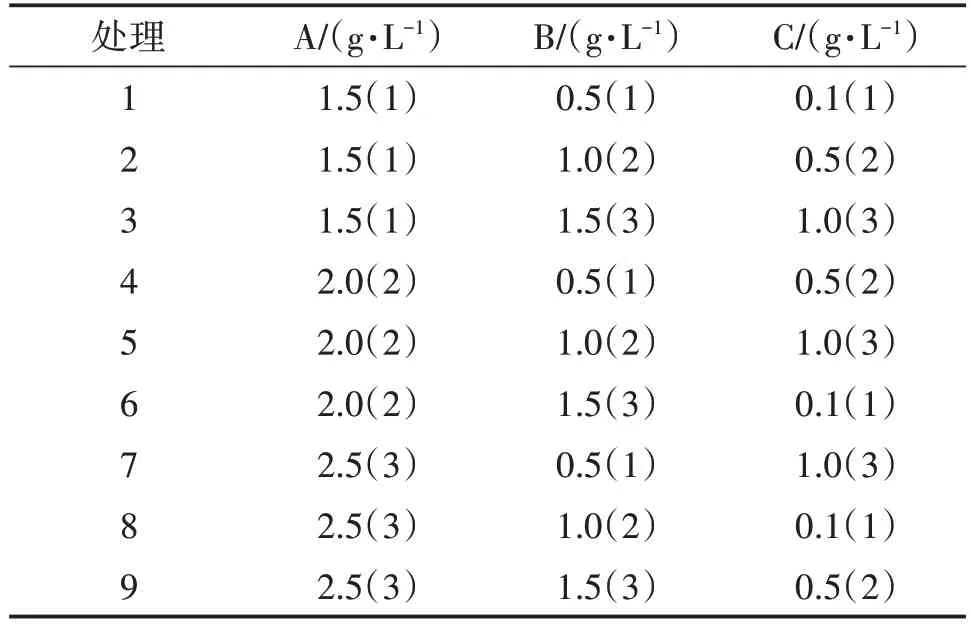
表1 優勢蜜環菌液體培養基優化正交試驗設計
2 結果與分析
2.1 11份蜜環菌種質rDNA-IGS序列分析
2.1.1 聚類分析
11 份蜜環菌種質樣品測序峰圖較好,序列拼接后,利用DNAMAN 6.0 軟件對所有序列進行多重對位排列,將對位排列結果中5’和3’端的非對位排列區去除,通過構建同源樹對11份蜜環菌種質進行聚類。由圖1可知,11份蜜環菌種質劃分為兩個大類,相似度為82%,Ⅰ類包括M-01—M-05 和M-08—M-10,相似度為100%,Ⅱ類包括M-06、M-07 和M-11,相似度為100%。

圖1 基于rDNA-IGS序列的11份蜜環菌種質聚類分析
2.1.2 特征序列分析
利用DNAMAN 6.0軟件分別對兩類蜜環菌序列進行多重對位排列,將對位排列結果中5’和3’端的非對位排列區去除,進行序列對比。在Ⅰ類蜜環菌種質中,M-01發生2個堿基的變異,在225 bp處由T→A,在247 bp處由A→G;M-02發生1個堿基變異,在 6 bp 處由 A→G;M-05 發生 1 個堿基變異,在465 bp 處由 A→G;M-09 發生 1 個堿基變異,在 6 bp處由A→G;M-10 發生2 個堿基變異,在 225 bp 處由T→A,在 465 bp 處由 A→G。共有序列長度為861 bp,其中堿基A、C、G、T 所占比例分別為31.2%、25.6%、18.9%、24.3%。在Ⅱ類蜜環菌種質中,M-11發生 17 個堿基變異,在 5 bp 和 284 bp 處由 C→T,在28 bp 處由 T→C,在 706 bp 處由 A→G,在 730 bp 處由 G→A,在 439~444 bp 和 430~535 bp 處均發生堿基缺失,其中在439 和444 bp 處為堿基C 的缺失,在440~443 bp、530 bp、532 bp、534 bp 和 535 bp 處為堿基A 的缺失,在431 bp 處為堿基G 的缺失,在533 bp處為堿基T 的缺失。共有序列長度為804 bp,其中堿基 A、C、G、T 所占比例分別為 33.5%、25.2%、17.1%和24.3%。將兩類的共有序列進行對比,去除非對位排列區后(表2),兩類蜜環菌核糖體基因序列差異較大,A、C、G、T 均有不同程度的變異,相似度為72.61%,共有序列長度為632 bp。其中堿基A、C、G、T 所占比例分別為 33.9%、24.8%、16.6%、24.7%。
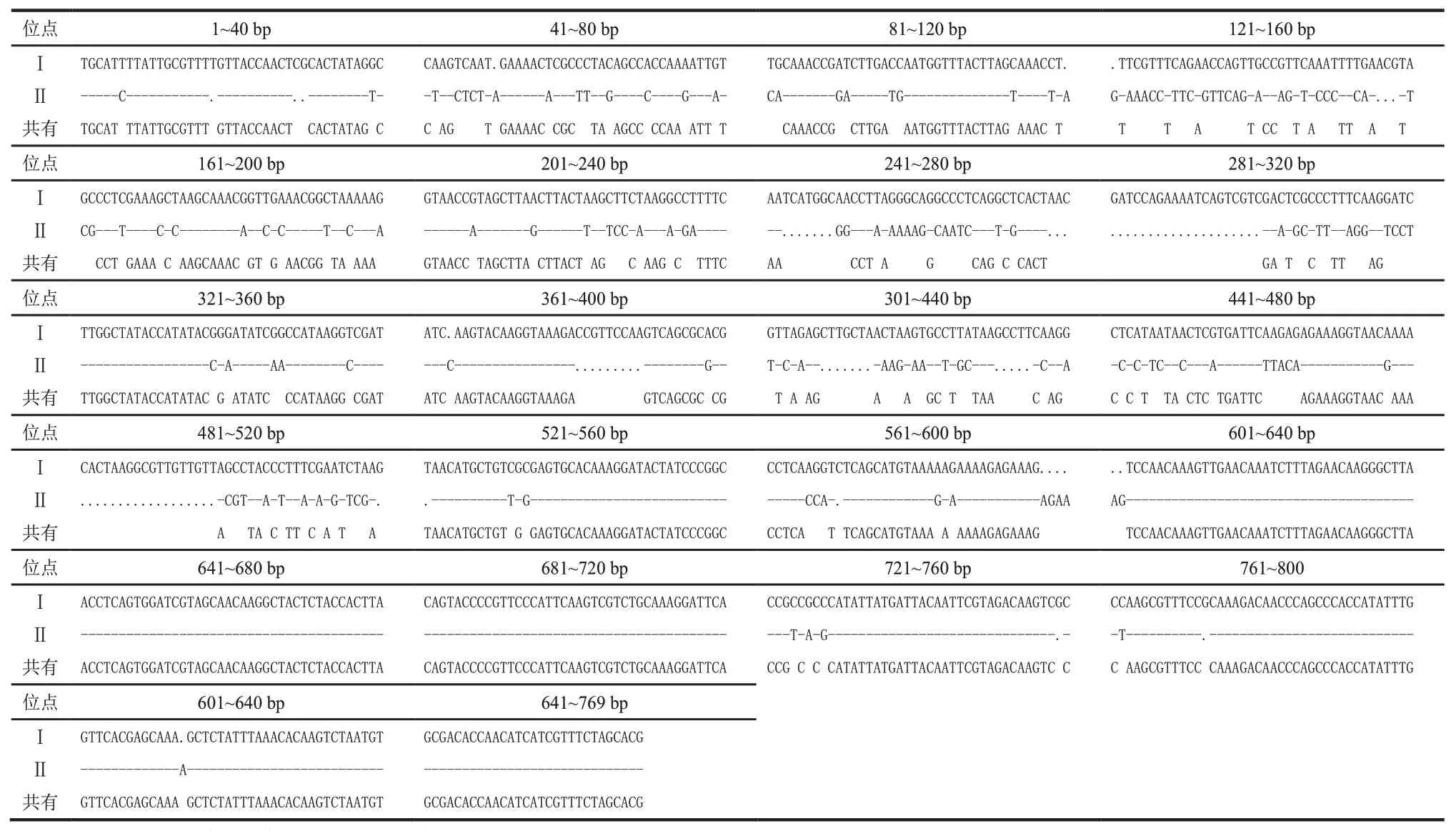
表2 兩類蜜環菌rDNA-IGS共有序列對比結果
2.2 液體培養優勢菌株篩選
2.2.1 顯著性分析
將數據導入DPS 數據處理系統,采用Duncan 新復極差法進行方差分析比較數據的差異顯著性。由表3 可知,M-03 菌球的直徑最大(16.43 mm),M-04 次之(14.21 mm),M-06 最小(2.84 mm);M-09 菌球的個數最多(160 個/150 mL),M-10 次之(130個/150 mL),與M-04、M-08 差異不顯著,M-03 最少(34 個/150 mL),與M-01、M-05、M-06 差異不顯著;M-09 菌球的干重值最高(1.683 g/150 mL),M-08 次之(1.509 g/150 mL),M-06 最小(0.029 g/150 mL);在黑暗條件下觀察菌球熒光情況,發現M-02 的熒光最強,M-09、M-10、M-08 和 M-04 熒光較弱,M-03、M-05 和 M-07 熒光弱,而 M-01、M-06、M-11 幾乎沒有熒光。因此,M-09 菌球生長情況較好,主要表現為菌球的直徑較大,個數較多,菌絲干重值較高,折干率較小以及熒光強度較強,M-03 雖菌球直徑最大,但菌球個數和干重較少,而M-06、M-01 和M-11表現最差。
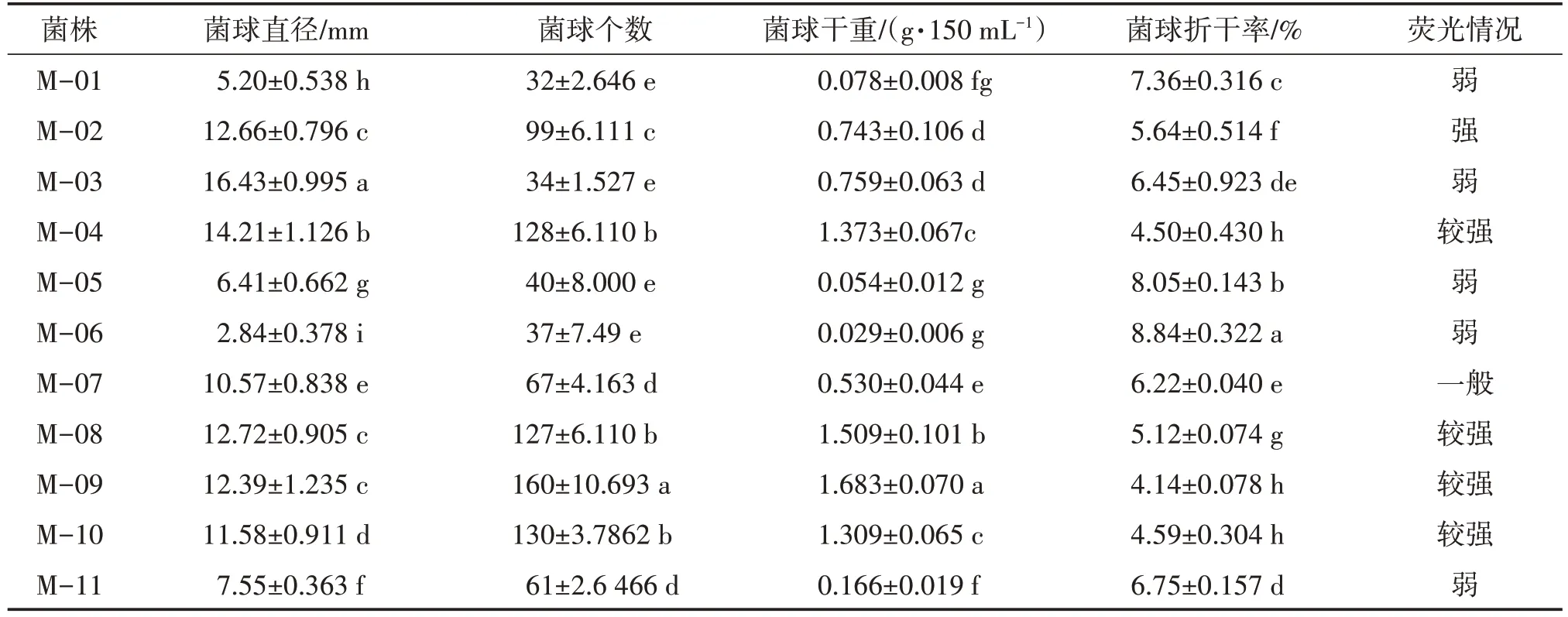
表3 蜜環菌種質菌球生長情況
2.2.2 聚類分析
以菌球的直徑、個數、干重以及折干率為指標,利用SPSS 軟件采用WORD 聚類法,對11 份蜜環菌種質進行分類。由圖2 可知,11 份蜜環菌種質在歐氏距離為25 時,分為兩個大類,Ⅰ類包括M-02、M-04 和 M-08—M-10,Ⅱ類包括 M-01、M-03、M-05、M-06、M-07 和M-11。Ⅰ類蜜環菌種質整體表現較優。
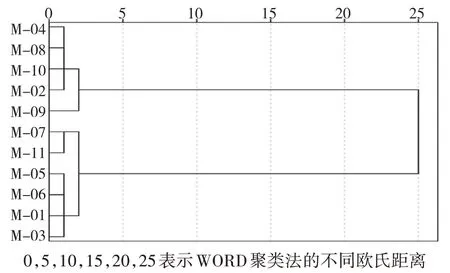
圖2 基于菌球表型的11份蜜環菌種聚類分析
2.3 優勢蜜環菌培養基優化
2.3.1 顯著性分析
以M-09 為優勢蜜環菌,對其培養基進行優化,由表4可知,處理2菌球的直徑最大(11.82 mm),與處理1 差異不顯著,處理9 最小(6.06 mm),與其他處理均差異顯著;處理3 的菌球個數最多(129 個/150 mL),與處理7 差異不顯著,處理1 最少(51 個/150 mL);處 理 7 菌 球 干 重 值 最 高(1.766 g/150 mL),與其他處理均差異顯著,處理8次之(1.379 g/150 mL),處理9最小(0.105 g/150 mL),但與處理1 差異不顯著。因此直觀分析認為處理7 為較優培養基,菌球干重值最高,個數較多。
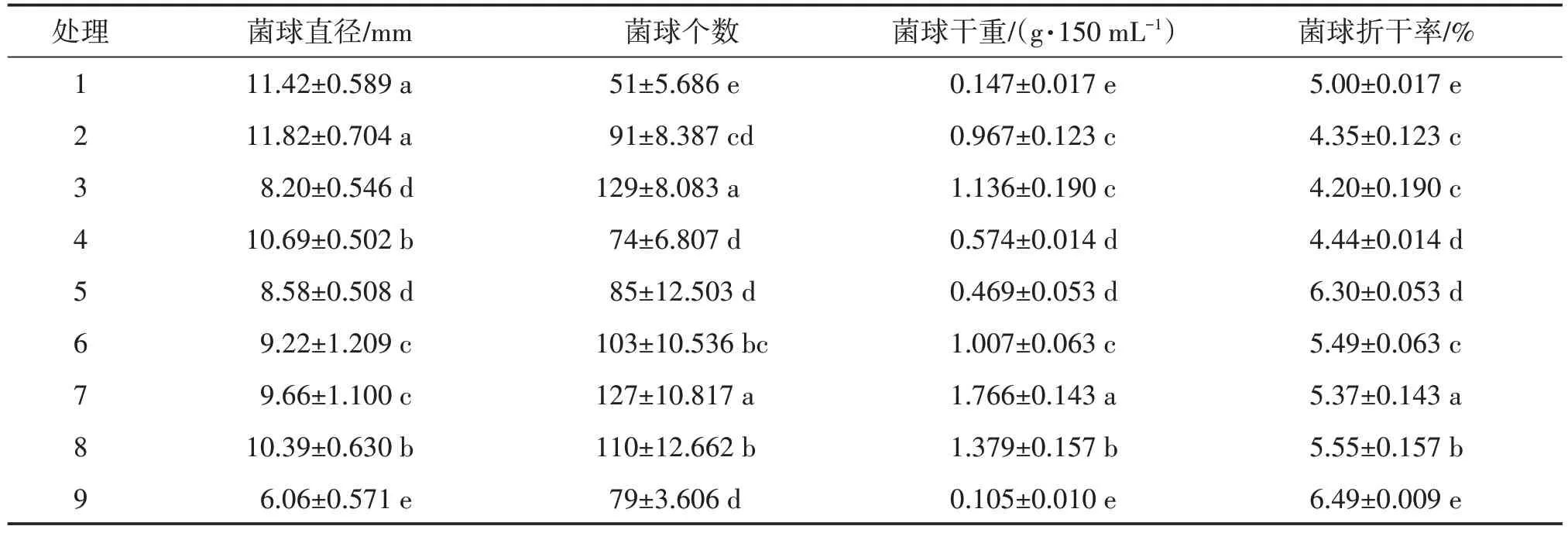
表4 優勢蜜環菌液體培養結果
2.3.2 正交分析
以菌球干重為指標,采用LSD 法進行正交分析,由表5可知,比較各因素極值排出影響因素大小(R越大的因素越重要):VB1>磷酸二氫鉀>七水硫酸鎂。經方差分析,由表6 可知,A、B、C 三因素的F值均小于F0.05(2,2),因此三個水平菌球干重差異均不顯著,所以選擇平均數大的作為最優組合,即A3、B1、C3。
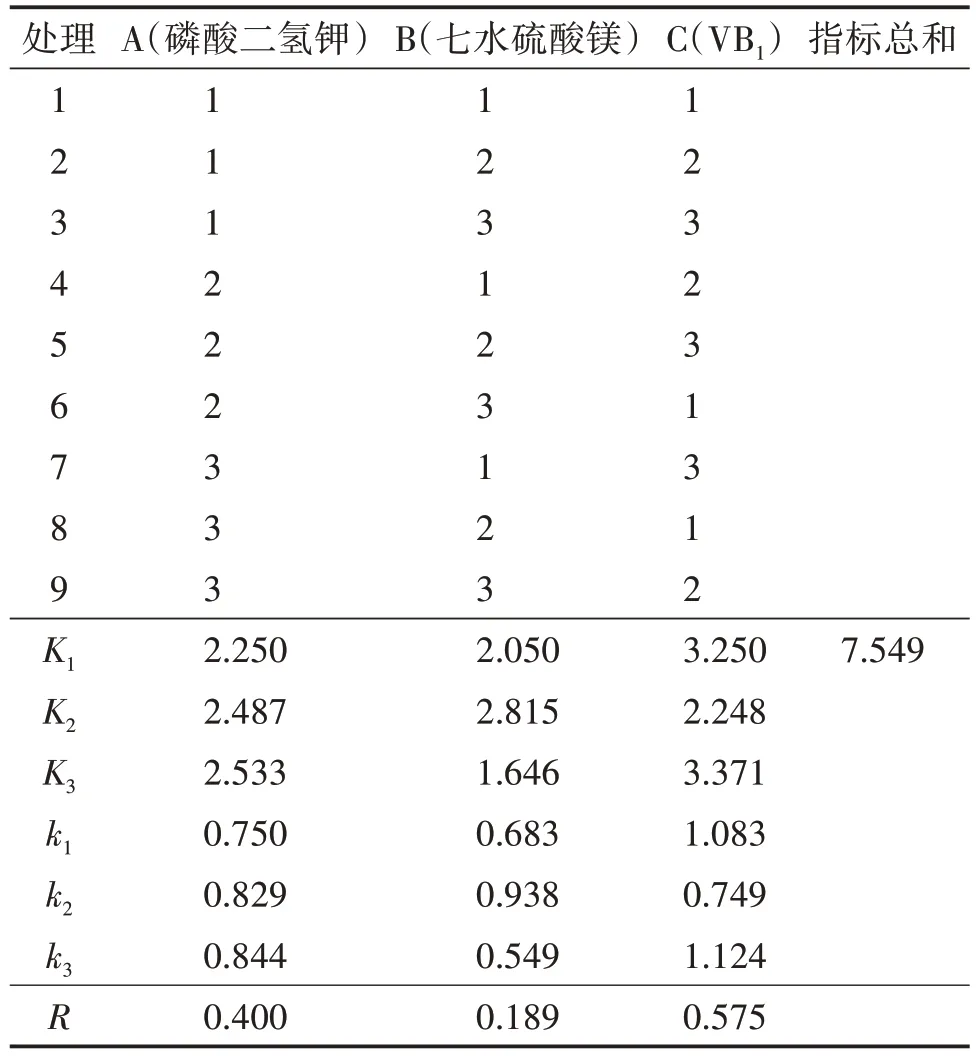
表5 優勢蜜環菌正交試驗結果(菌球干重)
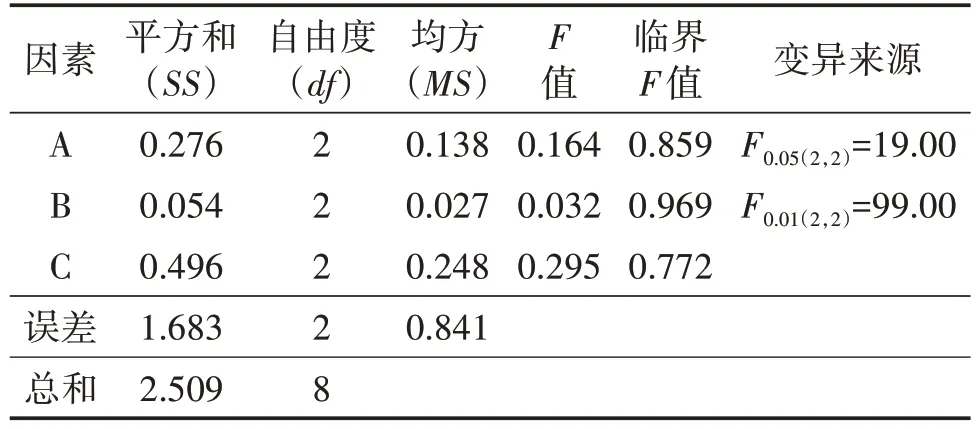
表6 正交設計方差分析表(完全隨機模型)
3 小結與討論
當前野生天麻資源匱乏,栽培天麻的產量、質量參差不齊,給市場供應帶來了一定的壓力。蜜環菌液體培養制品在藥理上與天麻有相似功能,通過利用蜜環菌來緩解天麻市場的需求,具有重要意義。基因是控制生物性狀的關鍵因素之一,試驗通過分析不同蜜環菌種質之間的rDNA-IGS 序列上的堿基差異,并通過液體培養,探究它們之間是否存在某種聯系。試驗結果表明,rDNA-IGS 序列的聚類與菌球表型的聚類存在一定的差異,即在rDNAIGS 序列的聚類中,第Ⅰ類包括M-01~M-05 和M-08~M-10,第Ⅱ類包括M-06、M-07 和M-11,而在菌球表型的聚類中,第Ⅰ類包括M-02、M-04 和M-08~M-10,第Ⅱ類包括M-01、M-03、M-05~M-07 和M-11,聚類結果存在差異,這可能是因為蜜環菌rDNA-IGS 比較保守的緣故。另外,M-03 在貴州省藥用植物繁育與種植重點實驗室被鑒定為芥黃蜜環菌。鑒定方法是采用引物ITS1/ITS4 擴增其rDNAITS 序列,其聚類結果與研究中rDNA-IGS 序列的聚類結果一致,并在NCBI 數據庫中對比發現M-03 與數據庫中的一株芥黃蜜環菌聚為一類,故認為M-03 可能為芥黃蜜環菌,可能是由于芥黃蜜環菌在核糖體基因上變異范圍較廣,或高盧蜜環菌與芥黃蜜環菌之間親緣關系較近造成了分類結果的差異。M-09 蜜環菌菌球液體培養表現較優,主要體現在菌球的個數和干重上,同時M-09 在Ⅰ類蜜環菌中6 bp處由A→G,該位點可能與菌球的個數或干重有關。Ⅱ類蜜環菌中M-11 變異位點有17 個,主要表現為堿基的缺失,在菌球的表型上表現為菌球較小,個數較少,干重較低。
蜜環菌作為天麻共生真菌,同時具有較高的藥用價值,其培養條件的研究引起了眾多學者的關注。前人對蜜環菌液體培養的研究多在于培養基的優化上,尤其是碳源、氮源的研究。程顯好等[11]對分離自山東煙臺和威海地區的蜜環菌菌株液體培養條件進行優化,結果表明最適碳源和氮源分別是糊精和豆餅粉提取液。楊海旭[12]發現秦巴山區蜜環菌優良菌株的最佳碳氮源分別為葡萄糖和蛋白胨。唐興國等[13]采用正交試驗同樣對櫟樹枝、毛竹根、葡萄糖、蔗糖、果糖、馬鈴薯等碳源、氮源進行優化,獲得一種蜜環菌液體種改良培養基配方(櫟樹枝100 g/L,毛竹根50 g/L,蔗糖20 g/L,馬鈴薯200 g/L,磷酸二氫鉀3 g/L,七水硫酸鎂1.5 g/L,VB110 mg/L,pH 自然)。以上研究均對培養基中的碳源、氮源進行優化,且篩選出較優的碳源和氮源以及適當的比例,但對于培養基中用量較少、價格較貴的成分研究較少。研究不僅對液體培養優良菌株進行篩選,還在固定碳源氮源的條件下,對磷酸二氫鉀、七水硫酸鎂及VB1的比例進行優化,得到其較優比例為5∶1∶2,以期在篩選適宜于液體培養的優勢蜜環菌的同時,減少此類成分用量并篩選出合適的比例。

