藻類連續培養體系的構建與優化及其在產毒和無毒微囊藻競爭中的應用
左俊 曾佳穎 楊絲雨 宋立榮 甘南琴
(1.中國科學院水生生物研究所淡水生態與生物技術國家重點實驗室,武漢 430072;2.中國科學院城市環境研究所城市環境與健康重點實驗室,福建省流域生態重點實驗室水生態健康組,廈門 361021;3.中國科學院大學,北京 100049)
藻類培養模式主要包括批次培養、半連續培養和連續培養。批次培養是指在一個封閉的反應器內加入一定數量的培養基后,接種藻種進行培養的一種培養方式,由于批次培養中底物的消耗和代謝廢物的積累,藻類一般表現為S型生長曲線,具有明顯的延遲期、對數生長期、穩定期和衰亡期[1]。半連續培養主要是在藻類培養過程中,當藻細胞達到一定濃度后,收獲一定量的藻液,補充等量培養液繼續培養[2]。半連續培養有利于藻細胞保持良好的生長狀態[3],主要是為了能夠重復地取得大量均一的培養藻細胞以供生化研究之用。連續培養是在藻類的整個培養期間,通過一定的方式使藻類能以恒定的比生長速率生長并能持續生長下去的一種培養方法。恒化培養是連續培養的一種類型,它是以恒定的流速使營養物質濃度恒定而保持培養物生長速率恒定的方法。這種培養方法常通過控制某種營養物的濃度,使其成為限制因子,而其他營養物均為過量。這樣,培養物的生長速率將取決于限制性因子的濃度。隨著培養物的生長,細胞密度會隨時間的增長而增高,而限制因子的濃度又會隨時間的增長而降低,兩者相互作用的結果使得培養物的生長速率恰好與恒速加入的新鮮培養基流速相平衡。目前連續培養已經成為室內研究藻類生理特性的重要培養方式。
由于水體富營養化及全球氣候變化,全球范圍內水生態系統藍藻水華暴發的頻率、范圍和強度呈現逐漸增加的趨勢,這些水華藍藻能夠產生對人及水生動植物有害的次生代謝物,損害水生態系統的功能,降低水資源的利用,帶來巨大的健康風險[4—7]。在藍藻水華監測和預警方面,現階段聚焦于外部環境參數如理化因子和氣象條件上的變化,忽略了特定藻類在生理生態學層面上的動態響應方式,因此難以準確地預測預報[8]。微囊藻水華是我國最為嚴重的藍藻水華之一[4,5],亟需通過生理生態學方法揭示其水華生消機制[8]。然而在自然水體中,產毒與無毒微囊藻存在競爭關系,但其驅動因素尚不明晰。目前有關產毒與無毒微囊藻競爭的研究主要集中在營養鹽N、P的變化、光照強度和CO2等方面[9]。但這些研究多以批次培養為主,少有連續培養的報道。在批次培養中,由于營養物質的消耗和有害代謝產物的累積,微囊藻的生長容易受到阻礙。但在天然湖泊等水體中,N、P等營養物質被消耗之后,在生物地球化學循環作用下,短期內可以迅速恢復。因批次培養中的營養物與野外水體之間存在顯著的差異,導致批次培養得到的實驗結果用于解釋野外水體中藍藻水華發生的機理時存在局限性。而在連續培養模式下,微囊藻的生長不會受到營養鹽的限制和有害代謝產物的影響,其生長速度、代謝活性都處于相對恒定的狀態,此時微囊藻生長變化只受到實驗單一或者復合因子的影響,而不會被其他因子干擾。因此,連續培養將成為研究產毒和無毒微囊藻競爭的主要培養手段[10,11]。
本研究通過微生物發酵罐,加裝外置環形光源,構建藻類連續培養系統,并通過優化參數,獲得最優培養條件,為室內開展藻類競爭試驗提供合適的培養模式。在此基礎上開展光強對產毒微囊藻與無毒微囊藻影響的試驗,為探究產毒微囊藻與無毒微囊藻的競爭演替機制提供技術支撐。
1 材料與方法
1.1 藻株和培養條件
本實驗所用的銅綠微囊藻(Microcystis aeruginosa)PCC 7806及其突變株PCC 7806mcyBmutant,由法國巴斯德藍藻藻種庫(Pasteur Culture collection of Cyanobacteria,PCC,France)提供。兩株藻種都是無菌株,前者是野生型產毒株,后者是人工無毒突變株。藻種培養條件為:溫度25℃,光強35 μmol/(m2·s)(冷光源),光暗比12h∶12h,M9培養基(改良自BG11[12])。M9培養基中除了NaNO3和NaHCO3外,其他成分同BG11。M9培養基配制時,不添加NaHCO3,滅菌后通過無菌濾器過濾除菌后,將NaHCO3加入滅菌后的培養基中。最后補加400 μL已用無菌濾器除菌的1 mol/L的HCl溶液,使得M9最終pH為8.5。
1.2 基本構造
實驗室開展的連續培養在BioFlo/CelliGen 115發酵罐(Eppendorf,EP)和BLBIO-5GJL發酵罐(百倫,上海)中進行。發酵罐主要包括罐體、檢測探頭、控制臺、循環水浴及樣品處理組件等(圖1)。EP罐體為3 L,百倫罐體為5 L,實驗時培養液占比在0.6(v/v)左右。發酵罐在攪拌和通氣作用下,使培養液不斷混勻。發酵罐溫度由溫度探頭實時測定,并經控制臺調配罐底的加熱裝置和外部夾套的冷卻循環水來達到平衡。罐體還有溶氧探頭、pH探頭和消泡探頭。補料泵A和出料泵B都由發酵罐主機控制,以恒定的速率泵入或泵出培養物。通過設置補料泵A的工作效率,如一個周期為60s,工作10s,停50s,從而達到控制泵入體積的目的(泵入體積=恒速泵速率×工作時間×工作效率)。新鮮培養基進入培養系統后,培養罐體內的液面會上升,當液面上升接觸到液位探頭后,觸發液位探頭啟動出料泵B,將培養液從發酵罐底部泵出培養體系。這樣通過補料泵A的持續泵入和出料泵B的自動泵出,達到平衡,保持培養體積恒定。稀釋率為每天泵入的新鮮培養基體積與培養體系總體積的比值。通過設置補料泵A的工作效率,調整泵入的體積,進而實現對稀釋率的精確調控。當藻細胞比生長速率與連續培養稀釋率相等時,培養系統進入穩定狀態,此時細胞密度保持恒定。
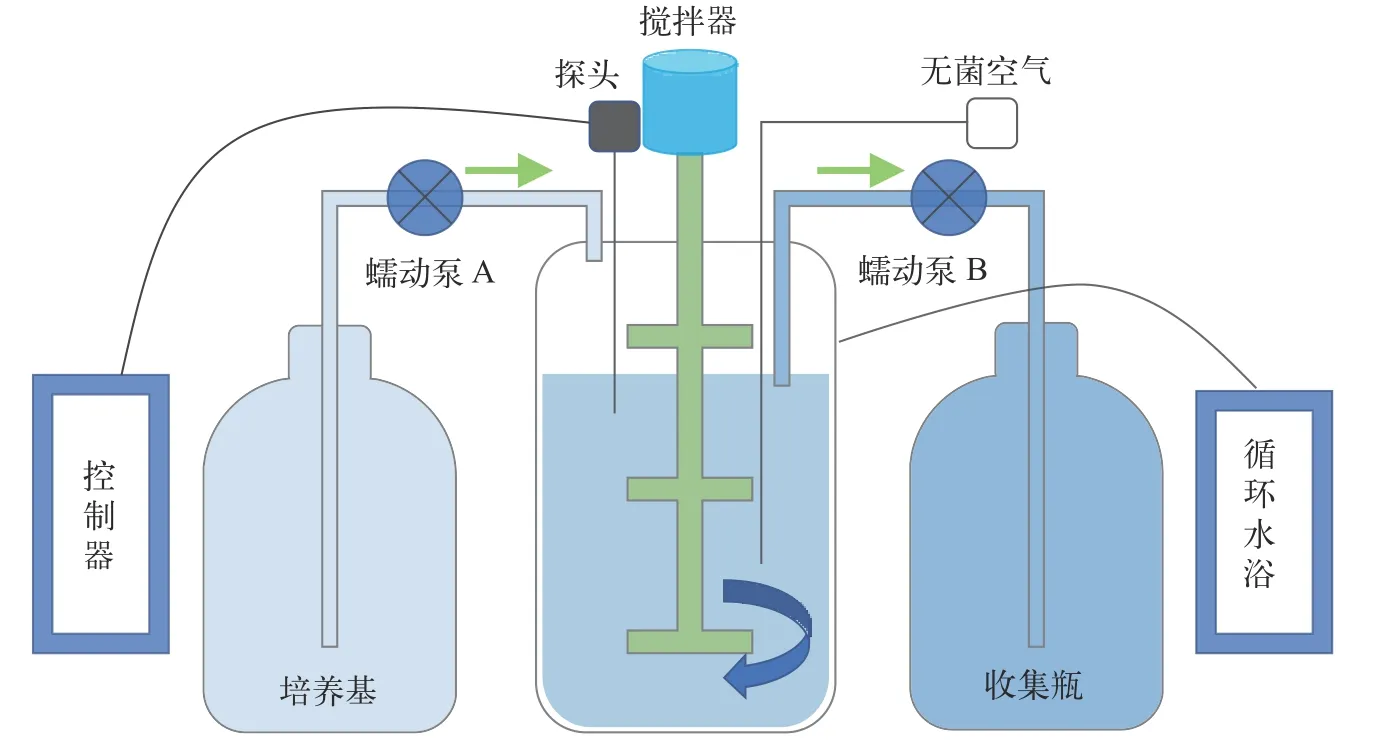
圖1 發酵罐連續培養示意圖Fig.1 Schematic diagram of continuous culture
1.3 培養條件和參數設置
連續培養溫度設置為25℃,光照35 μmol/(m2·s),光暗比為12h∶12h,培養基為M9。EP發酵罐培養體積為1.8 L,百倫發酵罐培養體積為3 L。發酵罐的稀釋率為0.075或0.15/d,通氣量為0.4 L/min,攪拌速度為50 rpm。起始接種量為(2—4)×106cells/mL,首先進行4d的預培養,然后在第4天開始連續添加新鮮培養基。
1.4 實驗設計
通過優化補加培養基的時間、接種密度和稀釋率對連續培養條件進行優化。起始按1∶1的比例接種產毒藻株PCC 7806和無毒藻株PCC 7806mcyB-,在選定天數取樣,測定細胞密度。連續培養條件優化共設計3個實驗。實驗一:起始接種密度為2×106cells/mL,稀釋率為0.15/d時,設置了3個補加培養基的時間:分別在第4、第6和第7天開始通入新鮮培養基。實驗二:起始接種密度為4×106cells/mL,稀釋率為0.15/d時,設置了2個補加培養基的時間:分別在第0和第4天開始通入新鮮培養基。實驗三:起始接種密度為4×106cells/mL,在第4天開始連續,設置2個稀釋率分別是0.075/d和0.15/d。
隨后開展了長周期和短周期培養過程中PCC 7806與PCC 7806mcyB-mutant競爭實驗。長周期實驗培養70d,短周期實驗培養22d。通過測定細胞數變化和無毒株比例變化,評價優化后短周期培養下的實驗結果。通過條件優化和競爭實驗結果分析最適培養體系。
在優化出最適培養體系后,我們還探索了不同光強在連續培養條件下對產毒藻和無毒微囊藻競爭的影響。實驗一共設置了4組光強,分別為5、15、35和80 μmol/(m2·s)。實驗周期為16d,每隔2天取樣,樣品備測。
1.5 細胞計數
每份初始藻液取1 mL加入10 μL魯哥試劑進行固定,設置3個平行。固定的樣品經振蕩混勻后,吸取10 μL加到血球計數板(上海求精)計數室,在普通光學顯微鏡(Eclipase E200,Nikon,Japan)下計數。每個樣品計數3次,每次均記錄上下2個計數室計數結果,樣品中藻細胞濃度由6次記錄的數據平均值計算得到。初始藻樣中細胞密度通過3個樣品平行計算平均值得到。
1.6 DNA提取
藻樣過0.2 μm的碳酸徑刻蝕膜(Nuclepore Track-Etch Membrane,Whatman,GE,USA),收集細胞,并立即存放在-20℃冰箱,用于后續DNA提取。用MP FastDNA SpinDown Kit(MP Biomedicals,LLC,France)提取基因組DNA,操作流程參照試劑盒說明書。DNA的濃度和純度使用超微分光光度計(NanoDrop 8000,Thermo Fischer Inc.,USA)進行測定。
1.7 標曲制備
以PCC 7806mcyB-mutant的基因組DNA作為定量產毒微囊藻和總微囊藻的標準。通過已知的DNA數量(以細胞數目來表示)與qPCR得到的Ct值(達到的閾值所需要的循環數)進行線性回歸,得到回歸曲線(標曲)[13]。將10 mL細胞密度為3.4×107cells/mL的PCC 7806mcyB-mutant抽濾到0.2 μm的碳酸徑刻蝕膜上,隨后提取基因組DNA。將提取的DNA進行10倍的梯度稀釋,得到7個(含原液)不同梯度的DNA樣品,細胞密度分別為3.4×106到3.4 cell/μL。qPCR生成的數據由iQ5(version 3.0,Bio-Rad,Hercules,CA)軟件通過最大相關系數方法計算得到Ct值,即軟件自動選取閾值,使得標準曲線的相關系數(R2)最大。
1.8 雙通道qPCR測定
Dittmann等在產毒銅綠微囊藻PCC 7806的mcyB基因中插入氯霉素抗性基因(Chloramphenicol resistance cassette,Cm),獲得了無毒的PCC 7806mcyB-突變體[14]。在雙通道熒光定量qPCR測定中,通過PC(PC-IGS,藻藍蛋白基因 PC中兩個蛋白亞基之間的基因間隔區域)和Cm分別定量競爭體系中總微囊藻和無毒微囊藻的數量,得到無毒微囊藻的比例。其中定量PC的探針序列是CY-5-5′-CCGCTG CTGTCGCCTAGTCCCTG-3′BHQ-2,正向引物序列是PC188F:5′-GCTACTTCGACCGCGCC-3′,反向引物序列是PC254R:5′-TCCTACGGTTTAAT TGAGACTAGCC-3′[15]。而定量Cm的探針序列為FAM-5′-ACCGTGTGCTTCTCAAATGCCTGAG GC-3′-TAMRA,正向引物序列為5′-GTTTATTGA CTACCGGAAGCAGTG-3′,反向引物序列為5′-CACGGGGAGAGCCTGAGC-3′[16]。
PCR反應在伯樂熒光定量PCR儀(Bio-Rad,Hercules,CA)上進行,該儀器配備有iQ5實時熒光檢測系統和處理軟件,能夠支持多通道熒光檢測。PCR反應總體系是20 μL,在96孔板(Bio-Rad)中進行。總體系包括10 μL 2×iTaq Universal Probes Supermix(Bio-Rad)預混液,1 μL BSA(牛血清蛋白,3 mg/mL),2 μL DNA樣品,0.4 μLPC的正反向引物和0.2 μLCm的正反向引物,最后補充無菌水至20 μL。PCR程序先在95℃預變性5min,隨后進行40個循環:95℃,15s;62℃下退火1min;72℃,30s。每個PCR樣品均設置3個平行,并添加不含DNA的無菌去離子水作為陰性對照。
1.9 數據分析
所有數據使用PASW Statistics 18.0(SPSS Inc,USA)進行統計分析,圖片使用Origin 2019b(Origin-Lab,USA)繪制。
2 結果
2.1 微囊藻連續培養條件的構建與優化
培養基補料時間的優化起始接種密度為2×106cells/mL,稀釋率為0.15/d時(如圖 2A),在細胞接種后,經過短時間的適應后,細胞數快速增加。不同處理下連續培養系統進入穩定期的細胞密度無顯著差異,但進入穩定期的時間有顯著差異。第4天開始補加培養基最先達到穩定,在第14天進入穩定期;第6天補料組在第16天進入穩定期,而第7天補料組在第18天才進入穩定期。這表明培養基補加時間越晚,連續培養系統進入穩定期的時間就越慢。
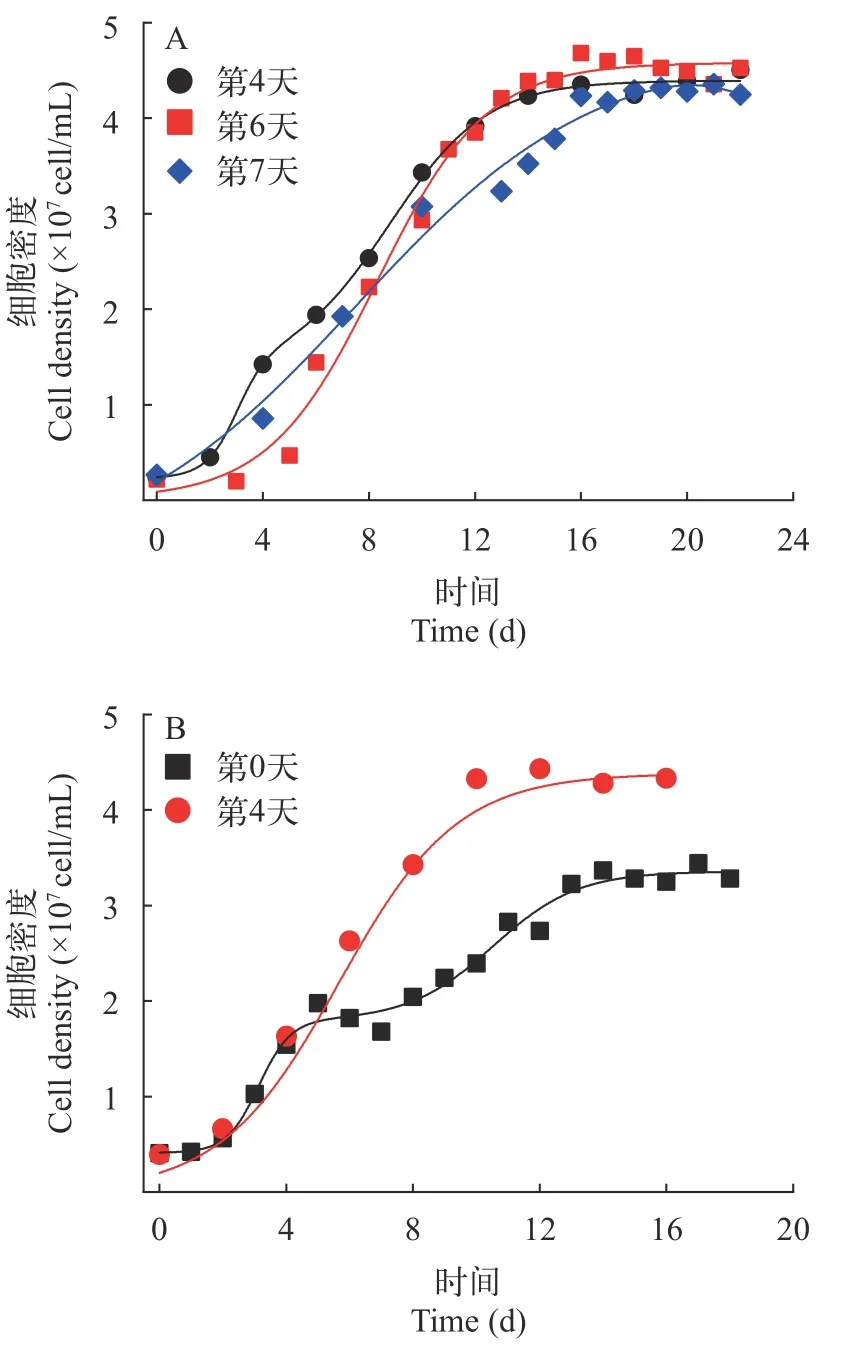
圖2 連續培養中不同補料時間處理下微囊藻細胞的生長曲線Fig.2 Growth curves of Microcystis when supplemented with medium on different days under continuous culture
起始接種密度為4×106cells/mL,稀釋率為0.15/d時(圖2B),第0天開始補加培養基的實驗組,在第14天進入穩定期,且細胞密度為3×107cells/mL;而第4天補料組在第10天就達到穩定,穩定期的細胞密度在4.3×107cells/mL。這表明,接種時就開始補加培養基,會推遲連續培養進入穩定期的時間,而且穩定期細胞密度比較低。比較培養基不同補加時間的結果表明,第4天開始補充新鮮培養基到連續培養系統較為合適。
藻種起始接種密度的優化第4天開始補加培養基,稀釋率為0.15/d時(圖3A),起始接種密度為4×106cells/mL的處理組在第12天進入穩定期,而起始接種密度為2×106cells/mL的處理組在第16天才達到平衡。不同接種密度的處理組進入穩定期后的細胞密度無顯著差異。
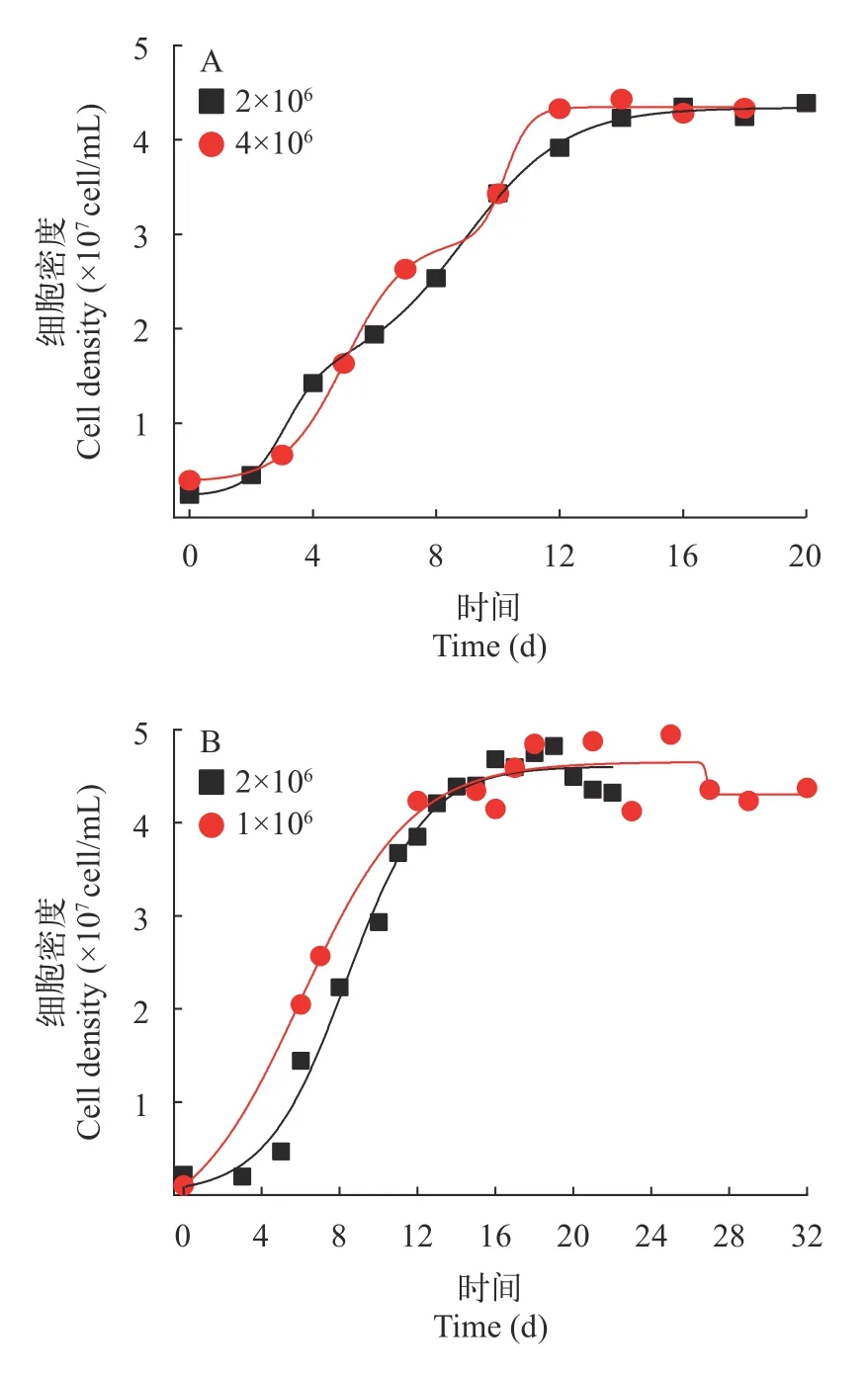
圖3 連續培養中不同接種密度處理下微囊藻細胞的生長曲線Fig.3 Growth curves of Microcystis with different inoculum densities under continuous culture
第6天開始補加培養基,稀釋率為0.15/d時(圖3B),起始接種密度為1×106cells/mL的處理組在第20天進入穩定期,而起始接種密度為2×106cells/mL的處理組在第16天進入穩定期。兩個處理組在穩定期的細胞密度無顯著差異。不同起始接種密度結果表明,較低的接種密度會推遲連續培養進入穩定期的時間,但過高的接種密度需要大量藻種。綜合來看,起始接種密度為4×106cells/mL時比較合適。
稀釋率的優化起始接種密度為4×106cells/mL,培養基在第4天補加時(圖4),稀釋率為0.075/d時,細胞生長緩慢,連續培養在20d后逐漸進入穩定期,細胞密度僅2.2×106cells/mL,而稀釋率為0.15/d時,細胞生長較快,在第10天就進入穩定期,穩定期細胞密度在4.3×106cells/mL。在連續培養達到穩定時,細胞比生長速率等于稀釋率。當稀釋率較低時,細胞生長較慢,在達到穩定時,細胞密度也較低。當稀釋率過高時,細胞比生長速率低于稀釋率,會導致系統無法進入穩定期。
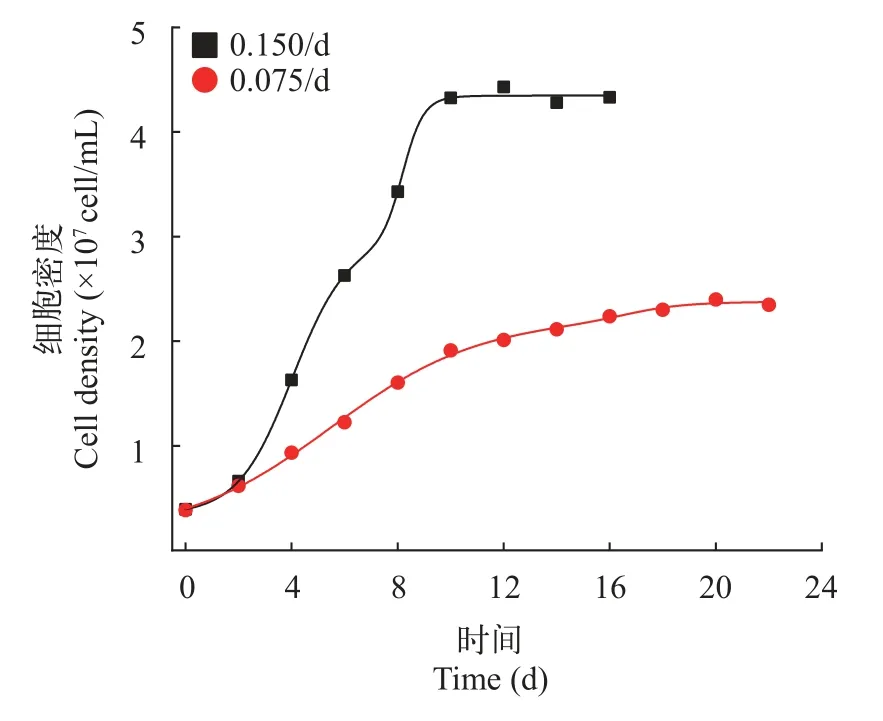
圖4 連續培養中不同稀釋率處理下微囊藻細胞的生長曲線Fig.4 Growth curves of Microcystis with different dilution rates under continuous culture
2.2 連續培養條件下產毒與無毒微囊藻混合培養條件的優化
混合培養中產毒與無毒微囊的定量測定產毒株PCC 7806與無毒株PCC 7806mcyB-在混合培養過程中的比例通過雙通道探針法qPCR來測定。如圖 5所示,在雙通道競爭PCR中,PC和Cm基因與細胞數之間均具有極顯著的相關性,兩者的回歸曲線分別為:y=-3.336 lg(x)+40.425(R2=0.999,n=3,P<0.001)和y=-3.537 lg(x)+40.165(R2=0.997,n=3,P<0.001)。式中x表示樣品中 DNA 的量(以細胞數的對數值表示),y表示樣品的Ct值。兩者的擴增效率E分別為99.4%和91.8%。在所有的樣品測定過程中,PC和Cm基因的擴增效率在91%—102%,擴增曲線的相關系數R2均大于0.995,表明雙通道探針法qPCR可以用來定量和區分產毒株PCC 7806和無毒株PCC 7806mcyB-。
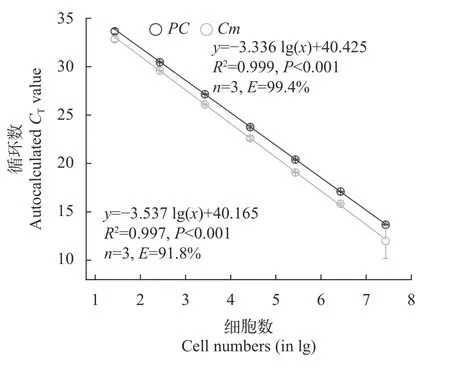
圖5 雙通道qPCR中無毒株PCC 7806 mcyB- PC和Cm基因擴增的標準曲線Fig.5 Standard curves for PC and Cm genes based on predetermined concentrations of DNA (given as log10 cell number equivalents)of the non-toxic Microcystis strain PCC 7806 mcyB-,amplified by multiplex real-time PCR
產毒株與無毒株在長周期培養下的競爭狀況長周期培養在第6天開始持續、恒定補充新鮮M9培養基到發酵罐中。初始接種密度為1.0×106cells/mL。在接種后,總細胞數快速增加,在20d左右達到最大值,其后近40d培養中,細胞數目一直維持在4.5×107cells/mL左右,沒有顯著變化(圖6)。產毒株比例在接種后逐漸降低,最后穩定在15%左右,而無毒株比例則逐漸上升,最后穩定在85%左右。細胞比例變化在20d左右達到平衡,隨后一直保持不變。這說明在連續培養系統達到穩定后,細胞密度在較長時間內維持不變,而且產毒株與無毒株以不同優勢共存,兩者比例也長時間保持不變。
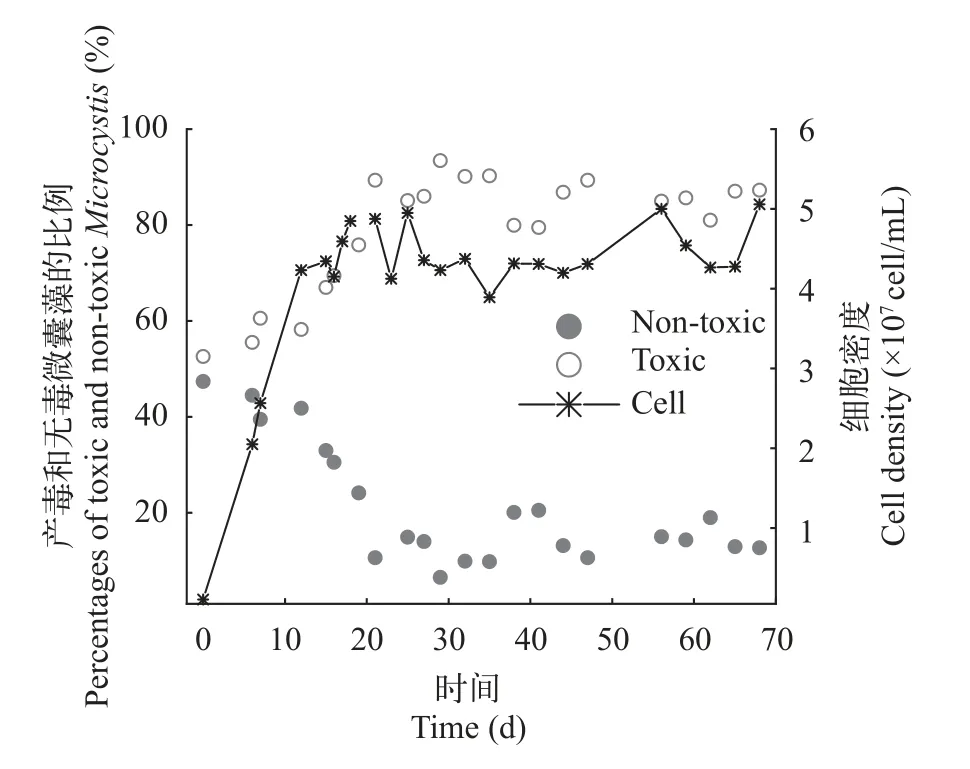
圖6 長周期的連續培養條件下產毒微囊藻(PCC 7806)與無毒微囊藻(PCC 7806 mcyB-)中細胞比例變化和總細胞數變化Fig.6 Percentages of the toxic Microcystis (PCC 7806) and nontoxic Microcystis (PCC 7806 mcyB-) and total cell density in competition under continuous culture for a long time
產毒株與無毒株在短期培養下的競爭狀況當初始接種密度為1.0×106cells/mL時,連續培養系統在20d左右才達到平衡。為了縮短實驗周期,在優化后的培養條件下進行競爭實驗。接種密度為4.0×106cells/mL,并在第4天開始補充培養基。如圖 7所示,在改變初始接種量后,競爭體系在第10天左右就達到了穩定,此后細胞比例和細胞數都沒有顯著變化。在達到穩定后,產毒株比例維持在20%左右,無毒株比例維持在80%,這與長周期培養下的結果一致。這說明連續培養達到穩定后,產毒與無毒株競爭格局不再隨時間發生變化。
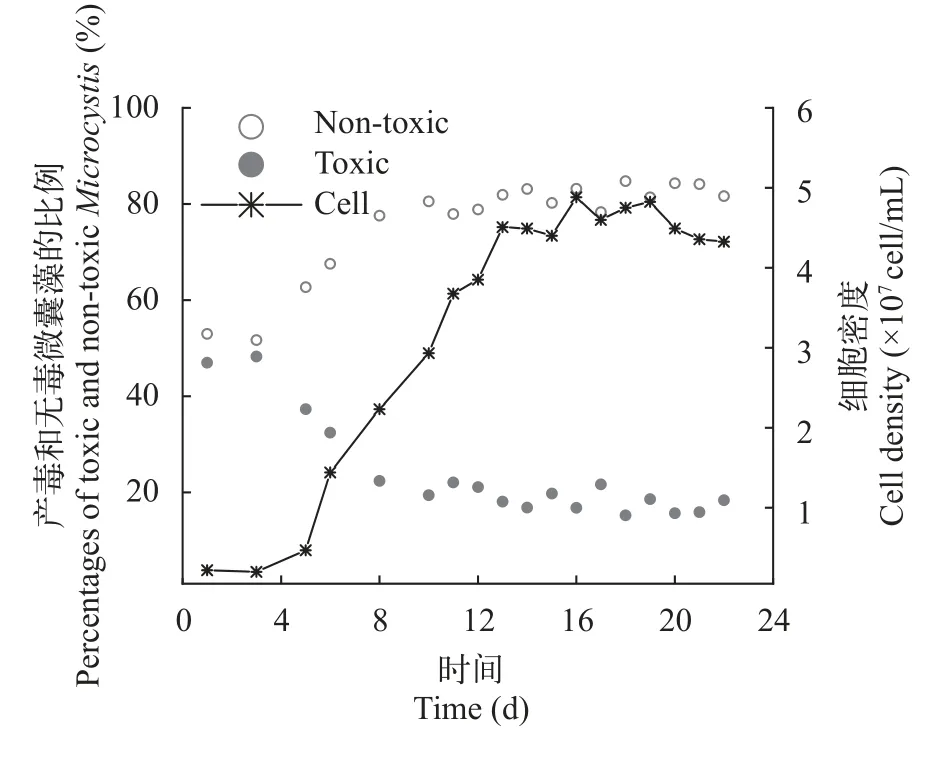
圖7 短周期連續培養條件下產毒微囊藻(PCC 7806)與無毒微囊藻(PCC 7806 mcyB-)競爭中細胞比例變化和總細胞數變化Fig.7 Percentages of the toxic Microcystis (PCC 7806) and nontoxic Microcystis (PCC 7806 mcyB-) and total cell density in competition under continuous culture for a short time
產毒株與無毒株競爭過程中溶解氧和pH變化如圖 8所示,在光照周期為12h∶12h作用下,溶氧(DO)呈現明顯的周期變化,白天(照光時)升高,晚上(黑暗時)降低,開始補充培養基之前,DO呈現逐漸升高的趨勢,在第5天開始補充新鮮培養基后,DO開始下降,隨后趨于穩定,從10天左右開始,其波動范圍不再顯著改變。pH變化在光合作用影響下,也呈現出周期性波動,變化趨勢和DO一致,即pH先升高,在第5天通入新鮮培養基后開始下降,隨后趨于穩定,從第10天左右開始pH變化維持在9.3—9.5,不再顯著改變。DO和pH變化表明,連續培養系統進入穩定期后,二者隨光周期變化保持周期性變動,其變化范圍保持不變。
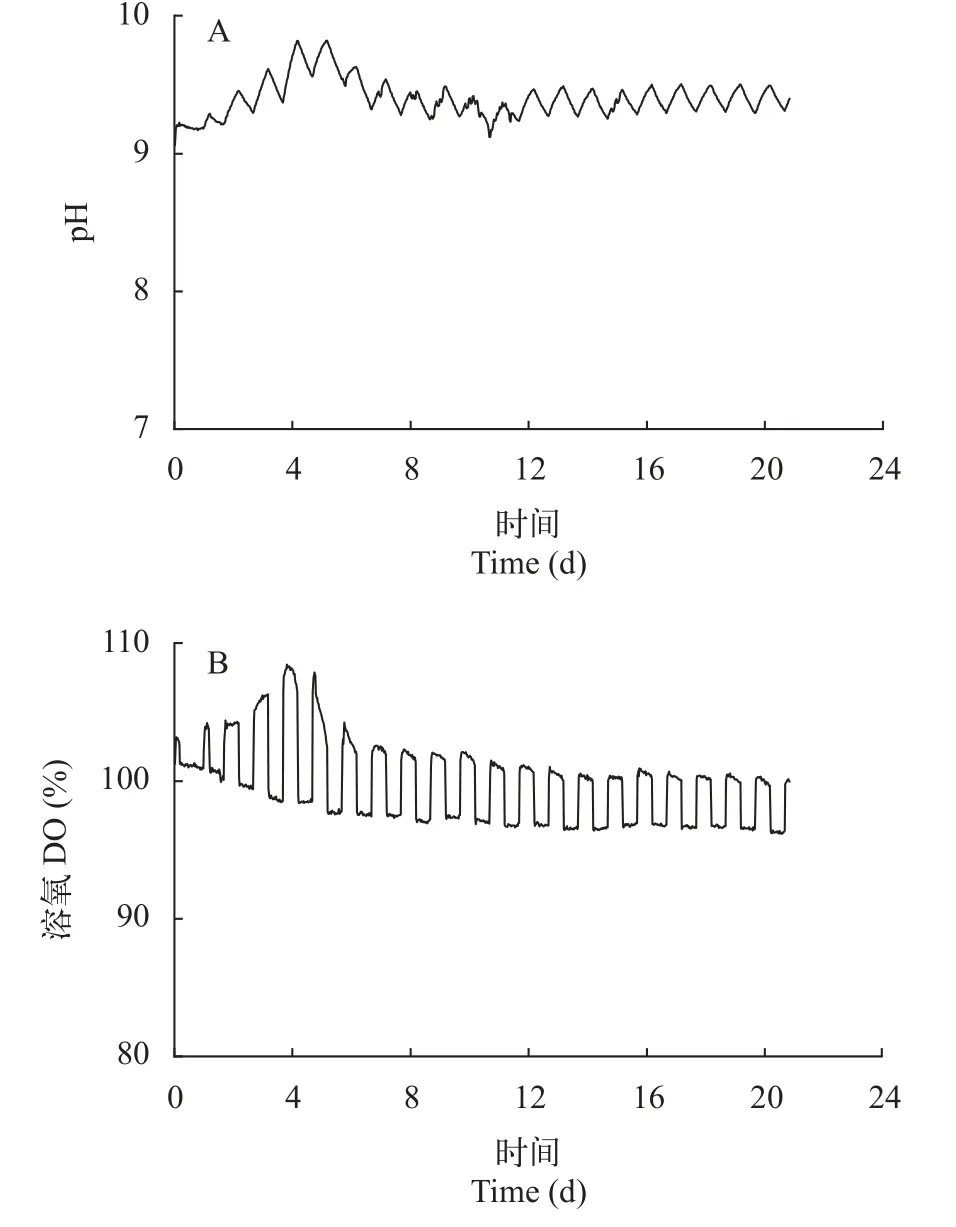
圖8 連續培養條件下產毒微囊藻(PCC 7806)與無毒微囊藻(PCC 7806 mcyB-)競爭中pH(A)和溶氧(B)變化Fig.8 Variations on pH (A) and DO (B) in competition between toxic Microcystis PCC 7806 and non-toxic Microcystis PCC 7806 mcyB- under continuous culture
綜合長周期和短周期培養實驗結果及胡麗麗[17]的實驗數據,我們將連續培養的初始接種量設定為(3.0—4.0)×106cells/mL,稀釋率為0.15/d。新鮮培養基在第4天加入,此時連續培養在10d左右就可以達到平衡。當競爭體系達到穩定后,細胞比例不再變化,因此,在后期開展的實驗中,將實驗周期設定為14—16d。
2.3 光照對產毒與無毒微囊藻競爭態勢的影響
在建立連續培養體系后,我們探究了不同光強對產毒和無毒微囊藻競爭的影響(圖9)。在35 μmol/(m2·s)的光照(對照組)下,無毒株比例逐漸增加,隨后穩定在80%左右,而產毒株比例則下降至20%左右。在高光下[80 μmol/(m2·s)],仍然是無毒株占據80%左右比例。在低光[15 μmol/(m2·s)]和弱光[5 μmol/(m2·s)]下,無毒株和產毒株都維持在初始比例,沒有發生顯著改變,但在弱光下,無毒株比例有下降的趨勢。綜合來看,光充足時,無毒株占絕對優勢,而光限制時,無毒株和產毒株無明顯差異。雖然在不同光強處理下,無毒株比例變化有明顯差異,但是在所有處理組中,無毒株和產毒株仍舊以不同優勢共存,沒有出現消亡現象。
3 討論
藻類生理生態學研究對于揭示藍藻水華暴發、維持及衰亡機制具有重要意義。傳統的批量培養模式往往會受到營養鹽消耗和有害代謝物質積累等的影響,而連續培養更接近于野外水體營養的變動,減少其他非控制因素對藍藻細胞生長產生的影響。本研究利用發酵罐構建了一套藻類連續培養系統。以產毒微囊藻PCC 7806及其無毒突變株PCC 7806mcyB-為培養材料,對連續培養的各項參數進行了優化。在藻種接種到培養基后,需要短暫的適應過程,因此起始補料時間會影響培養系統進入穩定期的時間。過短,如第0天,或者過長,如第7天,都會延遲系統進入穩定期的時間(圖2),而第4天開始進行補料比較合適,此時培養系統能夠較快進入穩定期。起始接種密度優化結果表明,提高接種密度,可以加快培養系統進入的時間(圖3),但過高的接種密度需要消耗大量的藻種,結合本研究結果,4×106cells/mL的起始接種密度較為合適。在系統進入穩定期后,藻細胞的比生長速率與稀釋率相等,所以稀釋率不僅影響系統進入穩定期的時間,還決定了穩定期的細胞密度。稀釋率較低時,系統進入穩定期較慢,且穩定期時細胞密度也比較低;而提高稀釋率時,系統可以較快進入穩定期(圖4)。藻類在一定稀釋率范圍內進行連續培養時,生物量(穩定期時的細胞密度)會隨著稀釋率的增加而增加,而當稀釋率超過臨界值之后,藻細胞未能充分生長便被帶出培養系統,生物量反而會隨著稀釋率的增加而下降。大量研究表明,藻類連續培養時都存在一個最佳稀釋率,例如杜氏鹽藻(Dunaliella salina)和三角褐指藻(Phaeodactylum tricornutum)的最佳稀釋率為0.15/d,而柵藻為0.31/d,藻細胞在最佳稀釋率下培養時,系統達到穩定后的生物量明顯高于其他稀釋率下的生物量[18—21](圖4)。綜合補料時間、起始接種密度和稀釋率,我們得到了連續培養的最適培養條件:第4天開始補料,起始接種密度為4×106cells/mL,稀釋率為0.15/d。
建立連續培養系統并優化后,我們探究了產毒與無毒微囊藻在連續培養下的競爭格局。但產毒微囊藻與無毒微囊藻混合培養后,傳統方法無法將其區分。而qPCR定量方法,可以針對特異性序列對靶基因進行定量。因此,我們采用了雙通道探針法qPCR來測定無毒微囊藻和總微囊藻。該方法通過特異性探針來監測PCR反應進程,與傳統染料法相比,大大提高了特異性,而且縮短了時間和人力成本,僅需一次測定就可以得到無毒株和產毒株的比例;而且已經被證明可以精確定量室內培養和野外樣品中產毒微囊藻的比例[9]。本研究中PC和Cm基因的擴增曲線顯示雙通道探針法qPCR可以精確定量產毒和無毒微囊藻(圖5)。隨著分子生物學技術的發展,探針合成成本逐漸降低,熒光定量PCR儀也將更加普及,未來雙通道qPCR定量檢測產毒藍藻將成為主流。
測試了qPCR定量產毒和無毒微囊藻效果后,我們開展了產毒微囊藻PCC 7806及其無毒突變株PCC 7806mcyB-的競爭實驗。在長周期(70d培養)的培養中,系統達到穩定后,產毒株與無毒株的比例不再發生變化,并且可以長時間維持穩定(圖6)。為了縮短連續培養周期,我們在優化后的培養條件下,開展了短周期的競爭實驗,此時連續培養在10d左右就進入了穩定期,而且穩定期時產毒株和無毒株比例與長周期一致(圖6—7),這表明優化后的實驗競爭體系可以表征產毒與無毒微囊藻的競爭格局。后續競爭實驗在此條件下,只需要進行14—16d即可。
利用優化的連續培養系統,我們開展了不同光強對產毒與無毒微囊藻競爭影響的實驗。在35和80 μmol/(m2·s)光強下,無毒株占據優勢;而在15和5 μmol/(m2·s)光強下,無毒株和產毒株沒有優勢差異(圖9)。Kardinaal等[22]發現在25 μmol/(m2·s)光強下,無毒株占據優勢,甚至能夠替換產毒株,但Van de Waal等[10]則發現在25 μmol/(m2·s)光強下,產毒株占據明顯優勢。由于Kardinaal等[22]的研究和本研究中用到的藻株都出現在Van de Waal等[10]的研究中,因此產毒株和無毒株在不同光強下競爭的差異,不能簡單歸因于藻株差異。PCC 7806mcyB-突變株是在mcyB片斷插入氯霉素抗性基因[14],從而使得mcyB基因失活,不能合成微囊藻毒素,其他的遺傳基因保持不變。Hesse等[23]分析PCC 7806及其突變株PCC 7806mcyB-的差異,發現不同光照強度下兩株藻生長的生長并沒有顯著性差異,只是突變株相對野生型PCC 7806而言,其色素的含量有所下降。雖然微囊藻毒素合成被認為是耗能過程,但是這部分耗能可能相對比較低[24],而且PCC 7806mcyB-突變株雖然不能合成毒素,但是mcyABC等基因的轉錄過程不受影響[25],這部分活動也需要能量。因此,產毒株因為合成MCs耗能而在各種限制條件下相對于無毒株占據優勢的假說也無法解答光限制下的差異。通過更多藻株進行實驗可能有助于解答產毒株與無毒株在競爭中的差異。

圖9 在連續培養條件下不同光強處理中產毒微囊藻(PCC 7806)與無毒微囊藻(PCC 7806 mcyB-)細胞比例的變化Fig.9 Percentages of the toxic Microcystis (PCC 7806) and non-toxic Microcystis (PCC 7806 mcyB-) in competition under continuous culture when treated with different lights
綜上所述,在不同因素作用下,產毒與無毒微囊藻競爭的結果往往存在巨大差異,這可能和藻株差異有關,而其實質是微囊藻屬基因組具有很強的柔性和可塑性。比較基因組學研究表明銅綠微囊藻擁有一個巨大的,開放的泛基因組,核心基因組約占到每個基因組大小的(48.4±4.6)%[26]。不同微囊藻藻株基因組在基因組成、數目與排列等方面都有較大差異,每株微囊藻均包含有數百至上千個藻株特有基因,而各藻株的核心基因數目只有2100個左右,少于各藻株基因總數目的1/2,這些結果可能解釋微囊藻不同藻株間的表型多樣性[27]。基于此,開展室內產毒與無毒微囊藻競爭實驗時,選取多株藻株進行實驗,可能得到更科學的結果。
4 結論
本研究利用發酵罐構建了藻類連續培養系統。通過對補料時間、起始接種密度和稀釋率的優化,得到了最優培養條件。在光照為35 μmol/(m2·s)的連續培養條件下產毒微囊藻PCC 7806及其無毒突變株PCC 7806mcyB-以1∶1接種后會達到平衡,但兩者以不同的優勢度(即無毒株占據優勢)長期穩定共存,而且通過優化后的培養體系,可以表征產毒與無毒微囊藻的競爭格局。在優化的連續培養條件下,當光充足時[35和80 μmol/(m2·s)],無毒株在連續培養中占據優勢;而光限制時[15和5 μmol/(m2·s)],無毒株和產毒株維持初始接種比例不變。

