生物活性物質遞送體系下絲素蛋白微膠囊的研究進展
吳建兵, 耿涵梟, 顧舒婷, 孫銀銀, 王永峰
(1.常熟理工學院 紡織服裝與設計學院,江蘇 蘇州 215500; 2.中國科學院蘇州納米技術與納米仿生所國際實驗室,江蘇 蘇州 215123)
生物活性物質是指對人類生命活動起調節功能的生理活性成分,能維持人體健康狀態和預防慢性疾病[1]。然而,在使用過程中,許多生物活性物質例如多酚、黃酮類、維生素、益生菌、蛋白多肽等,易受到溫度、酸堿性、離子強度、光照等外界因素影響,導致其活性迅速降低[2]。因此,開發一種遞送體系實現其高效裝載、持久穩定活性及可控釋放是目前研究中亟須解決的問題。
遞送體系是將生物活性物質裝載在載體基質中,保護活性免遭破壞的同時控制釋放速率,提高利用率[3]。遞送體系的載體基質形式有多種,其中微膠囊具有力學性能優異、穩定性好、裝載量高、壁材通透性可控等優點,是一種理想載體基質[4]。微膠囊具有完整囊膜的中腔結構,粒徑約為1~1 000 μm[4],形狀各異,其中以球形居多,囊膜厚度與層數可控。微膠囊可裝載固體、液體或氣體多種形式的物質,穩定其生物活性,同時可利用囊膜的選擇通透性調控釋放速率[5]。一般將被裝載的物質稱為芯材,用于裝載的物質稱為壁材。
目前,用于制備微膠囊壁材的材料主要包括天然高分子[6]、合成高分子[7]和無機材料[8]。天然高分子通常具有低毒性和高生物相容性,有利于生物活性物質的裝載、穩定及修飾。常用的天然高分子主要包括殼聚糖[9]、明膠[10]和藻酸鹽[11]。盡管這些材料在生物活性物質的遞送體系中作用突出,但仍存在不足,例如陽離子的殼聚糖細胞毒性強[12-13],且易在酸性下溶解[14];明膠在體內降解速率較快、機械性能差[15];藻酸鹽受鈣離子的濃度影響較大,以凝膠材料為主,應用范圍受限[16]。絲素蛋白具有優異的生物相容性[17]、極低的免疫原性[18],大量研究證實了其對生物活性物質有高度的親和性[19],是最為理想的穩定生物活性物質的天然高分子之一[20]。全水相條件純化下的絲素蛋白溶液可塑性強,可通過簡單、溫和的方法下制備成膜、凝膠、納微米球、支架、微針、微膠囊等多種形態的材料[21],并在酶[22]、胰島素[23]的裝載、穩定及遞送方面取得了豐富的研究成果。其中,微膠囊的研究最為活躍[24],其具有制備方法相對簡單、理化性能可控、生物活性物質裝載效率高、易化學修飾改性等優勢,因此,在生物活性物質的穩定、可控釋放及遞送方面的潛力巨大。
近年來,由于納米技術的突飛猛進使得國內外研究人員對絲素蛋白微膠囊在生物活性物質的持久穩定及高效遞送體系中的應用產生了濃厚的興趣。本文重點綜述絲素蛋白微膠囊作為生物活性物質遞送體系的研究進展。首先對絲素蛋白成囊的機理進行深入分析,其次對其制備方法進行詳細比較,然后對其理化性能及影響因素進行闡述,最后介紹其用于生物活性物質遞送體系下的應用現狀,以期為絲素蛋白微膠囊在遞送體系中的開發利用提供參考。
1 絲素蛋白成囊機理
Hermanson等[25]以重組蜘蛛絲蛋白(C16)為例,對蛋白質在乳液(甲苯和水)界面處的動態行為進行深入研究,結果表明蛋白質通常會在界面處發生吸附和變性。如圖1所示[25],蜘蛛絲蛋白在水和甲苯液滴界面處自組裝成囊共涉及3個過程:1) 蛋白質吸附;2) 蛋白質分子折疊;3) 蛋白質重折疊和組裝成膜。因此,結合前人的研究工作[25-26],筆者認為絲素蛋白成囊的機理需要經歷4個階段:1) 共混液中形成分散相(芯材)和連續相(壁材),芯材可以是液體或者固體;2) 絲素蛋白分子中的疏水氨基酸殘基向芯材界面區域擴散并吸附在芯材表面,此時蛋白質分子可以是部分折疊或未折疊狀態;3) 在外界條件刺激下(噴霧干燥[24]、甲醇[27]、乙醇[28]、高濃度氯化鈉[29]、低pH值[30]、聚乙二醇[31]),絲素蛋白分子可通過氫鍵、分子間作用力的非共價鍵(疏水作用力)、共價鍵等方式誘導絲蛋白分子重折疊和自組裝;4)絲素蛋白進一步自組裝形成納米結晶體并聚集增大,沉積在芯材表面,在界面處形成完整的囊膜(整個吸附和組裝過程小于30 s)。成囊過程可通過對絲素蛋白的濃度、芯材的尺寸和外界刺激等因素進行調控。

圖1 蜘蛛絲蛋白在水和甲苯液滴界面處通過自組裝成囊過程示意
2 絲素蛋白微膠囊的制備方法
2.1 噴霧干燥法
基于上述成囊機理,噴霧干燥法[32]制備微膠囊需經歷4個過程:1) 制備共混乳液;2) 高壓均質化乳液;3) 高壓霧化形成微細液滴;4) 在干燥氣流下,微細液滴表面的水快速蒸發,絲素蛋白迅速固化包覆芯材形成微膠囊(圖2)[32]。Hino等[33]將連續相的絲素蛋白乳液在較高溫度下送入干燥室,隨著水分快速蒸發形成囊膜,最大程度上穩定芯材(茶堿)的活性。另外,探討了絲素蛋白微膠囊的二級結構與空氣濕度的關系,結果表明無規卷曲的絲素-茶堿微膠囊易在室溫、89%濕度條件下發生構象轉變(β-折疊),進而提高其穩定性。Wang等[24]通過噴霧干燥法制備了姜黃素-絲素蛋白微膠囊,并分析了姜黃素的裝載量與噴霧干燥參數(進出口溫度、進料流速、噴嘴口尺寸、霧化壓力)及絲素蛋白濃度之間的關系。盡管噴霧干燥法具有流程簡單、過程易控制及可工業化生產等優勢,但是仍存在微膠囊易聚集、芯材包覆效率低及生產成本高等問題。
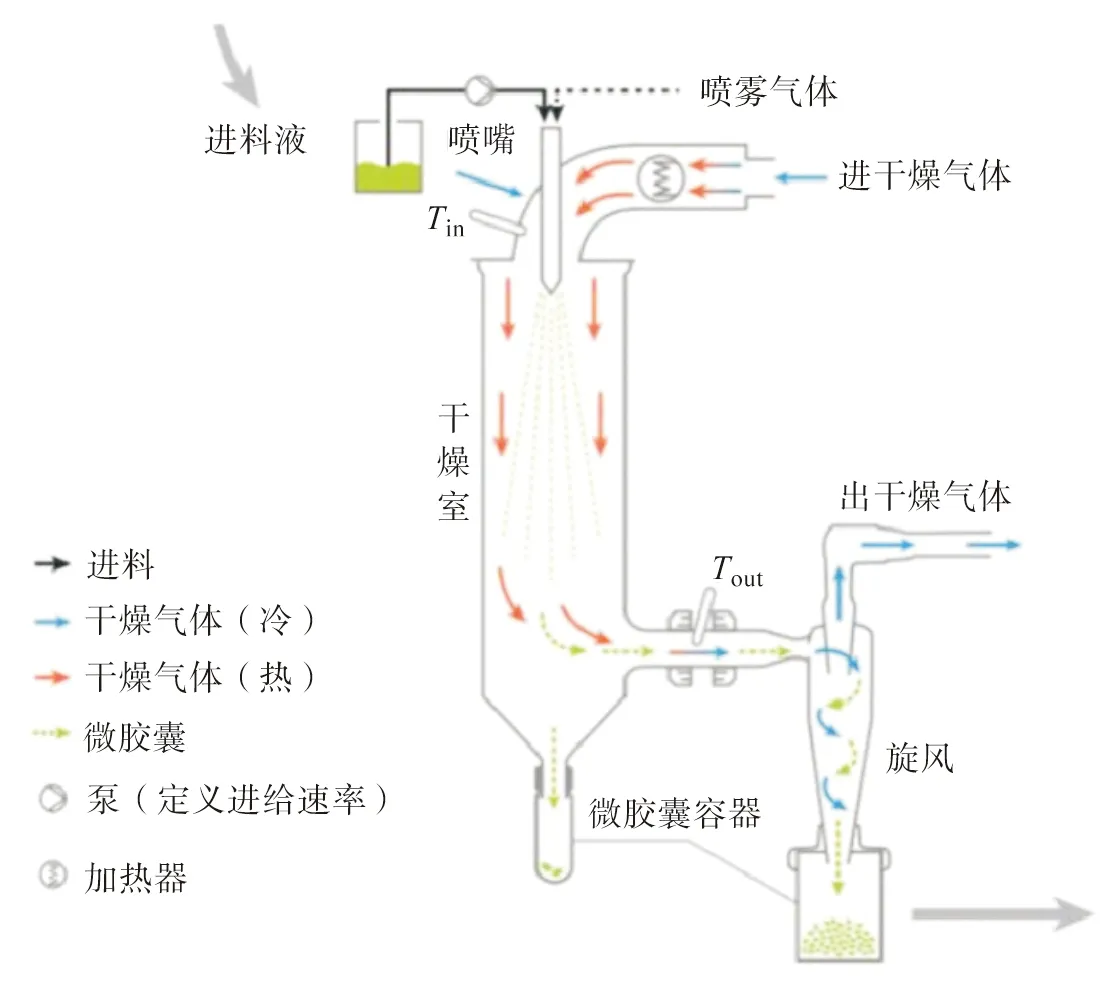
圖2 噴霧干燥法制備絲素蛋白微膠囊的過程示意
2.2 復凝聚法
在復凝聚法中,一般將不同電荷的聚合物作為壁材引物,再將芯材分散在壁材引物的水溶液中。在一定條件下,電性相反的聚合物引物就會迅速相互吸引,發生凝聚形成復合聚合物,并析出沉積在芯材表面形成囊膜。Basal等[34]首先將正二十烷分散在帶負電荷的絲素蛋白溶液中,并加入司盤-20降低乳液的表面張力;然后,向上述溶液中加入帶正電荷的殼聚糖溶液,使相反電荷的絲蛋白與殼聚糖迅速相互吸引,并調節pH值使復合物凝聚析出,不斷沉積在乳液界面處,進一步加入戊二醛交聯以提高微膠囊的穩定性。此方法制備的微膠囊形貌不規整、易團聚、分散性差,另外戊二醛等交聯劑的使用也會影響載體基質的生物安全性。
2.3 層層組裝法
層層組裝(Layer-by-layer,LBL)法需要以不同形狀的硬質材料(無機或聚合物)為模板,將絲素蛋白分子通過靜電、氫鍵、非共價鍵或共價接枝等方式吸附到其表面,緊接著在變性劑和交聯劑的作用下誘導絲素蛋白自組裝形成穩定的囊膜,再將模板溶蝕(物理或化學)后得到中空的微膠囊,整個過程需要循環多次。Shchepelina等[35]將絲素蛋白分子通過疏水和氫鍵作用吸附到球形二氧化硅模板上,再利用甲醇誘導其構象轉變(無規卷曲到β-折疊),促進其自組裝結晶沉積到模板上,周而復始多次形成微膠囊(圖3(a));Ye等[36]先分別利用聚L-谷氨酸和聚賴氨酸對絲素蛋白中的絲氨酸和酪氨酸進行改性接枝,得到不同電荷的聚合物,緊接著通過電荷作用將其吸附在經聚乙烯亞胺(PEI)處理的二氧化硅微球上,如此循環多次,最后利用交聯劑(EDC)穩定微膠囊(圖3(b));同樣思路,Geryak等[37]先將胺基聚合物(SF-PL)與聚乙二醇(PEG)共價接枝得到帶正電荷的SF-PL-PEG聚合物,再與負電荷的羧基聚合物(SF-PG)相互吸附、沉積,反復多次,最后通過EDC交聯形成SF-PL-PEG/SF-PG微膠囊。Du等[38]以聚乳酸-羥基乙酸共聚物(PLGA)微球為模板,利用乙醇增強絲素蛋白與PLGA之間的疏水作用力,進而促進絲素蛋白的吸附和自組裝,再通過乙腈與1-甲基-2-吡咯烷酮溶蝕PLGA微球,得到單層絲素蛋白微膠囊。Drachuk等[39]先通過PEI處理二氧化硅以固定DNA,再以此為模板吸附絲素蛋白分子,同樣在甲醇誘導下加快絲素蛋白自組裝沉積形成穩定的膜,再利用氫氟酸(HF)溶蝕二氧化硅得到絲素蛋白微膠囊,并為金納米粒子(AuNPs)和抗體(IgG)的功能化設計提供載體基質。LBL法制備的微膠囊可實現復雜結構和理化性能的精細調控,也可引入功能性基團對微膠囊進行化學修飾,賦予微膠囊功能化和智能化響應。然而其制備方法繁瑣,涂層的成囊影響因素多(絲蛋白相對分子質量、濃度、電荷密度、pH值、離子濃度),化學交聯劑(EDC或戊二醛)的引入會降低其生物安全性。

圖3 LBL法制備絲素蛋白微膠囊的過程示意
2.4 乳液模板自組裝法
水油兩相界面存在熱力學不穩定的問題,可通過加入乳化劑吸附在其界面處穩定液滴。乳液模板自組裝法是利用高分子材料的乳化特性,能在界面處穩定液滴的同時進而固化形成囊膜的基礎上發展起來的技術[40]。氨基酸組成的絲素蛋白具有雙親性,已證實可作為天然乳化劑用于納米乳液的穩定[41]。受上述絲素蛋白成囊機理啟發,先利用絲素蛋白吸附在兩相界面處穩定乳液形成模板,再經外界刺激誘導絲素蛋白自組裝固化形成穩定的囊膜附著在液滴表面,其過程包括3個階段:1) 可添加表面活性劑或固體粒子(Pickering效應),進一步降低兩相(連續相和分散相)之間的界面張力,得到穩定的乳液;2) 引入絲素蛋白的不良溶劑,促使絲素蛋白分子暴露疏水基團,引發自組裝;3) 通過疏水作用在芯材液滴表面沉積,最終包覆液滴表面以形成微膠囊。Cheng等[42]用絲素蛋白納米纖維乳化油滴形成乳液(圖4(a)),并深入研究了絲素蛋白的濃度、構象、乳化轉速和乳化時間等參數對乳液穩定性的影響,另外選擇了不同極性的油相(正己烷、正己醇、十二烷、丁酸丁酯)來驗證絲素蛋白作為乳化劑的適用性。研究結果發現,高晶絲素蛋白納米纖維形成的乳液具有優異的均一性、分散性和持久穩定性(長達6個月),這可能與絲素蛋白在界面處的吸附能力、排列緊密程度和界面強度有關。Wang等[24]先以二氧化硅穩定油相形成Pickering乳液,再加入絲素蛋白溶液經高速攪拌、勻漿共混。研究過程中發現,絲素蛋白分子能均勻擴散至二氧化硅顆粒之間,以及二氧化硅與油相的界面處,在Pickering乳液界面周圍形成三維網絡薄層結構,使乳液穩定,這可能與大量氫鍵的形成有關。緊接著加入PEG誘導絲素蛋白疏水區暴露,絲素蛋白由無規卷曲向α-螺旋轉變并自組裝析出,形成穩定的囊膜(圖4(b))。乳液模板自組裝法制備方法簡單、溫和、高效,無有機溶劑和交聯劑的添加,也不需強酸溶蝕模板,使得絲素蛋白微膠囊的生物安全性得以保證,有望工業化生產。

圖4 乳液模板自組裝法制備絲素蛋白微膠囊的過程示意
3 絲素蛋白微膠囊的理化性能
3.1 粒 徑
絲素蛋白微膠囊的粒徑會直接影響其機械性能和活性物質的擴散及釋放速率。粒徑越小,其比表面積越大,擴散和釋放速率越快;同時,粒徑越小,其機械強度相對越高。由表1可知,噴霧干燥法、復凝聚法、LBL法及乳液模板自組裝法中,微膠囊的粒徑分布主要受噴嘴類型和流量、固體模板尺寸、自組裝次數、乳化劑、攪拌速度、絲素蛋白濃度等因素影響。

表1 不同方法制備絲素蛋白微膠囊的粒徑及影響因素
3.2 壁厚和粗糙度
壁厚和粗糙度是絲素蛋白微膠囊完整性的重要指標,也是其裝載生物活性物質、功能化設計的前提和保證。相比于噴霧干燥法、復凝聚法,以LBL法和乳液模板自組裝法制備并探究絲素蛋白囊膜的壁厚和粗糙度的較多。Shchepelina等[35]探究了經LBL法(疏水作用)制備的絲素蛋白微膠囊膜的壁厚和粗糙度的影響因素,發現壁厚和粗糙度與自組裝層數并不是完全的線性關系,這可能與絲素蛋白在LBL成囊過程中的吸附和沉積協同作用相關。而有意思的是Ye等[47]利用SF-PL與高疏水的氧化石墨烯經LBL法制備微膠囊,研究結果表明壁厚與自組裝層數呈線性關系(每層均增加了5.7 nm),這可能與絲素蛋白僅吸附在氧化石墨烯表面,無法向層間擴散有關。緊接著Ye等[36]研究了SF-PG與SF-PL經LBL法(靜電作用)形成的囊膜的壁厚和粗糙度,結果表明囊膜的厚度從19 nm(3層)顯著升高到了277 nm(9層),粗糙度也從4.4 nm增加到11.4 nm。相比于疏水作用,電荷作用形成的囊膜厚度和粗糙度均呈指數型增長,這與聚電解質在LBL過程中存在劇烈的界面擴散及高效的絡合作用有關。在此基礎上,Ye等[44]繼續深入探究了不同pH值及交聯劑處理時間長短對壁厚與粗糙度的影響,當pH值為5.5時,5層囊膜厚度為87 nm,而當pH值分別為2.0和11.5時,厚度分別增加到204 nm和201 nm;同樣囊壁的粗糙度也由15.5 nm分別增加到27.5 nm和37.5 nm,這與在極性條件下SF-PG與SF-PL的離子鍵的減少有關。另外,交聯時間的延長可促使囊膜更致密(厚度從48 nm降低到44.5 nm)。Du等[38]利用單層自組裝法(去溶劑法)制備了壁厚為22.42 nm、表面粗糙度為4.09 nm的絲素蛋白微膠囊,并認為微膠囊的壁厚和粗糙度與β-折疊的形成有關。另外,該單層微膠囊的囊膜粗糙度,與上述LBL經疏水作用的第一層結果一致[35],但要比LBL經靜電作用的略高[36]。總而言之,囊膜的厚度、粗糙度與LBL法中的作用方式(疏水、靜電)、pH值、交聯劑的添加、處理時間、囊膜基質的性質(絲素蛋白構象)及制備方法等眾多因素有關。
3.3 機械性能
微膠囊的機械性能是評估其穩定性和使用價值的核心指標之一。Hermanson等[25]通過原子力顯微鏡對基因重組蜘蛛絲蛋白微膠囊的機械性能進行測試,并經計算得出楊氏模量達到0.7~3.6 GPa,接近于天然的蠶絲(10 GPa),展現出了優異的化學穩定性。Shchepelina等[35]研究了厚度為20~100 nm的薄絲素蛋白膜的楊氏模量達到驚人的6.5 GPa,經甲醇處理后膜的極限強度達到100 MPa。Ye等[36]分別研究了經EDC交聯的PEI-SF-PG/SF-PL微膠囊在干濕態時的機械性能,干態下微膠囊的楊氏模量最高達到1.8 GPa;濕態下經EDC交聯160 min的微膠囊的楊氏模量(15 MPa)比未交聯的(3.5 MPa)高出了5倍。除此之外,Ye等[44]也比較了不同pH值對囊膜機械性能的影響,相比于pH值為7.5時(楊氏模量為8.5 MPa),在極端酸堿性的條件下(pH值分別為1.5和11.5),楊氏模量驟降到了1 MPa以下(分別為0.6 MPa和0.4 MPa),這與此時囊膜中的絲素蛋白骨架結構(多孔結構)較松散有關。隨后Ye等[47]將氧化石墨烯與SF-PL經LBL法形成囊膜,測試結果發現楊氏模量達到470 MPa,比純絲素蛋白囊膜高2倍,說明氧化石墨烯的加入(約占20%)有助于提升囊膜的機械性能。Wang等[24]通過添加納米二氧化硅制備絲素蛋白微膠囊的楊氏模量達到95.2 MPa,分別比利用絲素蛋白納米纖維[42](27.4 MPa)和對絲素蛋白接枝改性[37](19.1MPa)制備的微膠囊的楊氏模量高3~5倍。上述研究結果表明,無機納米粒子的引入可顯著提升囊膜的機械性能。總之,微膠囊的機械性能與絲素蛋白的晶體結構、無機納米粒子的添加、交聯劑的添加及處理時間、pH值、絲素蛋白的相對分子質量及聚集形態等因素有關。
3.4 通透性
微膠囊的選擇通透性是生物活性物質能否遞送并發揮作用的關鍵指標。根據生物活性物質的特性來靈活調控囊膜的通透性一直是研究人員研究的落腳點。Shchepelina等[35]通過LBL法制備了多孔、滲透性可控的絲素蛋白微膠囊,選擇了相對分子質量為20~2 000 kDa的葡聚糖對囊膜的通透性進行驗證。研究結果表明,隨著自組裝層數的增加,囊膜的通透性逐漸降低,自組裝5層時(殼的孔隙約為25 nm),尺寸為22.9 nm的葡聚糖(500 kDa)可通過,而尺寸為31.8 nm的葡聚糖(2 000 kDa)卻無法通過,囊膜的孔隙直接決定了其通透性。另外當自組裝12層后(孔隙約為7 nm),其選擇通透性的葡聚糖的相對分子質量閾值為70~150 kDa(尺寸約為5.8~9.6 nm)。此外,通過疏水作用形成囊膜的通透性遠高于經電荷作用形成的囊膜,這可能與絲素蛋白自組裝和沉積方式(氫鍵和疏水作用)形成的多孔結構有關[36]。并且對于LBL法形成的囊膜,可通過改變自組裝的層數(孔隙大小)來調控其通透性,比乳液法制備的微膠囊的優勢顯著(只能通過27 kDa)[25-26]。基于該研究基礎,Ye等[44]深入研究了不同pH值、交聯劑的添加對囊膜通透性的影響。盡管自組裝層數在一定程度上可調控囊膜的通透性,但是對于經電荷作用形成的微膠囊會受限。研究發現9層囊膜在pH值為5.5時,無法通過相對分子質量為20 kDa的葡聚糖,而當pH值為11.5時可順利通過,這可能與在極端酸堿性下聚電解質分子之間的電荷作用減弱,通透性增加有關。基于此規律,可通過調控pH值實現微膠囊的智能裝載和釋放;當pH值從11.5降低到7.5時,利于葡聚糖的高效裝載;當pH值從7.5升高到11.5時,利于葡聚糖的快速釋放。另外,交聯劑的添加也在一定程度上降低了囊膜的通透性(更致密)[44]。因此,囊膜的通透性與LBL法中疏水作用下的自組裝層數、電荷作用下的pH值及交聯程度有關。
4 絲素蛋白微膠囊在生物活性物質遞送體系中的應用現狀
Li等[46]首次利用LBL法制備絲素蛋白微膠囊用于質粒DNA(pDNA)的裝載及遞送,并分別對pDNA的裝載方式(前裝載和后裝載,圖5(a))、體外釋放、細胞毒性及增強型綠色熒光蛋白(eGFP)的表達水平進行了研究,結果發現前后裝載方式均可有效延緩(pDNA)的釋放(3 d),表明蛋白酶的存在可加速釋放。相比于PEI/pDNA復合物,經絲素蛋白微膠囊(尤其1 μm微膠囊)裝載的pDNA表現出了更高的轉染效率和更低的細胞毒性。因此,絲素蛋白微膠囊可用于pDNA的局部遞送。Drachuk等[39,48]首次將具有編碼翻譯激活核糖開關的DNA模板和RNA核酸適配子裝載在絲素蛋白微膠囊中(圖5(b))。在自組裝過程中,通過調控聚合物引物、絲素蛋白濃度及DNA含量,得到通透性可控、生物相容性優異的微膠囊。將DNA固定在微膠囊膜內,不僅提高了其長期存儲的穩定性(2年),同時也改善了空間受限DNA編碼傳感元件的輸出響應。在體外轉錄/翻譯過程中,通過囊膜對細胞游離組分的選擇通透性激活特異性分析物,合成多個mRNA和綠色熒光蛋白(GFPa1)。此外,進一步地利用金納米粒子(AuNPs)和抗體(IgG)對微膠囊進行功能化設計,也證實了其裝載傳感元件的適用性,有望用于復雜生物標記物的多重生物傳感設計。Cao等[49]利用絲素蛋白制備了雙凹面形和球形兩種微膠囊(粒徑1.8 μm、壁厚20 nm),并比較了細胞攝取、生物相容性和體內生物分布(圖5(c))。經小鼠尾靜脈注射研究發現,當兩種微膠囊經血液循環時,相比于圓形微膠囊,雙凹面形的微膠囊更能減少被腎臟、肝臟代謝,延長其在血液中的循環時間,并最終在肺部組織中堆積。這可能是雙凹面形的微膠囊與紅細胞的形狀類似,比表面積高、水動力學小,可向血管內壁側向漂移且能實現可逆變形,有利于其在狹窄的空間內自由通過,且能逃避不同類型細胞的內化作用。該實驗數據可為通過靈活設計微膠囊的形狀,高效裝載生物活性藥物用于治療肺部疾病(肺纖維化、哮喘和肺癌)提供有益參考。目前,關于絲素蛋白微膠囊的遞送研究仍集中在對葡聚糖的通透調控上,而其在生物活性物質遞送方面的應用研究才剛起步,近幾年相關的研究仍然比較少。一方面是制備方法相對比較復雜,形成的微膠囊需后處理提高水不溶性,生物活性物質高效負載受限。例如LBL法過程精細、流程繁瑣;噴霧干燥法制備的絲素蛋白微膠囊形成時間短,構象無法瞬時從無規卷曲向β-折疊轉變,仍需利用水蒸氣等方式進行后處理,這在一定程度上增加了制備難度。另一方面是絲素蛋白微膠囊理化性能的限制,例如絲素蛋白微膠囊的機械性能和通透性等難以精確調控,而這些因素又都會反過來影響生物活性大分子的遞送。盡管存在挑戰,但是絲素蛋白微膠囊已在姜黃素、奧氮平、葡聚糖、DNA等不同生物活性物質的裝載、穩定及遞送等方面的研究取得了一些成果,這可為下一步開發新型營養制劑、給藥制劑、食品保護劑及生物傳感器等提供材料選擇。

圖5 絲素蛋白微膠囊在生物活性物質遞送體系下的遞送模式
5 結 論
絲素蛋白對生物活性物質具有高度的親和性,已被作為乳化劑用于活性納米乳液的穩定。絲素蛋白微膠囊具有成型簡單、內部空間大、囊膜薄且穩定、通透性可控的優勢,是活性物質的裝載、穩定、遞送的理想載體材料。本文從材料選擇、絲素蛋白微膠囊的成囊機理、制備方法、理化性能的影響因素及在生物活性物質遞送體系中的應用現狀5個角度進行了全面總結,闡述了絲素蛋白微膠囊形成機理中4個階段并深入分析了其不同階段對微膠囊粒徑、壁厚及粗糙度、機械性能和通透性等的影響,厘清了絲素蛋白微膠囊的形成、結構、理化性能和活性物質遞送方面的相互關系。當前,絲素蛋白微膠囊在生物活性物質遞送方面的應用研究,尤其是不同分子量活性物質的高效裝載、長久穩定和可控釋放等方面取得了一定的進展,有望為下一步開發新型營養制劑、給藥制劑、食品保護劑及生物傳感器等提供材料選擇。
盡管前景樂觀,但是絲素蛋白微膠囊在制備工藝、理化性能和微膠囊活性物質產品開發上仍存在一系列的問題和挑戰:1) 為了提高囊膜的穩定性,LBL法需在制備過程中添加有機溶劑和交聯劑,生物安全性難以保證;2) LBL法制備流程復雜,對成囊的要求較高,難以產業化;3) 乳液模板自組裝法形成的微膠囊通透性差,難以用于大分子量蛋白質等的遞送。因此,科研工作者應重點在絲素蛋白微膠囊的制備方法(安全性和工業化生產)、理化性能的調控和提升、不同特性的生物活性物質的裝載及穩定、特定遞送體系需求的功能化和智能化設計等方面進行深入研究。

《絲綢》官網下載

中國知網下載

