多發性骨髓瘤骨病外科治療專家共識(2022版)
中國抗癌協會骨腫瘤和骨轉移瘤專業委員會
多發性骨髓瘤(multiple myeloma,MM)是一種克隆漿細胞異常增殖的惡性疾病,是血液系統第二常見惡性腫瘤,多發于老年,目前仍無法治愈[1]。隨著新藥不斷問世及檢測手段的提高,MM的診斷和治療得以不斷改進和完善。
多發性骨髓瘤骨病(multiple myeloma bone disease,MMBD)是指由于骨髓瘤溶骨破壞導致的病理性骨折、脊髓與神經根壓迫癥、骨質疏松、高鈣血癥以及骨痛等一系列臨床并發癥的總稱,在骨髓瘤患者中的發生率高達80%以上[2]。多發性骨髓瘤骨病的發生機制主要是由于骨髓瘤細胞激活破骨細胞的同時抑制了成骨細胞活性,最終導致骨代謝失衡[3]。
MMBD常累及扁骨,包括顱骨、脊柱、骨盆、肋骨及胸骨,四肢長骨病變以股骨和肱骨最為常見。疼痛是MMBD最常見的癥狀,多發生于腰背部及胸肋部,超過50%的患者在其自然病程中會發生病理性骨折,約8%~10%的脊柱病變患者出現神經功能損害,嚴重時會出現脊髓壓迫導致截癱及二便障礙。骨髓瘤骨骼浸潤明顯時可導致骨相關事件(skeletal related events,SREs),即病理性骨折、脊髓壓迫、高鈣血癥。為緩解骨痛可進行放療,為預防或治療脊髓壓迫或病理性骨折可進行外科手術等[4]。
隨著近年來骨髓瘤化療、干細胞移植、免疫治療和分子靶向治療領域的一系列突破,大多數MMBD均可通過內科系統性治療得到有效控制[5],但面對病理性骨折、截癱等特殊情況時,外科治療仍舊是一種不可或缺的手段。
本共識旨在通過循證醫學證據回顧,確定多發性骨髓瘤骨病外科干預的時機,優化選擇手術方式,初步形成診療規范,最大限度地恢復MMBD患者的生存質量,避免因嚴重骨相關并發癥阻礙患者接受規范內科治療;同時指導骨科醫生進一步提高對MMBD的認識,避免漏診誤診,充分發揮多學科討論的優勢,合理選擇診療手段。
1 證據和推薦等級
證據推薦等級方法采用GRADE方法,見表1。

表1 GRADE推薦等級和證據分級
2 MMBD的診斷流程
2.1 診斷標準
參考世界衛生組織(WHO)、美國國立綜合癌癥網絡(NCCN)、國際骨髓瘤工作組(IMWG)和英國血液學標準化委員會/英國骨髓瘤協會指南工作組的指南[6],診斷有癥狀(活動性)多發性骨髓瘤和無癥狀(冒煙型)骨髓瘤的標準及相關檢查項目見表2~4(1A級)。

表2 有癥狀(活動性)多發性骨髓瘤診斷標準(需滿足第1條及第2條,加上第3條中任何1項)
2.2 已確診MM患者的骨破壞評估
對于已經確診的MM患者來說, X線檢查是常規診療手段,可直觀評估病理性骨折和瀕臨骨折的風險[7]。CT和MRI檢查可以發現更多的無癥狀病灶。歐洲骨髓瘤學會(EMN)強烈推薦應用全身低劑量CT掃描(whole-body,low-dose computed tomography,WBLD-CT)評估MMBD的骨骼受累范圍(1A級)[8]。脊柱和骨盆MRI對預后判斷有重要意義(1B級),與常規X線檢查相比,MRI可以發現一些更小的無癥狀溶骨破壞,無癥狀MM患者若在MRI檢查中發現溶骨破壞灶>2個,極有可能(>70%)在2年內進展為有癥狀MM[9]。推薦使用MRI評估脊髓壓迫的程度。PET/CT有助于更好地定義完全或深度緩解(CR)和疾病進展(2B級)[10]。骨掃描(ECT)反映骨合成,而MM以溶骨破壞為主,成骨代謝減弱,因此ECT不作為MMBD的常規檢測。
2.3 不明原因骨破壞
對沒有MM病史而因骨痛、骨質破壞、病理性骨折、軟組織腫塊或神經壓迫癥狀首診于骨科的患者,在除外骨轉移癌、代謝性骨病等其他疾病的同時應考慮到MM的可能,應進行相關的骨髓檢查及血、尿免疫球蛋白檢測,尤其血尿免疫固定電泳。單發骨破壞及四肢軟組織腫塊也應考慮到孤立性漿細胞瘤或髓外漿細胞瘤的可能。檢查項目見表4(1B級)。

表4 多發性骨髓瘤的檢測項目
2.4 活檢手術
當骨髓穿刺及實驗室檢查無法做出MM診斷時(如孤立性漿細胞瘤),病變部位的活檢是明確診斷的最重要手段,切開活檢和穿刺活檢(粗針或針吸)是骨與軟組腫瘤診斷中兩種方法[11]。切開活檢是最準確的方法。因為其可以提供較多的標本來進行免疫組化或細胞遺傳學檢查[12]。但是,切開活檢需要在手術室進行全麻或區域麻醉。穿刺活檢可以在局麻下進行,其診斷準確率為88%~96%[13]。隨著影像學技術的發展,影像學定位下的穿刺活檢越來越多的得到應用[14]。在活檢時,應妥善固定病變骨,采取適當的措施防止病理骨折的發生。原則上選擇病變明顯,創傷小、易操作、遠離重要血管神經、對后續診治影響小的部位。活檢前應仔細閱讀各種影像學資料,復習檢驗結果,骨科和血液科醫生共同決定活檢部位[15]。標本應分別做組織病理、流式細胞和染色體檢查(1C級)。

表3 無癥狀(冒煙型)骨髓瘤診斷標準[需滿足第3條,加上第1條和(或)第2條]
3 全身系統藥物治療
除病理性骨折和急性截癱患者外,其余患者在接受外科治療前建議接受1個療程以上血液科醫師主導的全身化療,之后再次評估手術的必要性(1C級)[16]。規范的化療、免疫治療、靶向治療和自體干細胞移植是治療MMBD的基礎和最重要的組成部分(1A級)[17]。蛋白酶體抑制劑具有抑制溶骨破壞的作用(1A級)[18]。
所有肌酐清除>30 mL/min的MM患者,在接受全身抗骨髓瘤治療同時,還應當給予靜脈注射唑來膦酸(4 mg,至少輸注15 min, 3~4周1次)或帕米膦酸二鈉(60 mg,輸注時間>4 h,3~4周1次)(1A級)[19]。唑來膦酸應持續給藥,一般建議用藥2年[20],但應注意預防頜骨壞死等嚴重并發癥(2C級)[21]。
地舒單抗(denosumab)是一種全人源單克隆抗體(Ig G2類),以高特異性和高親和力與核因子κB受體活化因子配體[receptor activator of nuclear factorκB(NF-κB) ligand,RANKL]結合,阻止RANKL與其受體核因子-κB受體活化因子(receptor activator of nuclear factor-κB,RANK)結合,從而抑制破骨細胞形成和活化,進一步抑制骨吸收,增加骨密度。一項國際多中心隨機雙盲臨床試驗結果[22]提示,美國食品藥品監督管理局(FDA)批準地舒單抗用于預防骨髓瘤骨病患者的骨相關事件,地舒單抗預防骨相關事件的能力不劣于唑來膦酸,同時接受地舒單抗治療的患者無進展生存期(progression-free survival,PFS)延長11個月。全球多家權威指南美國臨床腫瘤學會(ASCO)、歐洲腫瘤學會(EMSO) 、中國臨床腫瘤學會(CSCO)均肯定地舒單抗在骨髓瘤骨病中的地位,NCCN等循證醫學指南以1A級推薦。對于存在腎功能不全的患者來說,優先使用地舒單抗。地舒單抗推薦使用劑量為120 mg,每4周皮下注射。在使用地舒單抗治療過程中容易出現低鈣血癥,皮下注射地舒單抗前及治療過程中應監測血漿鈣濃度、肌酐、磷、鎂水平,對相應電解質予及時補充,同時避免口腔有創操作,預防頜骨壞死的發生。
4 放療
放療可用于孤立性漿細胞瘤、早期脊髓壓迫癥、藥物無法緩解的嚴重骨痛,并用于預防病理性骨折。10~15次劑量為3 000 cGy的放療即可獲得極好的效果。在緩解頑固性骨痛方面,單次放療(通常是8~10 Gy)的作用與分次放療作用相仿(1B級)[23-24]。
5 外科治療
面對病理性骨折、截癱等特殊情況時,外科治療是一種不可或缺的手段。外科治療最基本的原則是盡快恢復患者生存質量,同時盡可能保證在患者生存期內局部無需二次手術。骨髓瘤外科治療的目的不是根治疾病,而應以緩解癥狀、提高生存質量為重點,通過手術早期干預治療潛在的或已經發生的病理性骨折、解除脊髓與神經根壓迫,緩解疼痛,重建骨連續性及脊柱、骨盆等重要結構的穩定性,為患者后續的治療創造條件[25-26]。目前尚缺乏大規模的臨床病例對照研究證實手術能否延長患者的總生存期,但可明確改善患者生存質量。
5.1 手術指征
1)四肢長骨病理性骨折或存在潛在病理性骨折風險;2)脊柱病變壓迫脊髓與神經根致神經功能損害進行性加重;3)多發性骨髓瘤導致脊柱壓縮骨折和(或)脊柱不穩;4)藥物和(或)放療無法緩解的嚴重骨痛,且對應部位存在明確骨破壞;5)穿刺或切開活檢(1C級)。關于手術指征的具體說明和評分系統見以下條目。
5.2 禁忌證
全身狀況差,不能耐受手術者;心、肺、腎、肝功能衰竭不能控制者;凝血功能嚴重障礙不能糾正者;合并嚴重感染不能控制者。建議應用Karnofsky評分(表5)評價生存質量。患者在接受外科治療前,應由血液科醫師進行嚴格的評估,參照分期和危險分層對預后進行判斷(預期生存時間需>3個月)(1C級)。
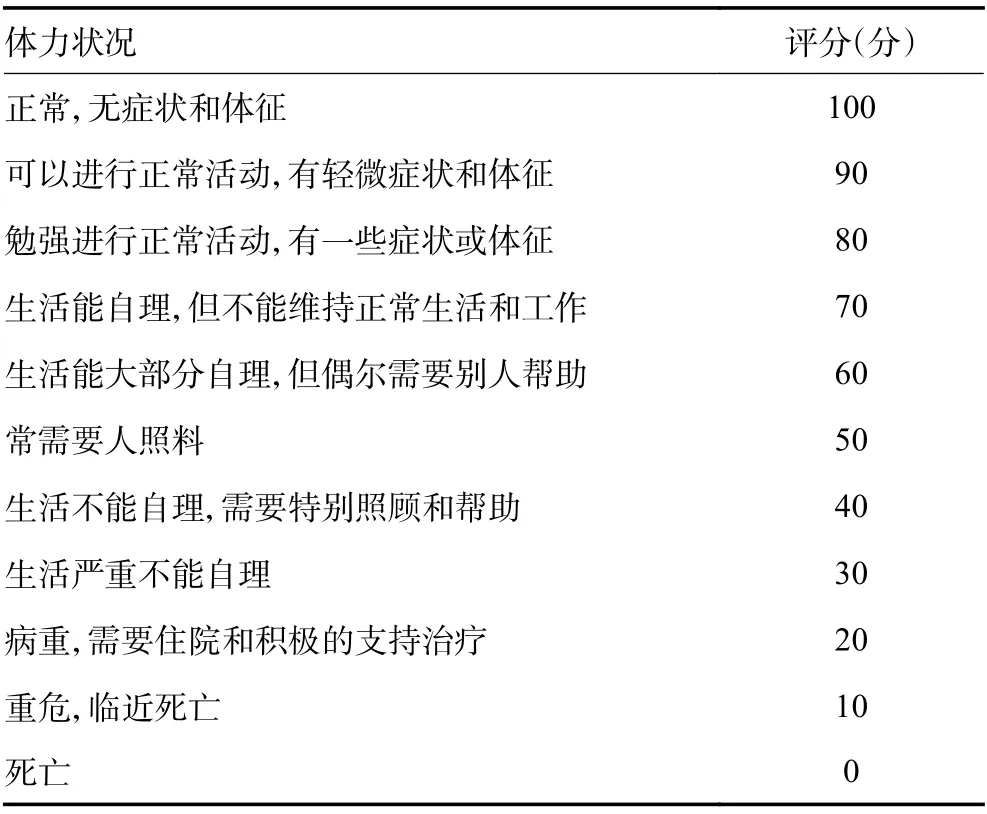
表5 Karnofsky功能狀態評分標準
5.3 手術時機
當出現下面兩種情況時建議盡快手術:1)短時間內迅速進展的截癱;2)無法實現有效外固定的長骨病理性骨折。其他情況均建議首先接受1個療程以上血液科醫師主導的全身系統治療后再次評估手術必要性(1C級)。
5.4 麻醉及手術方式的選擇
首選全麻,因為椎管內麻醉或其他麻醉方法均有一定創傷性,有導致出血、感染的危險,另外此類患者身體虛弱,全麻相對更便于控制血壓、血氧飽和度、呼吸等生命指標(1C級)。
5.5 長骨病變
1)已發生病理性骨折:手術治療四肢長骨病理性骨折療效確切,可以有效地緩解疼痛、恢復骨連續性、有利于恢復肢體功能,提高生存質量。根據病變破壞部位和范圍,手術包括病灶切除(廣泛或邊緣)和刮除(囊內)兩種,囊內手術可聯合微波或射頻消融技術,刮除后骨缺損處可以填充骨水泥,再根據不同的部位選擇內固定方式,可應用螺釘、鈦板或髓內釘。病變切除后大段骨缺損可行腫瘤型人工假體置換術;不建議采用異體骨或滅活再植等生物重建方式。手術切除和重建策略見表6(1B級)[27-28]。

表6 股骨上段病理性骨折部位與推薦術式
2)存在潛在病理性骨折風險:建議確診骨髓瘤患者接受全身低劑量CT檢查,對于有潛在病理性骨折風險的部位實施預防性內固定或密切隨訪。推薦應用Mirel's評分系統[29](表7)作為預測病理性骨折風險的手段。選擇刮除術的患者可應用局部化學物理滅活等方法擴大安全外科邊界,刮除后骨缺損處可以填充骨水泥,術后根據全身治療反應決定是否追加局部放療(1C級)。
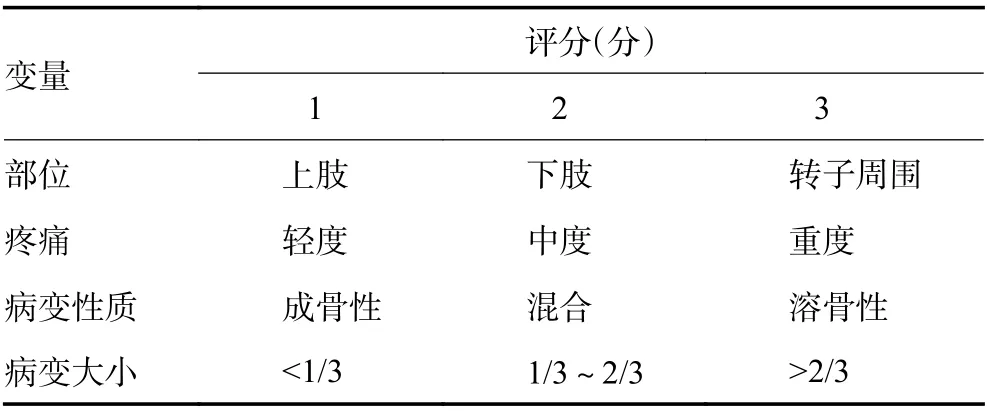
表7 Mirel’s評分
5.6 脊柱病變
大多數脊柱受累的MM患者在接受系統內科治療后胸背部疼痛癥狀會有不同程度的緩解。但椎體高度損失嚴重和(或)脊柱不穩造成的疼痛較難通過內科治療和放療控制,而當脊髓和神經根受到腫瘤或破碎骨折塊壓迫時可能出現更為嚴重的疼痛甚至發展為截癱,這些情況應該建議患者咨詢骨科醫師,并接受相應的外科治療[30]。推薦應用NOMS流程圖設計治療方案,應用SINS評分判斷脊柱穩定性(圖1,表8),應用ESCC評分判斷脊髓壓迫程度(2C級)。當患者在接受全身治療過程中出現脊髓和神經根壓迫癥狀時應及時咨詢骨科醫師,避免出現不可逆轉的神經功能損害。
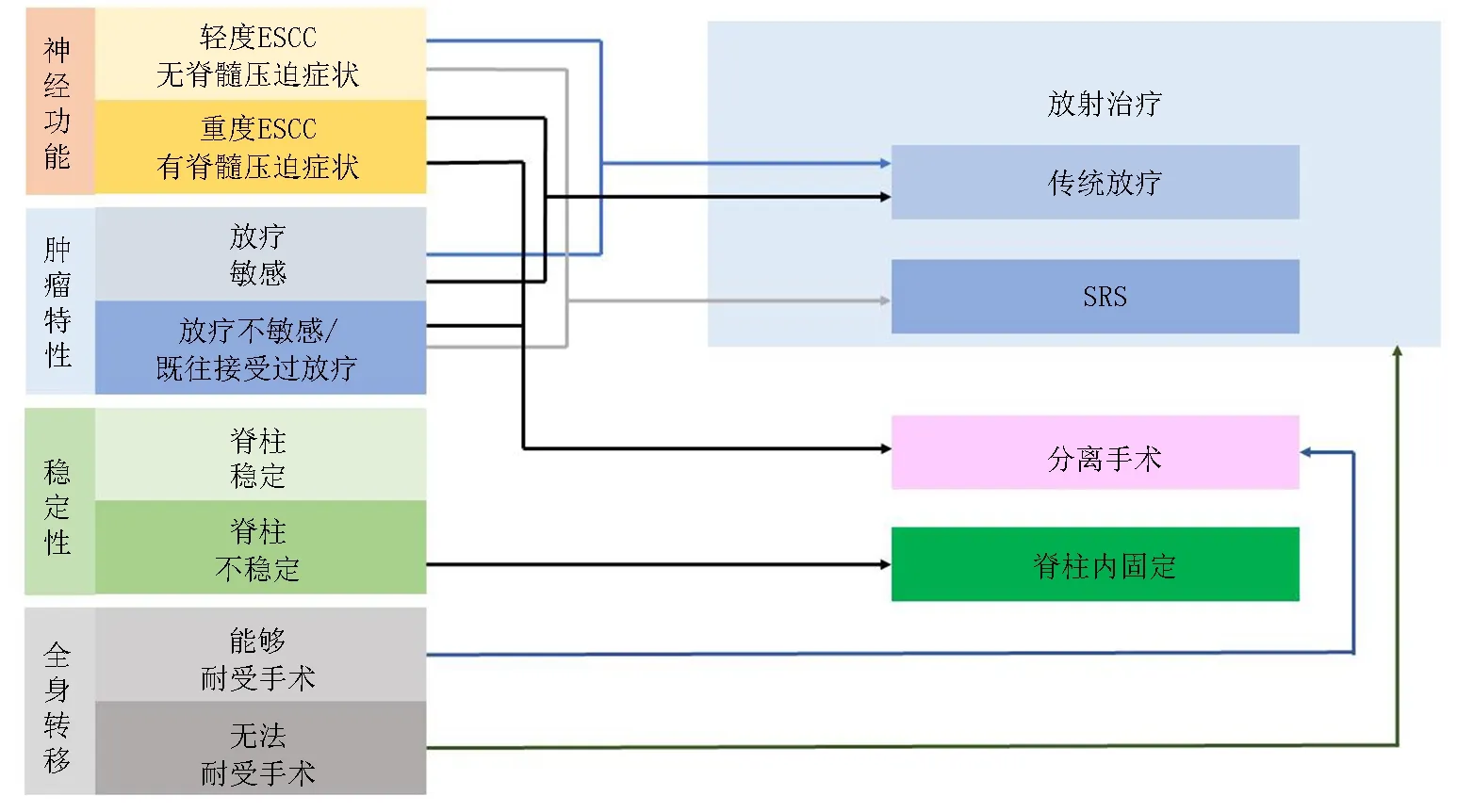
圖1 NOMS流程圖
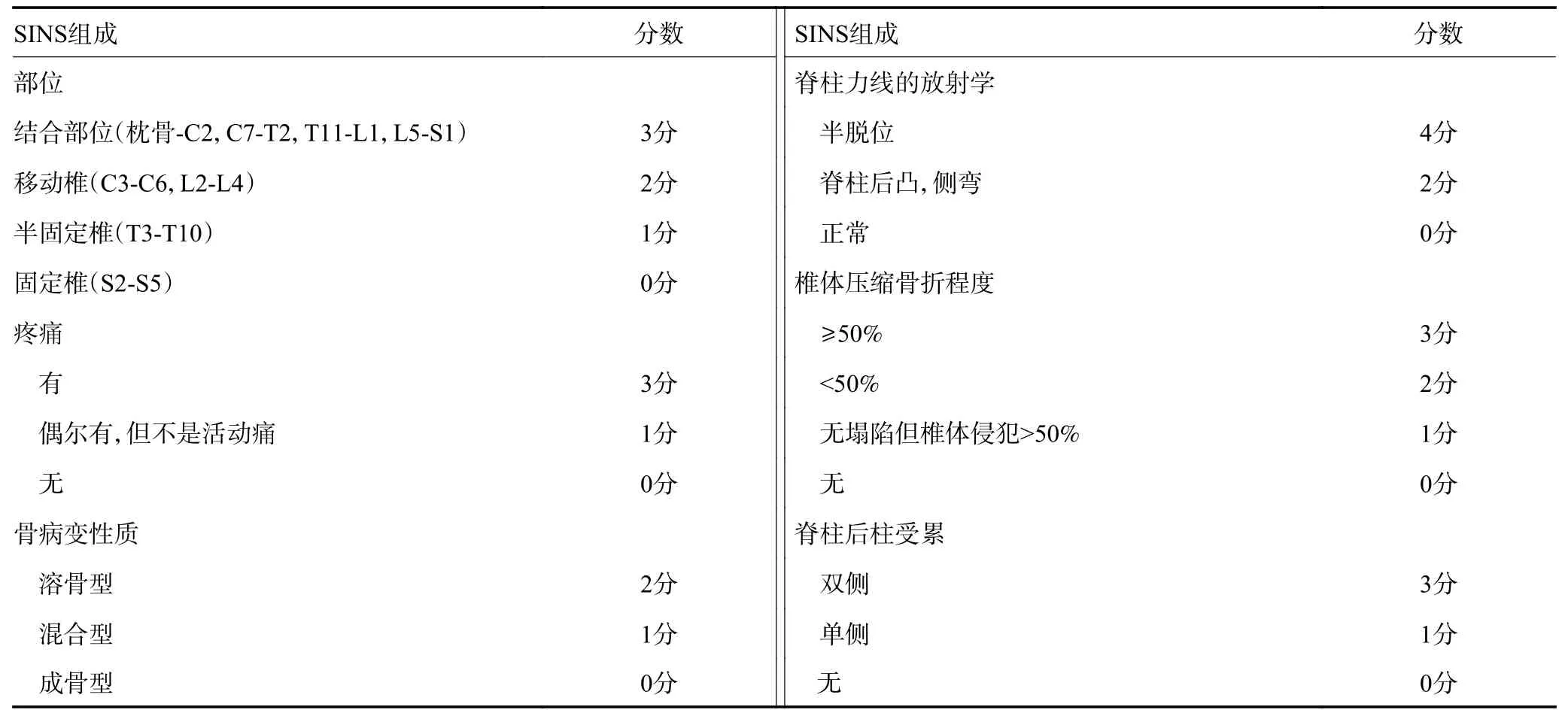
表8 評價脊柱腫瘤穩定性的SINS評分系統[31]
1)椎體成形術(PVP和PKP):PVP和PKP主要用于治療椎體壓縮骨折導致的劇烈疼痛,部分對止痛藥無效的嚴重疼痛患者可得到不同程度的緩解[32]。治療前首先應明確誘發疼痛的責任椎體,當椎體高度壓縮>1/3,或SINS評分7~12分時,可采用PVP和PKP治療(2C級)。椎體后壁不完整的病例應慎重選擇PVP或PKP手術。目前所有循證醫學證據中,一項Ⅲ期臨床研究顯示,PKP可有效緩解骨髓瘤導致椎體壓縮骨折誘發的疼痛,與PVP相比可降低骨水泥滲漏的發生率(1A級)[33]。
2)脊柱壓縮骨折和(或)脊柱不穩定:MM患者脊柱病變SINS評分≥13分時,簡單的微創手術無法恢復脊柱穩定性,患者需要接受開放手術重建脊柱穩定性,脊柱不穩合并局部腫瘤進展造成脊髓和神經根卡壓癥狀時應同時進行減壓手術(2C級)[34]。
3)脊髓與神經根壓迫癥:快速進展的脊髓功能受損、椎管內游離骨折塊造成的脊髓壓迫應盡早手術治療。神經功能評價目前常用Frankel分級(表9)。脊髓壓迫程度目前常用硬膜外脊髓壓迫(epidural spinal cord compression, ESCC )分級,見圖2。根據病灶的部位、大小和手術目的等選擇不同的手術方式。手術操作包括在保證安全的前提下切除壓迫脊髓和神經根的腫瘤(需去除骨性壓迫)、椎管減壓、脊柱重建和內固定(后路椎弓根釘內固定系統、人工椎體、鈦網、骨水泥)。對于骨質疏松明顯者,推薦使用骨水泥技術強化椎弓根螺釘的把持力量(1C級)[35-36]。

表9 Frankel脊髓損傷分級(脊髓損傷嚴重程度的評定標準)
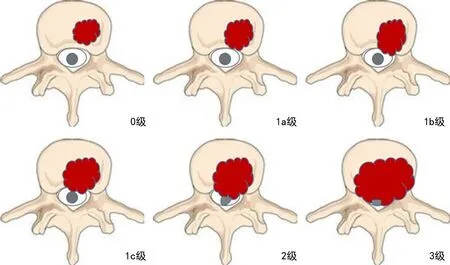
圖2 ESCC分級
除了上述的單純脊柱開放手術外,也可將開放外科手術與微創手術聯合應用,可以最大限度地發揮二者的優勢,減少術中出血量及合并癥的發生,主要適用于脊柱多發病灶的MM患者。手術必須要考慮患者的全身情況和預后情況,以重建脊柱的穩定性和解除壓迫癥狀為主要目的。
脊柱孤立性漿細胞瘤若伴有脊髓神經根壓迫或存在嚴重脊柱不穩時可選擇全脊椎切除術,該類手術風險大,手術醫生需要有豐富的脊柱腫瘤外科手術經驗。術前需展開多學科協作診療(MDT)討論,充分評估患者全身情況及轉化為多發性骨髓瘤的風險(2C級)。
4)骶骨病變:骶骨骨髓瘤可以造成頑固性疼痛、二便障礙,若內科治療和放療無效,可采取手術治療。手術應以解除骶神經根壓迫為主要目的。骶髂關節、腰骶關節強度連續性受損者應恢復其結構支撐以緩解疼痛。術后根據全身治療反應決定是否追加局部放療(2C級)[37]。
5.7 骨盆手術
6%的多發性骨髓瘤患者會出現骨盆溶骨性破壞。無癥狀患者先接受內科系統性治療,當患者疼痛癥狀明顯而骨盆環結構完整時,可行放療。如病變累及髖臼和骶髂關節影響生存質量或伴發病理性骨折時,可行病變切除或刮除、骨水泥填充,同時行骶髂關節固定和髖臼重建。 Harrington髖臼轉移癌分期見表10。術后根據全身治療反應決定是否追加局部放療(1C級)[38]。

表10 Harrington髖臼轉移癌分型
5.8 孤立性漿細胞瘤
孤立性漿細胞瘤的診斷標準見表11,很多孤立性漿細胞瘤最終會進展為MM,因此廣泛或根治性切除手術的適應證應嚴格把握,當骨性支撐結構被破壞時,往往需要外科手術進行功能重建[39-40]。鑒于孤立性漿細胞瘤預后的不確定性,由經驗豐富的血液科醫師根據流式細胞和染色體分析結果對高危病例進行的篩查和評估非常重要。低危的孤立性漿細胞瘤若能早期發現、早期治療,預后較好,若病變局限易于切除,可行擴大或邊緣切除術。未達到R0邊界需輔以放療(2C級)[41]。

表11 英國血液學標準化委員會/英國骨髓瘤協會指南工作組孤立性漿細胞瘤診斷標準(2004年)[42]
6 預后、療效評估和術后隨訪
MMBD患者的預后主要取決于初診時的風險分層(表12~15)、治療手段的選擇以及并發癥的干預及轉歸情況。接受外科治療的MMBD患者建議應用MSTS評分評估外科療效,Frankle分級評估脊髓受損恢復情況,VAS評分評估疼痛水平。骨髓瘤患者應終身隨訪,在接受外科治療后,除常規血液學檢查外,應定期對手術部位進行影像學評估。孤立性漿細胞瘤隨訪和監測開始時每4周進行1次;若漿細胞瘤治療后M蛋白完全消失,則每3~6個月進行1次,或在有臨床癥狀時進行相關檢查;如M蛋白持續存在,則繼續每4周1次的監測。每6~12個月進行1次影像學檢查(1A級)。

表12 多發性骨髓瘤分期和危險分層方法Durie-Salmon分期體系

表12 多發性骨髓瘤分期和危險分層方法Durie-Salmon分期體系 (續表12)

表13 國際分期體系(ISS)及修改的國際分期體系(R-ISS)

表14 國際骨髓瘤工作組(IMWG)的多發性骨髓瘤危險分層

表15 mSMART的危險分層
7 結語
大部分多發性骨髓瘤患者在病程中會出現骨髓瘤骨病,嚴重影響患者的生存質量和生存率。標準化規范化的化療、免疫治療、分子靶向治療和骨改良藥物是治療多發性骨髓瘤骨病的基礎和最重要的部分。局部手術在多發性骨髓瘤骨病急性并發癥(病理性骨折、脊柱不穩和脊髓壓迫癥等)的治療中發揮著重要作用。本次撰寫的共識旨在倡導骨科和血液科醫師積極開展MDT,使患者更多獲益。骨科醫生應提高對MM疾病本質的認識和診治水平,進一步降低圍手術期及遠期并發癥。血液科醫生在遇到脊柱不穩、脊髓壓迫、病理性骨折或潛在病理性骨折等情況時應及早建議患者咨詢骨科醫師,接受相應外科治療。
專家共識委員會
專家組組長:
郭 衛 北京大學人民醫院
專家組成員(按姓氏筆畫排列):
于秀淳 中國人民解放軍第960醫院
王 晉 中山大學腫瘤醫院
王 臻 空軍軍醫大學西京醫院
王國文 天津醫科大學腫瘤醫院
牛曉輝 北京積水潭醫院
葉招明 浙江大學第二附屬醫院
曲國藩 哈爾濱醫科大學腫瘤醫院
嚴望軍 復旦大學腫瘤醫院
李建民 山東大學齊魯醫院
李浩淼 南方醫科大學第三醫院
肖建如 上海長征醫院
吳蘇稼 南京東部戰區總醫院
沈靖南 中山大學第一附屬醫院
張偉濱 上海瑞金醫院
陳文明 北京朝陽醫院
邵增務 華中科技大學同濟醫學院附屬協和醫院
郭 征 空軍軍醫大學唐都醫院
屠重棋 四川大學華西醫院
董 揚 上海市第六人民醫院
路 瑾 北京大學人民醫院
蔡 真 浙江大學第一附屬醫院
蔡鄭東 上海市第一醫院
樊征夫 北京大學腫瘤醫院
執筆:
楊 毅 北京大學人民醫院

