鈣法提釩廢水除錳并制備高純碳酸錳
王曉東,張 衡,彭碧君
(攀鋼集團攀枝花鋼鐵研究院有限公司,四川 攀枝花 617000)
國內某釩制品廠鈣法提釩工藝每年產生提釩廢水約400 kt,其中錳、鎂離子等雜質含量較高,且會在廢水回用過程中不斷富集,影響工藝穩定性,因此必須對廢水中的雜質離子加以脫除。該廠提釩廢水中錳離子質量濃度為10~14 g/L,目前主要采用石灰中和法進行處理,因此產生大量的含錳石膏渣,每年損失單質錳4~6 kt。文獻報道了多種廢水除錳方法,何強等采用化學沉淀-混凝沉淀工藝序批式處理電解錳廢水。劉正乾等發明了利用高錳酸根將錳離子氧化成二氧化錳絮體的方法,但成本較高。陶長元等采用過硫酸銨對錳離子進行氧化制備二氧化錳。此外,還有生物法、離子交換法等含錳廢水處理方法。
高純碳酸錳是軟磁鐵氧體生產的主要原料,廣泛應用于電子行業。利用工業硫酸錳制備高純碳酸錳效果良好。彭清凈等采用菱錳礦為原料生產了高純碳酸錳。趙立新等利用對苯二酚生產的副產物含錳廢水生產了高純碳酸錳。
本研究采用化學沉淀法處理鈣法提釩廢水并制備高純碳酸錳,優化了生產工藝條件,在對含錳廢水進行有效處理的同時實現錳的資源化回收。
1 實驗部分
1.1 材料和試劑
提釩廢水:某釩制品廠鈣法提釩過程中產生的廢水,主要成分見表1;氨水(質量分數25%)、碳酸鈣、草酸鈣、草酸銨、碳酸氫銨均為分析純。

表1 提釩廢水的主要成分 ρ,g/L
1.2 實驗方法
1.2.1 廢水pH的調節
廢水pH的調節分為兩部分,包括初始pH的調節和終點pH的調節。初始pH的調節方法為:在攪拌下向廢水中加入碳酸鈣,待廢水pH升至5.5左右時停止加入,靜置,過濾后廢水備用,此步驟的目的是將廢水pH調節至適宜的范圍,以減少銨根離子的引入。終點pH的調節方法為:向廢水中加入碳酸氫銨溶液的同時滴加少量氨水,使體系pH保持在6.8~7.2范圍內直至反應結束,以保證反應在最佳pH范圍內進行。
1.2.2 鈣離子的脫除
廢水經過初始pH調節后,先加入少量草酸鈣作為晶種,然后以不同的((NH)CO)∶(Ca)加入除鈣劑草酸銨溶液,攪拌反應1 h后靜置陳化24 h,使用0.45 μm濾膜抽濾,取上清液測定鈣離子質量濃度并計算除鈣率和有效除鈣率(即實際除鈣率/理論除鈣率)。
1.2.3 碳酸錳的制備
廢水經初始pH調節和除鈣處理后,邊攪拌邊加入一定量的飽和碳酸氫銨溶液,同時使用氨水控制反應pH在6.8~7.2之間。加料結束后繼續攪拌反應一段時間,靜置沉降后過濾,使用超聲輔助清洗一定時間后再用液固體積比為3∶1的純水洗滌濾餅,最后在110 ℃下烘干,測定濾餅中錳及各雜質的含量,計算產品錳品味(錳的質量分數);取濾液測定其中Mn質量濃度,計算錳去除率。
1.3 分析表征方法
采用iCAP7000型電感耦合等離子體發射光譜發生儀(美國賽默飛公司)測定廢水中金屬離子(Mn、Al、K、Na、Ca、Mg、Pb)和SiO的含量;參照水質 氯化物的測定 硝酸銀滴定法(GB 11896—1989)測定廢水中Cl的質量濃度;參照工業沉淀硫酸鋇(GB/T 2899—2017)的方法測定廢水中SO的質量濃度;參照軟磁鐵氧體用碳酸錳(HG/T 2836—2011)的方法測定濾餅中雜質的質量分數。
采用XPert PRO MPD型X射線衍射儀(荷蘭帕納科公司)表征產品碳酸錳的主要特征峰;采用ZEISS Sigma 500型掃描電子顯微鏡(英國卡爾蔡司公司)觀測產品碳酸錳的形貌。
2 結果與討論
2.1 n((NH4)2C2O4)∶n(Ca2+)對除鈣效果的影響
廢水中的鈣離子會在反應過程中發生夾雜、共沉淀等反應而進入碳酸錳產品,最終影響高純碳酸錳的品級,故需在沉錳前加入草酸銨進行除鈣處理。((NH)CO)∶(Ca)對除鈣率和有效除鈣率的影響見圖1。由圖1可見:隨著((NH)CO)∶(Ca)的增大,有效除鈣率逐漸提高;當((NH)CO)∶(Ca)>0.95后,繼續增大((NH)CO)∶(Ca),有效除鈣率逐漸下降。同時,由于廢水處理后將會回用于酸浸過程,溶液中過量的草酸根可能會對酸浸過程造成不良影響,所以應盡量避免草酸根過量。當((NH)CO) ∶(Ca)=0.95時,草酸銨有效除鈣率最高,達到90.7%,且此時除鈣率為86.5%,殘余鈣離子質量濃度為0.06 g/L,符合處理要求。故本實驗選擇((NH)CO)∶(Ca)=0.95。
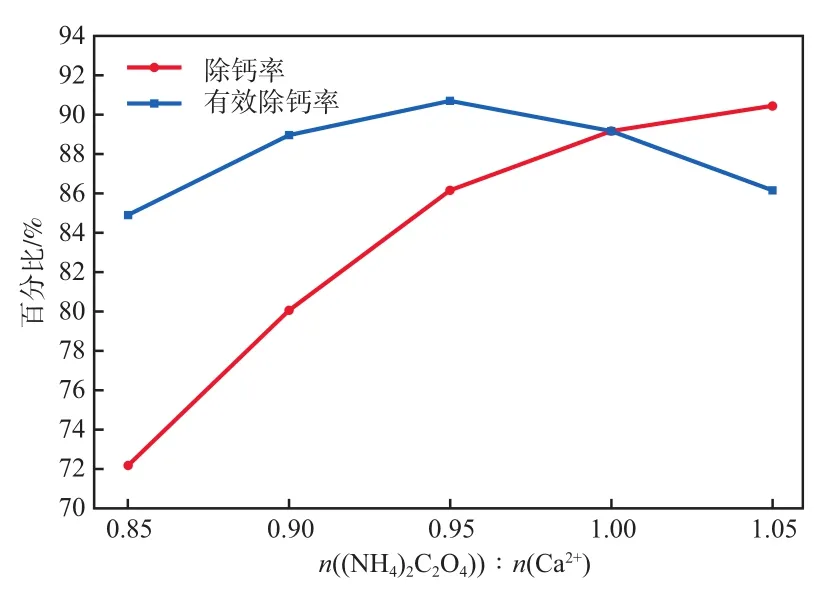
圖1 n((NH4)2C2O4)∶n(Ca2+)對除鈣效果的影響
2.2 n(NH4HCO3)∶n(Mn2+)對廢水錳去除率、產品錳品味和雜質含量的影響
提釩廢水經pH調節、除鈣兩步處理后,其主要成分見表2。由表2可見,廢水主要成分的含量發生了明顯變化,pH升至5.4,SO質量濃度降至62 g/L左右,Ca質量濃度低于0.1 g/L,SiO質量濃度低于0.1 g/L,Mg含量變化不大,其他雜質離子均較低。

表2 廢水預處理后的主要成分 ρ,g/L
在攪拌轉速為300 r/min、反應時間為60 min的條件下,(NHHCO)∶(Mn)對廢水錳去除率、產品錳品味及雜質含量的影響見圖2。由圖2可見:當(NHHCO)∶(Mn)大于2.0后,產品錳品味顯著降低,且Mg和SO含量逐漸上升,可能是由于過量的碳酸氫銨與Mg等反應生成沉淀并與產品碳酸錳混合的原因;當(NHHCO)∶(Mn)小于2.0時,隨著NHHCO加入量的增加,錳去除率逐漸增大;當(NHHCO)∶(Mn)=1.9時,錳品味最高,為44.2%,此時,Mg質量分數為0.27%,SO質量分數為0.72%,考慮到此時廢水的錳去除率為94.5%,已滿足處理要求,故本實驗選擇(NHHCO)∶(Mn)=1.9。
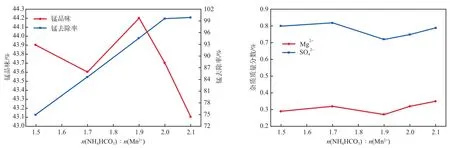
圖2 n(NH4HCO3)∶n(Mn2+)對廢水錳去除率、產品錳品味及雜質含量的影響
2.3 攪拌轉速對產品錳品味及雜質含量的影響
在(NHHCO)∶(Mn)=1.9、反應時間為60 min的條件下,攪拌轉速對產品錳品味及雜質含量的影響見圖3。由圖3可見:隨著攪拌轉速的增大,產品錳品味逐漸提高,但均未超過45%;當攪拌轉速大于700 r/min后,錳品味增速放緩;Mg和SO含量則隨著攪拌轉速的增大而逐漸下降,同樣在攪拌轉速700 r/min后趨于平緩。這是因為轉速過低時,所產生的碳酸錳沉淀分散不及時,且體系中Mg和SO含量均較高,造成一定量的雜質離子被包裹于碳酸錳沉淀中無法分離;其次是因為當轉速低時,碳酸氫銨溶液進入液相瞬間分散不及時,造成局部濃度過高,部分NHHCO與Mg、Ca等反應生成沉淀,與產品混合后難以去除。在較高轉速下則避免了以上副反應的發生。攪拌轉速對廢水錳去除率的影響不明顯。綜合考慮,本實驗選擇攪拌轉速700 r/min為宜。
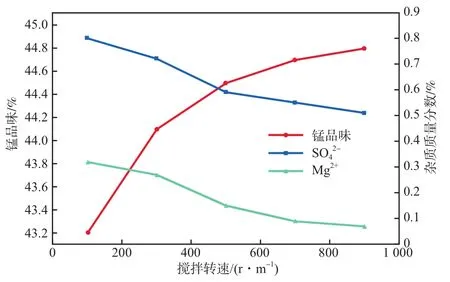
圖3 攪拌轉速對產品錳品味及雜質含量的影響
2.4 超聲清洗時間對產品雜質含量的影響
超聲清洗時間對產品雜質含量的影響見圖4。由圖4可見,超聲清洗對SO的去除效果顯著,超聲清洗5 min就可將產品中SO質量分數降至0.3%以下,且隨著超聲清洗時間的延長,SO質量分數不斷降低。相較于SO,超聲清洗對Mg的去除效果較差,原因是兩者在碳酸錳表面的存在方式不同,由于體系中SO濃度高,且可與其生成固體沉淀的離子少,所以SO在固體表面大部分屬于吸附和少部分包裹,超聲清洗可將其很好地分離。而Mg則與CO或Ca等結合成難容固體,與碳酸錳混雜后難以脫除,加之其本身含量較低,所以超聲清洗對Mg的去除效果較差。當超聲時間達10 min時,Mg質量分數降至0.05%以下。
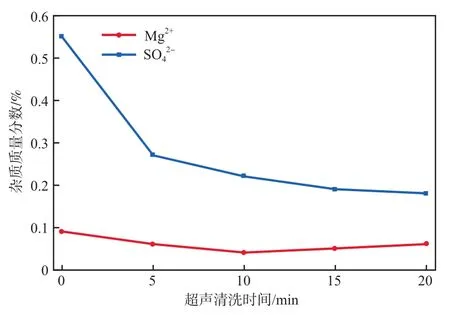
圖4 超聲清洗時間對產品雜質含量的影響
綜上所述,在(NHHCO)∶(Mn)=1.9、攪拌轉速為700 r/min的條件下反應60 min制得碳酸錳,將濾餅超聲清洗10 min后使用純水沖洗,廢水中錳去除率達94.5%,制得的碳酸錳產品錳品味達44.2%,其雜質含量達到HG/T 2836—2011 標準Ⅱ型一等品的要求,處理后廢水的主要成分見表3,碳酸錳產品的主要成分見表4。

表3 處理后廢水的主要成分 ρ,g/L

表4 碳酸錳產品的主要成分 w,%
2.5 產品碳酸錳的表征結果
2.5.1 SEM
產品碳酸錳的SEM照片見圖5。由圖5可見,產品碳酸錳的顆粒大部分呈現規則的球形,少部分呈不規則方形,方形顆粒相互堆疊在一起或吸附在球形顆粒表面,形成較大的團聚體,球型顆粒為錳沉淀產物碳酸錳,方形顆粒則為鈣鎂離子與碳酸根的CaMg(CO)(白云石)雜質。碳酸錳顆粒粒徑為1~5 μm。

圖5 產品碳酸錳的SEM照片
2.5.2 XRD
產品碳酸錳的XRD譜圖見圖6。由圖6可見,譜圖中出現了碳酸錳和CaMg(CO)的典型特征峰,未出現硫酸鹽的特征峰,說明Ca不是以硫酸鈣的形式隨著錳一起沉降,而是和Mg一起形成了更難容的CaMg(CO)沉降下來,而SO可能是被大量沉淀物裹挾在其中而沉降。
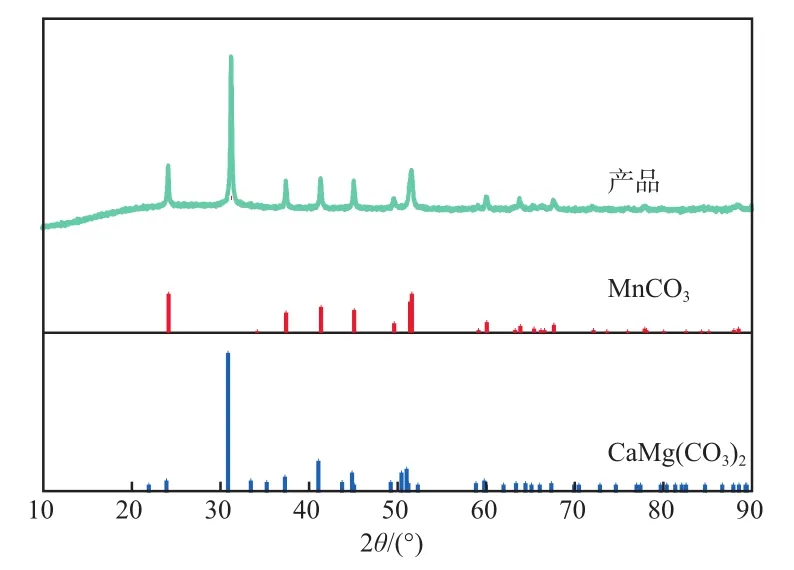
圖6 產品碳酸錳的XRD譜圖
3 結論
a)采用化學沉淀法脫除鈣法提釩廢水中的錳,先將提釩廢水pH調至5.5左右再進行除鈣處理,當((NH)CO)∶(Ca)=0.95時,有效除鈣率最高,達90.7%,此時除鈣率為86.5%,殘余鈣離子質量濃度為0.06 g/L。
b)再向廢水中加入碳酸氫銨溶液進行沉淀,并調節廢水pH為6.8~7.2,在(NHHCO)∶(Mn)=1.9、攪拌轉速為700 r/min的條件下反應60 min制得碳酸錳,將濾餅超聲清洗10 min后使用純水沖洗,廢水中錳去除率達94.5%,制得的碳酸錳產品錳品味達44.2%,其雜質含量達到HG/T 2836—2011 標準Ⅱ型一等品的要求,實現了提釩廢水中錳的資源化回收。

