血清HIF-1α和CEA與肺癌放療敏感性的相關性分析
劉培培 張 凱 孫 潺 崔艷紅 許學宗 彭 飛 金 博 趙 江
肺癌是目前人類生命安全與健康威脅最大的也是最常見的一種惡性腫瘤之一,隨著生活環境的改變和節奏加快,近幾年肺癌在我國發病率及死亡率呈不斷上升趨勢,現已成為男性腫瘤死亡率首位,女性第2位,嚴重威脅患者生命安全[1]。根據組織病理學分類,肺癌分為非小細胞肺癌和小細胞肺癌,其中非小細胞肺癌約占肺癌的80%左右,是肺癌中最多見的一種病理分類,肺腺癌與肺鱗癌都屬于非小細胞肺癌[2]。目前在臨床中主要有手術治療和放、化療等治療手段,其中早期手術治療被認為是首選治療方法也是唯一有可能治愈肺癌的方法,但是肺癌發病早期一般無明顯癥狀,待癥狀出現在就診時多數已處于中晚期,錯過最佳手術時機,因此,放射治療已成為目前肺癌中晚期主要治療方式[3]。隨著放射治療技術的不斷發展,肺癌的腫瘤局部控制率和5年生存率有了一定程度的提高,但腫瘤細胞對放射治療的耐受性快速出現使得患者很少有可能被治愈,5年生存率不足20%[4]。因此,如何進一步提高肺癌的放射敏感性和降低復發率一直是臨床研究的一大熱點和難題。相關研究顯示,缺氧誘導因子-1α(HIF-1α)的含量高低可以影響腫瘤細胞對放射的敏感性[5]。同時也有部分研究指出HIF-1α的表達并不能顯著影響肺癌在內的腫瘤細胞放射敏感性[6]。癌胚抗原(CEA)是一種非特異性腫瘤標記物,其已被證實與肺癌的發生、發展密切相關。因此,本研究針對HIF-1α與CEA在肺癌患者血清中的表達水平與肺癌放療敏感性做出相關分析,以期能為臨床放療提供新思路。
1 資料與方法
1.1 一般資料
選擇2019年1月至2020年12月期間在我院確診治療并符合納入標準的肺癌患者102例。納入標準:①經組織學或細胞學確診為肺癌;②患者預計生存期>6個月;③治療前未服用其他影響免疫力的藥物;④患者及家屬簽署知情協議書。排除標準:①嚴重心、肝、腎功能異常患者;②中途退出治療患者。具體如表1。
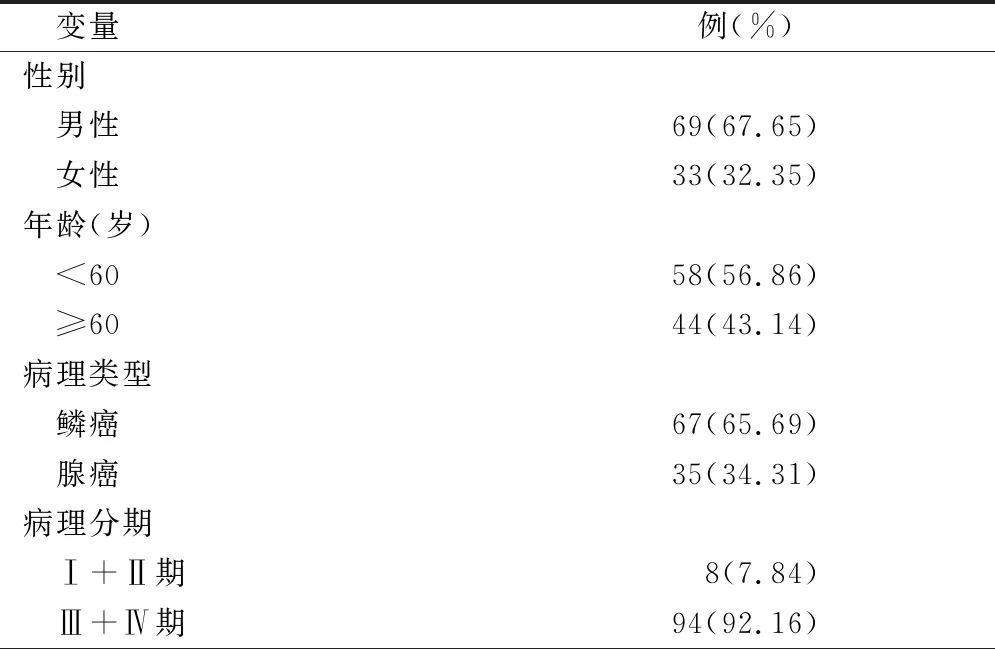
表1 患者基線資料情況
1.2 方法
所有患者均采用8MV-X線常規分割外照射治療,每天2 Gy/次,總DT60~70 Gy,40 Gy時改為斜野或等中心照射,放療期間常規行胸部 CT檢查。
療效判定:根據實體瘤療效評價標準(RECIST)[7],包括完全緩解、部分緩解、穩定以及惡化,有效率=(完全緩解+部分緩解)/總例數×100%。根據肺癌原發灶體積縮小程度和療效分為放療敏感組和放療不敏感組,其中敏感組為腫瘤體積縮小≥50%,療效為完全緩解或部分緩解;不敏感組腫瘤縮小<50%,療效為穩定或惡化;腫瘤體積通過測量胸部CT獲得。
HIF-1α和CEA檢測:患者于治療前后空腹抽取外周靜脈血5 ml, 3000 r/min離心10 min取上清,-80 ℃儲存。采用酶聯免疫吸附(ELISA)法,測定血清HIF-1α、CEA表達水平,所有試劑均在有效期內使用,嚴格按照儀器說明書的實驗步驟進行所有操作。
1.3 統計學方法
2 結果
2.1 放療后總體有效率和敏感性情況
所有患者經放療后43例緩解,48例穩定,11例惡化,總體有效率為42.16%,其中放療敏感患者43例,不敏感59例。
2.2 敏感組與不敏感組HIF-1α和CEA水平
敏感組HIF-1α和CEA水平放療后顯著下降(P<0.05),不敏感組HIF-1α和CEA水平放療后有統計學差異(P>0.05),具體如表2。

表2 敏感組與不敏感組HIF-1α和CEA水平比較
2.3 多因素回歸分析
采用COX模型對放療敏感性進行多因素分析結果表明,病理分期以及HIF-1α、CEA水平是影響肺癌患者化療敏感性的獨立因素(P>0.05),具體如表3。

表3 多因素回歸分析
2.4 HIF-1α、CEA水平與放療敏感性的相關性分析
經Pearson檢驗,肺癌患者病理分期及血清HIF-1α、CEA水平與放療敏感性呈負相關(P<0.05),即分期越高,HIF-1α、CEA水平越高,放療敏感性越差,具體如表4。

表4 放療敏感性的相關性分析
3 討論
目前,中晚期肺癌尚無十分有效的治療方法,主要以放、化療為主,放化療以被廣泛應用于不限于肺癌在內的惡性腫瘤臨床治療,因此,深入研究肺癌細胞對放化療耐受性的機制具有重要臨床意義。張秀亮等[8]在研究中指出,HIF-1α的高表達可引起肺癌細胞對化療藥物的耐受性,通過抑制HIF-1α的表達可提高肺癌耐藥細胞對順鉑藥物的敏感性。Xu等[9]在研究中也顯示,肺癌細胞中HIF-1α表達沉默后,腫瘤細胞對順鉑的敏感性明顯增加,且不表達的HIF-1α的成活率顯著降低。因此,目前普遍認為HIF-1α與肺癌細胞抗化療的作用密切相關。而放療作為肺癌的另一種重要治療手段,HIF-1α是否會同樣影響腫瘤細胞對放療敏感性的抗拒,目前尚存在一定爭議。Roudkenar等[10]在研究中表示,肺癌患者中HIF-1α水平高表達患者5年生存率和總生存率明顯降低,且放療效果不佳。Zhu等[11]在研究中通過siRNA抑制HIF-1α的表達,結果顯示可有效提高放射線對多種肺癌細胞的殺傷效果。相反,Moreno等[12]在研究中則認為肺癌細胞的放射敏感性并不顯著依賴于HIF-1α表達。CEA水平的升高可見于任何類型的肺癌,且肺癌細胞中可以直接產生CEA,在肺癌的診斷中具有較高的敏感性和特異性,其水平的變化與治療的反應性和預后有著極好的相關性[13]。因此,出于此分歧,本研究通過聯合CEA對HIF-1α水平與肺癌患者放療敏感性做出研究與分析。
本研究患者放療后,通過療效以及腫瘤體積將患者分為放療敏感組和不敏感組,結果兩組放療前后HIF-1α和CEA水平存在顯著性差異,敏感組HIF-1α和CEA水平放療后顯著下降,不敏感組HIF-1α和CEA水平放療后統計學差異,說明HIF-1α和CEA與放療敏感性存在密切相關性。起具體作用機制目前尚不清楚,我們分析其原因可能為:惡性腫瘤在生長的過程中必然會造成局部組織缺氧、供能和耗能間的失衡,而在實體腫瘤中存在乏氧區,一旦缺氧即可迅速引起HIF-1α的高表達。同時,低氧可引起腫瘤細胞對放射抗拒基因的擴散[14],此外,低氧狀態下腫瘤細胞的一些基因和蛋白合成增加,如血管內皮生長因子,P53等,這些因子在適應低氧環境的同時,引起腫瘤自身侵襲性的增加和對放療的抗拒性增加[15]。Huang等[16]亦在研究中指出,低氧狀態下HIF-1α呈高表達,通過降低HIF-1α水平可提高腫瘤細胞對放射線的敏感性。此外本研究通過COX模型對放療敏感性進行多因素分析進行驗證,結果顯示病理分期以及HIF-1α、CEA水平是影響肺癌患者化療敏感性的獨立因素,通過Pearson檢驗顯示肺癌患者病理分期及血清HIF-1α、CEA水平與放療敏感性成負相關,即分期越高,HIF-1α、CEA水平越高,放療敏感性越差,與上述Roudkenar、Zhu、Huang等研究結果基本相符。
盡管如此,本研究仍存在一定不足之處,①樣本量較小,存在一定局限性;②對HIF-1α高表達導致腫瘤細胞對放射敏感性降低的具體作用機制研究尚淺,其具體機制還需后續進行更多的基礎實驗進行驗證。
綜上所述,血清HIF-1α和CEA與肺癌放療敏感性呈負相關,其水平越高,腫瘤細胞對放射性敏感性越低。

