局部晚期宮頸癌組織Notch通路蛋白表達與以順鉑為基礎的子宮動脈介入栓塞有效性的關系
皇甫政彤
局部晚期宮頸癌(LACC)是一種發病率僅次于乳腺癌的宮頸癌,在婦科惡性腫瘤中較為常見,我國也是宮頸癌高發的國家,每年新發病的患者約10萬,死亡率在60%,并且發病率呈逐年上升的趨勢,Ⅱb~Ⅳa期宮頸癌統稱為局部晚期宮頸癌[1]。Notch信號通路是一種參與機體及組織分裂更新活動的重要手段,Notch信號通路主要是參與機體以及組織分裂的活動,結構具有保守性,在細胞的增生分裂過程中,發揮重要的作用,并且促進上皮組織物質交換速度。臨床研究表明子宮動脈介入栓塞是Ⅱb期以上中晚期宮頸癌首選的治療方法,但隨著該方法的廣泛應用,栓塞藥物耐藥性的問題也日益突出[2]。有研究指出[3],人體大多數惡性腫瘤的發展與自身Notch信號通路存在密切聯系。為了進一步探討、驗證LACC組織Notch通路蛋白表達與以順鉑為基礎的子宮動脈介入栓塞有效性的關系,本研究選取98例LACC患者和95例宮頸良性腫瘤患者開展對照研究,詳情如下。
1 材料與方法
1.1 一般資料
經過醫院倫理委員會批準,選取本單位2019年4月至2020年7月收治的98例LACC患者和95例宮頸良性腫瘤患者,分別記為惡性組和良性組。惡性組年齡30~69歲,平均(52.95±4.55)歲,其中62例年齡≥50歲,36例<50歲;臨床分期Ⅱb、Ⅲa、Ⅲb、Ⅳa期分別為35、15、29、19例;最大腫瘤直徑4~10 cm,平均(5.45±0.95)cm,其中最大腫瘤直徑≥6 cm 56例;未分化16例、低分化31例、中分化33例、高分化18例;有淋巴結轉移36例;治療情況:全身化療53例,放射治療45例。良性組年齡42~78歲,平均(53.11±4.65)歲,其中年齡≥50歲者60例,<50歲者35例;子宮肌瘤43例、卵巢囊腫30例、卵巢囊腺瘤22例。通過對比2組間數據,差異無統計學意義(P>0.05)。
納入標準:①惡性組符合局部晚期宮頸癌診斷標準[4],良性組均為宮頸良性腫瘤患者;②患者的肌瘤的血供為:極富血流型、富血流型、一般血流型;③均簽署本研究知情同意書。
排除標準:①有嚴重的精神疾病、認知障礙等;②合并有心、肺、肝、腎等疾病;③患有感染性疾病,如肺炎、肝炎、流感等;④合并慢性病,如慢性呼吸系統疾病、糖尿病等;⑤合并乳腺癌、胃癌、肺癌等其他惡性腫瘤;⑥非富血流型肌瘤,肌瘤有較大間變、鈣化、壞死等,帶蒂的漿膜下肌瘤、闊韌帶肌瘤。
1.2 方法
蛋白表達檢測方法:主要試劑鼠抗人Notch1、Hes-1、細胞周期蛋白D1(CyclinD1)單克隆抗體、酶標記的兔抗鼠Notch1、Hes-1、CyclinD1多克隆抗體,MaxVisionTM試劑盒二步法免疫組化、二氨基聯苯胺法(DAB)顯色試劑盒購自愛必信上海生物科技有限公司,0.02 mol/L的磷酸鹽緩沖液(pH=7.5)、國產分析純試劑0.02 moL/L的枸椽酸鹽抗原修復液(pH=6.0),采用雙蒸水配置。95例宮頸良性腫瘤組織在術中切取,98例LACC組織在治療前活檢獲取。所有組織樣板石蠟包埋,制片;采用二步法進行染色,按試劑盒說明書操作步驟進行。以已知標準片作為陽性對照,用磷酸緩沖液作陰性對照。判斷結果:采用雙盲法對光學顯微鏡下Notch1、Hes-1、CyclinD1染色的組織標本進行評估,當出現黃色顆粒為陽性細胞;并觀察陽性細胞色度,根據百分比得分,陽性細胞數<5%為0;陽性細胞數當≥5%且<25%為1;當陽性細胞數≥25%且<50%為2;當陽性細胞數≥50%且<75%為3;染色強度的評分標準:不著色記為0分,藍色或黃色記為1分,紫藍色或棕黃色記為2分,藍黑色或黃褐色記為3分;根據兩者總分0~1為(-),2~3弱陽性為(+),4~5中度陽性為(++),6~7強陽性為(+++);陰性為(-),陽性為(+~+++)。
介入栓塞:在腹股溝區進行消毒鋪巾,局麻后,采用Seldinger技術穿刺一側股動脈,置導管鞘,在數字減影血管造影術透視下將Cobra 4-5F導管插入雙側骼內動脈造影,采用碘佛醇或碘比醇對比劑,在腫瘤血供后,操作側動脈插管,導管成樣后,進行同側操作。按腫瘤供血分配比例灌注藥物,瘤體滋養動脈栓塞,針對Ⅳa期直腸侵犯的病例加做腸系膜下動脈插管灌注化療。栓塞治療后,若進行造影復查時發現靶動脈封鎖,未出現對比劑溢出,患者出血情況好轉,患者血紅蛋白指標上升,則視為栓塞有效。以順鉑為基礎栓塞劑由直徑1 mm的明膠海綿顆粒和絲裂霉素或表柔比星以及對比劑充分混合制成,用量依據腫瘤體積而定;透視監控下的栓塞,以不出現栓塞劑返流為宜。
癌組織中Notch1、Hes-1、CyclinD1蛋白陽性表達與介入栓塞治療有效性的關系分析方法:總結可能影響介入栓塞治療有效性的因素,包括性別、年齡、臨床分期、腫瘤直徑、分化程度、Notch1蛋白陽性表達、Hes-1蛋白陽性表達、CyclinD1蛋白陽性表達等,將其作為自變量,將介入栓塞治療效果作為因變量,分析2種變量的臨床關系。
1.3 觀察指標
(1)惡性組與良性組Notch1、Hes-1、CyclinD1蛋白表達。(2)惡性組介入栓塞的效果,完全緩解:肉眼觀察目標腫塊完全消退;目標腫塊體積縮小50%以上為部分緩解;腫瘤病灶的兩徑乘積縮小不足50%或增大不超過25%為病情穩定;腫瘤病灶的兩徑乘積增大25%以上或者出現新病灶為病情進展。完全緩解和部分緩解記為有效[5]。(3)分析惡性組癌組織Notch1、Hes-1、CyclinD1蛋白陽性表達與介入栓塞治療有效性的關系,統計介入栓塞治療無效的影響因素,并記錄各項因素的相對危險度(OR)及95%置信區間(95%CI)。
1.4 統計學方法
2 結果
2.1 惡性組與良性組Notch1、Hes-1、CyclinD1蛋白表達比較
惡性組與良性組Notch1、Hes-1、CyclinD1蛋白表達對比差異有統計學意義(P<0.05),惡性組Notch1、Hes-1、CyclinD1蛋白陽性表達率均高于良性組(P<0.05),見表1、表2。
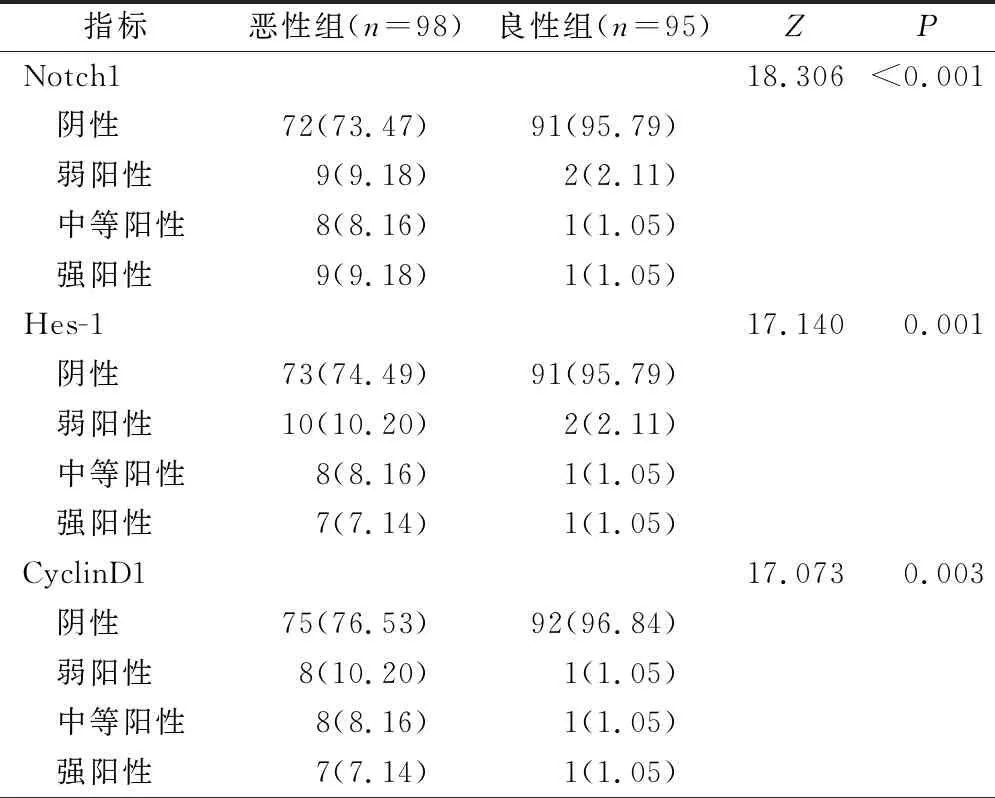
表1 惡性組與良性組Notch1、Hes-1、CyclinD1蛋白表達對比(例,%)
2.2 統計惡性組介入栓塞的效果
惡性組完全緩解21例,部分緩解30例,病情穩定27例,病情進展20例,惡性組以順鉑為基礎的子宮動脈介入栓塞無效率為47.96%(47/98)。
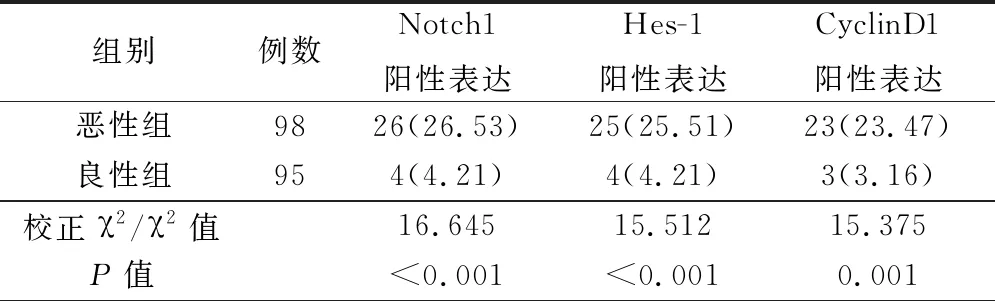
表2 惡性組與良性組Notch1、Hes-1、CyclinD1蛋白陽性表達率(例,%)
2.3 惡性組癌組織Notch1、Hes-1、CyclinD1蛋白陽性表達與介入栓塞治療有效性的關系
≥Ⅲb期、腫瘤直徑、未/低分化、癌組織Notch1蛋白陽性表達、癌組織Hes-1蛋白陽性表達、癌組織CyclinD1蛋白陽性表達均是影響惡性組介入栓塞治療效果的危險因素(P<0.05),見表3,表4。

表3 惡性組介入栓塞治療效果的可能因素對比(例,%)
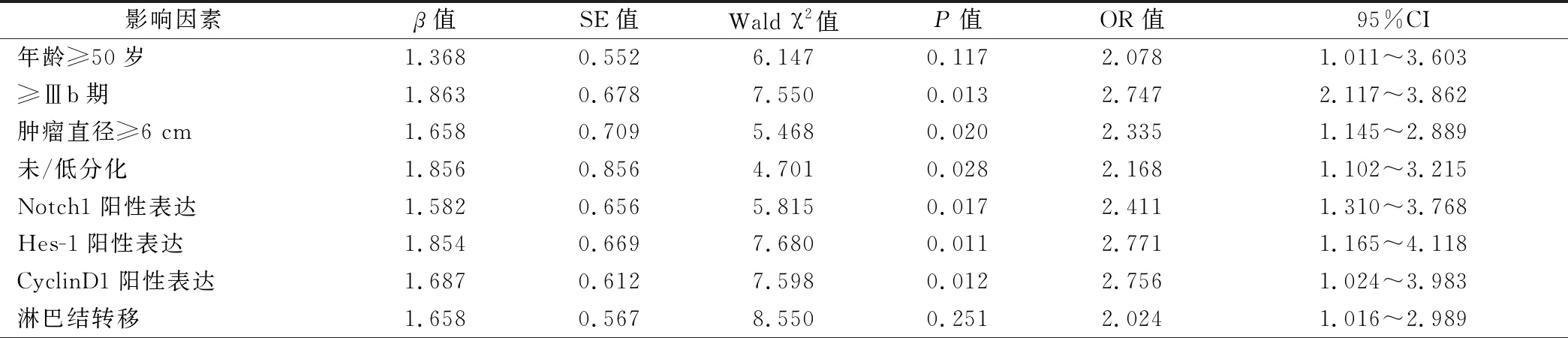
表4 惡性組介入栓塞治療效果的影響因素Logistic多元回歸分析
3 討論
LACC狹義的概念是指癌灶直徑≥4 cm的早期宮頸癌,由于腫瘤的體積較大,沒有經過術前的治療而進行手術,可能會導致病灶殘留,并且會出現較高的淋巴結轉移及并發癥發生率。目前宮頸癌獲得治愈最有效的方法是手術根治性切除,其可以提高患者的遠期生存率,而對于局部腫塊伴有周圍浸潤以及淋巴結轉移的患者,往往會出現術后治療無效的情況。本研究發現以順鉑為基礎的子宮動脈介入栓塞無效率為47.96%,與劉保清等的報道結果接近[6],提示以順鉑為基礎的子宮動脈介入栓塞治療效果不佳,因此需要進一步探討影響介入栓塞治療無效的因素。
本研究發現惡性組Notch1、Hes-1、CyclinD1蛋白陽性表達率均高于良性組,提示在LACC患者中Notch1、Hes-1、CyclinD1蛋白陽性表達偏高。Notch是一種信號通路蛋白,可以通過氧化反應,進而合成一種限速酶類,增加花生四烯酸合成前列腺素的速度。有研究指出,Notch1在宮頸癌患者機體生理病變中發揮著重要的作用[7]。Hes-1、CyclinD1蛋白能夠影響癌癥細胞的活性,并且進一步增強癌細胞的遷移侵襲能力。有研究表明[8]Hes-1、CyclinD1蛋白可調動蛋白水平,以調節宮頸癌細胞惡化程度。Notch受體與鄰近的相應配體結合,進一步改變Notch受體胞外段結構,通過釋放胞外段,從而使Notch受體的胞外段與包內部分離,Notch的包內段在蛋白酶復合體催化作用下分解,并且轉移到細胞核內轉錄,抑制因子相結合,進而影響激活轉錄活性,調節靶基因(如Hes)等的轉錄表達,抑制下游基因轉錄[9]。有研究指出[10],Notch信號通路能夠調控人體內正常細胞的增殖以及分化,與一些腫瘤的發生息息相關,并且為腫瘤細胞的轉移和擴散提供了可靠的依據。本研究與上述相關報道和分析相符。
本研究還發現,癌組織Notch1蛋白陽性表達、癌組織Hes-1蛋白陽性表達、癌組織CyclinD1蛋白陽性表達是介入栓塞治療無效的影響因素。Notch1蛋白在人體腫瘤細胞的分化凋亡增殖過程中發揮著重要的作用,當蛋白持續異常表達時,細胞則會出現異常分化,導致過度增殖,進一步形成腫瘤。有研究表明[11],Notch1能夠解除細胞生長的抑制,進一步促進宮頸癌腫瘤細胞的生長。Notch1蛋白通過互補協同的方式影響腫瘤細胞的生長,促進新生血管的形成。Hes作為一種具有螺旋結構的轉錄因子,可以調節人體干細胞的分化。在脊椎動物中,Hes-1蛋白表達最為廣泛,可以抑制靶基因的轉錄,在特定分化效應基因的啟動子上發揮著重要的作用。Hes-1蛋白的表達受Notch信號的調節,也是Notch信號通路中最為重要的下游靶基因,影響以順鉑為基礎的子宮動脈介入性栓塞的有效性[12]。CyclinD1作為周期素家族中的主要成員,其基因定位在染色體上,由295氨基酸組成,與周期蛋白依賴性激酶(CDK)、成視網膜母細胞瘤蛋白(PRb)蛋白相結合,共同形成氨基酸序列。體外實驗證明,CyclinD1蛋白通過結合并激活周期蛋白依賴性激酶4(CDK4)、周期蛋白依賴性激酶6(CDK6),使后者催化一系列關鍵底物,釋放轉錄因子,促進DNA合成,促進宮頸癌細胞加速增殖[13]。因此,CyclinD1表達使CDK4、CDK6對PRb調節失常,導致細胞的生長和腫瘤的發展。因此在臨床實踐中針對LACC患者應積極控制上述危險因素,采取積極有效措施,抑制細胞生長和腫瘤的發展。
本研究還發現,≥Ⅲb期、腫瘤直徑、未/低分化也是惡性組介入栓塞無效的危險因素,提示≥Ⅲb期、腫瘤直徑、未/低分化也是介入栓塞治療無效的影響因素。有研究指出[14],以順鉑為基礎的子宮動脈介入栓塞與患者分期、腫瘤直徑、未/低分化等臨床特征顯著相關。順鉑在當前的人類腫瘤的治療中發揮了重要的作用,同時,LACC的化療藥物也離不開順鉑通過誘導細胞死亡來抑制Notch信號進一步影響子宮動脈介入栓塞的效果[15]。對于LACC診斷及后期干預治療,應該結合患者臨床資料、腫瘤分期或臨床病理分期,判定治療后病情是否存在惡化,并根據≥Ⅲb期、腫瘤直徑、未/低分化的變化情況及時更換預后的治療干預方式。
綜上所述,LACC患者中Notch1、Hes-1、CyclinD1蛋白陽性表達率高,Notch1、Hes-1、CyclinD1蛋白表達狀態可能成為預測局部晚期宮頸癌同步放化療預后的分子生物學指標。以順鉑為基礎的子宮動脈介入栓塞治療效果不佳,≥Ⅲb期、腫瘤直徑、未/低分化、Notch1、Hes-1、CyclinD1蛋白陽性表達均是LACC介入栓塞無效的危險因素,因此針對LACC患者應及時檢測Notch信號通路不同蛋白表達情況,預測介入栓塞的有效性。

