PD-1和PD-L1在卵巢上皮性癌組織中的表達及其與免疫抑制相關因子的關聯
王絲雨 王 娜 張 蘭 劉月華
上皮性卵巢癌(epithelial ovarian cancer,EOC)是卵巢癌中最常見的類型,在婦科腫瘤中惡性程度和病死率最高,由于早期癥狀輕微且無特異性癥狀,缺乏有效的篩查手段,大多數患者確診時已為晚期[1-2]。近年來,程序性死亡受體1(PD-1)以及配體程序性死亡配體1(PD-L1)的相關抑制藥物在治療惡性腫瘤中獲得顯著關注[3]。CD4+CD25+CD127-調節性T細胞(regulatory T cells,Treg cell)指具有免疫調節功能的抑制性細胞亞群,可介導腫瘤發生免疫逃避,在抗腫瘤應答中發揮抑制效應[4]。有研究證實Treg細胞水平在多種腫瘤患者的外周血中有所增加[5]。有研究報道PD-1和PD-L1可能與CD4+CD25+CD127-調節性T細胞存在關聯性[6],但是相關研究報道較少,具體關聯機制尚不明確。因此本研究探討PD-1和PD-L1在卵巢上皮性癌組織中的表達及其與免疫抑制相關因子的關聯,旨在尋找合適的生物標志物用于EOC的臨床應用。
1 材料與方法
1.1 一般資料
選取2019年1月至2021年1月本院收治卵巢上皮性癌患者60例,年齡28~74歲,平均(55.65±8.68)歲。納入標準:①符合《卵巢惡性腫瘤診斷與治療指南(第四版)》診斷標準[7],經病理學確診為卵巢上皮性癌; ② 均行卵巢分期手術或腫瘤細胞減滅術;③術前未接受放化療或抗腫瘤治療; ④患者簽署自愿受試同意書,患者及其家屬需簽署知情同意書。排除標準:① 患者資料收集未完整;②合并其他惡性腫瘤;③合并其他器官嚴重性病變患者;④合并神經系統疾病。
1.2 免疫組化法檢測PD-1、PD-L1表達
4%中性甲醛固定標本,經脫水、石蠟包埋,切片后分別進行HE及免疫組化染色,光鏡顯微鏡下觀察組織形態學特征。采用PV600二步法,以PBS代替一抗作為陰性對照,用已知陽性組織作為陽性對照。結果判定:PD-1陽性染色定位于細胞質,呈黃色或棕黃色,當著色細胞≥5%時可定義為陽性。PD-L1陽性染色定位于細胞膜,呈黃色或棕黃色,當著色細胞≥5%時定義為陽性。
1.3 CD4+ CD25+CD127-Treg 細胞檢測
抽取患者靜脈血5 mL,加入抗凝管,取80 μL抗凝全血于流式檢測管底部,加抗人CD3、CD4、CD45、CD25和CD127抗體,各10 μL,充分混勻后避光孵育15 min;加1 mL溶血劑,混勻,避光15 min;離心后去上清,加入2 mL PBS混勻,離心后去上清;上機檢測,以CD45/SSc設門圈定淋巴細胞群,以CD3/CD4設門圈定CD4+T細胞,再分析該群細胞中CD25+CD127-細胞比例。
1.4 統計學分析
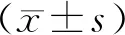
2 結果
2.1 PD-L1、PD-1的表達與患者臨床病理特征的關系
PD-L1表達與卵巢癌患者的FIGO分期有關,FIGO Ⅲ+Ⅳ期患者PD-L1陽性表達率顯著高于Ⅰ+Ⅱ期(P<0.05);PD-1蛋白表達與其他臨床病理參數均無顯著相關性(P>0.05),見表1。

表1 PD-L1、PD-1的表達與患者臨床病理特征的關系/例
2.2 Treg 細胞頻率比較
流式細胞術結果顯示,PD-1、PD-L1陽性患者CD4+CD25+CD127-Treg頻率顯著高于PD-1、PD-L1陰性患者(P<0.05),見表2。

表2 Treg 細胞頻率比較
3 討論
卵巢癌有漿液性囊腺癌、透明細胞癌、卵巢子宮內膜樣癌、卵巢黏液性囊腺癌等多種類型,臨床病理類型復雜多樣,其中以上皮性卵巢癌發病率最高,大多數患者確診時已為中晚期,常會出現腫瘤細胞腹膜轉移,是目前EOC患者死亡的主要原因[8-9]。手術治療聯合化療是目前臨床用于EOC患者的常規治療方案,但是由于手術難以根治以及化療易產生耐藥等原因,導致EOC患者易出現治療以及預后效果不佳的情況[10-11]。近年來,由于新輔助技術和靶向治療技術在不斷發展,EOC患者的預后以及生存期有所改善。免疫治療是一種通過激活自身的免疫系統,來增強腫瘤微環境抗腫瘤免疫力,從而控制和殺傷腫瘤細胞的腫瘤治療新方案,是目前腫瘤免疫治療的主要靶點之一[12-13],其主要機制是協同刺激分子通過提供正性或負性信號,調節T細胞活化、增殖及免疫應答等生物學功能[14]。
PD-L1是B7家族成員之一,主要在活化的T細胞和B細胞以及巨噬細胞表面表達。PD-1是CD28/CTLA-4家族成員之一,編碼Ⅰ型跨膜糖蛋白,是PD-L1的受體[15-16]。PD-1和PD-L1結合后,下調下游激活信號的磷酸化,向T細胞內傳遞抑制信號,可防止T細胞過度活化,從而抑制免疫反應的發生[17-18]。腫瘤細胞中的PD-1和PD-L1結合后可以抑制T細胞抗腫瘤免疫應答的發生,促使腫瘤發生免疫逃避[19]。研究報道稱,在卵巢癌、胃癌、淋巴瘤等多種腫瘤細胞上均有PD-L1的表達,與患者的預后差及生存期短顯著相關[20]。本研究發現PD-L1表達與卵巢癌患者的FIGO分期有關,FIGO Ⅲ+Ⅳ期患者PD-L1陽性表達率顯著高于Ⅰ+Ⅱ期,提示PD-L1可能參與卵巢癌的發生發展進程。
腫瘤的形成與發展可能與某些轉化的細胞逃避機體免疫清除作用有關[21],其中CD4+CD25+CD127-調節性細胞屬于特異的T淋巴細胞亞群,已成為腫瘤免疫學領域的研究熱點[22]。CD4+CD25+CD127-調節性細胞作為負性免疫調節細胞,具有免疫抑制性,主要通過直接的細胞與細胞接觸、間接的分泌可溶性細胞因子等途徑來降低抗腫瘤特異性T淋巴細胞的功能,從而達到促使腫瘤發生免疫逃逸的目的[23-24]。目前多種研究發現,Treg在乳腺癌、卵巢癌、胃腸道腫瘤等患者的外周血和腫瘤局部均有所增加[25-26]。本研究發現PD-1、PD-L1陽性患者CD4+CD25+CD127-Treg頻率顯著高于PD-1、PD-L1陰性患者,提示EOC患者PD-1、PD-L1的表達與免疫抑制相關因子存在密切聯系,這與既往研究報道一致[27]。
綜上所述,EOC患者PD-L1的表達水平與腫瘤分期有關,還與免疫抑制相關因子密切相關。但是本研究依然存在局限性,首先是納入樣本量不足以及中心單一,易對結果造成影響;其次是本研究采用免疫組化的實驗方法,可能存在蛋白降解的情況,對試驗結果造成影響,因此需要未來更為前瞻性的試驗研究來驗證此結果。

