miR-142-5p通過靶向作用WWP1對前列腺癌細胞PC-3生物學行為的影響
黃興武 羅 鋒 陽國彬
前列腺癌(prostate cancer,PCa)是老年男性中常見的惡性腫瘤,發病率和死亡率僅次于肺癌[1]。PCa由于發病隱匿且尚無有效早期診斷指標,發現時往往多為晚期,目前臨床上治療PCa的主要方法有內分泌療法、手術療法、放射療法及化學療法[2]。但內分泌療法因激素的依賴性而向惡性腫瘤轉化進而延誤治療,手術療法和放射療法對患者身心傷害較大,許多患者因無法忍受治療的痛苦而選擇退出治療[3]。因而尋找副作用小且療效好的治療方式成為了目前研究的熱點之一。隨著醫療的發展,基因治療越來越多地使用在腫瘤的治療中,微小RNA(micro-RNA,miRNA)是一種長度為20~25個核苷酸左右內源性非編碼RNA,對腫瘤細胞的增殖、凋亡以及侵襲遷移有著一定的作用[4]。高棟梁等[5]研究表明:miR-497-5p可以靶向泛素蛋白連接酶1(WW domain-containing protein 1,WWP1)抑制瘢痕疙瘩成纖維細胞的增殖,并誘導其凋亡。朱延杰等[6]研究表明:miR-142-5p可以通過靶向調控TOP2A基因抑制PCa細胞的增殖與侵襲能力。因此我們推測升高PCa細胞中的miR-142-5p或者降低WWP1的表達可能可以實現抑制其惡性生物學特征的目標。基于此本研究預測了miR-142-5p與WWP1的結合位點并驗證其靶向性,并體位培養PC-3細胞,檢測miR-142-5p靶向作用WWP1對PC-3細胞生物學行為的影響,旨在為PCa的治療提供理論基礎。
1 材料與方法
1.1 主要細胞
20例PCa組織及癌旁組織(>2 cm處)來自2020年1月至2021年1月于醫院行PCa手術治療的患者;PC-3(人PCa細胞;貨號:YS-E96354;培養基:90% DMEM+10%FBS)細胞購自上海研生實業有限公司。
1.2 主要試劑與儀器
DMEM和FBS均購自美國Gibco公司;TaqMan miRNA逆轉錄試劑盒(貨號:4427975)購自美國的Thermo公司;Matrigel購自美國的BD公司;質粒購自上海吉瑪公司; E-cadherin抗體(貨號:ab763189)、N-cadherin抗體(貨號:76011)和Vimentin抗體(貨號:ab92547)均購自艾博抗有限公司;Transwell小室購自美國Millipore公司;超凈工作臺購自中國蘇凈安泰公司;BX51熒光顯微鏡購自日本Olympus公司;Rt2100c酶標儀購自美國Rayto公司;GNP-9080恒溫培養箱購自中國上海精宏實驗設備有限公司;Neofuge 15R低溫離心機購自中國Heal Force公司;DY89-I型勻漿機購自寧波新芝公司;熒光定量PCR儀購自中國博日有限公司。
1.3 方法
1.3.1 細胞培養及傳代 提前準備37℃恒溫水浴,液氮中取出凍存的PC-3細胞,置于水浴中解凍。轉速:1000 rpm,時間:5 min,棄去上清。加入1 ml含10%胎牛血清(FBS)、同時加入1%的100 U/ml濃度的青霉素-鏈霉素雙抗以及90%的DMEM不完全培養基,緩慢吹打混勻,轉速:1000 rpm,時間:5 min,進行離心,然后棄去上清。再次加入1 ml培養基轉移至培養皿或培養瓶中,于37℃、CO2濃度為5%的培養箱內培養。待細胞單層貼壁生長至密度約90%時,采用胰蛋白酶進行消化傳代培養備用。
1.3.2 細胞轉染 取出目的質粒,按照說明書將適量DEPC水加入質粒中數分鐘溶解質粒,然后置于-20 ℃冰箱中保存。取PC-3細胞接種到6孔板中,待單層細胞密度生長至90%左右按實驗分組:NC組(轉染空載對照質粒)、miR-142-5p組(轉染miR-142-5p質粒)、WWP1組(轉染WWP1質粒)、miR-142-5p+WWP1組(轉染miR-142-5p質粒及miR-142-5p)進行質粒轉染。轉染前提前半小時更換恢復室溫的新鮮培養基,將其放入培養箱。然后取EP管,采用DMEM不完全培養基溶解質粒及LipofectamineTM 2000,待各自溶解約5 min后將兩管輕輕混合,然后靜置15~20 min。靜置混合后再將混合物加入各處理組孔板中,6 h后更換新鮮培養基,待48 h后收集細胞進行處理。
1.3.3 RT-PCR檢測基因表達 提取PCa組織、癌旁組織和細胞總RNA,使用電動勻漿機進行組織勻漿制備并在離心機中以3500 r/min的轉速離心10 min,將離心后的上清液轉移至EP管中,裂解細胞收集上清并使用氯仿抽提水相、異丙醇和75%的乙醇洗滌純化核酸,加入DEPC水將RNA沉淀進行溶解,測定RNA濃度進行逆轉錄。根據試劑盒方法于逆轉錄管中分別加入逆轉錄酶和RNA樣本以及水,反應體系為10 μL,設置程序進行cDNA的合成。然后再根據RT-PCR說明書進行實時定量PCR的反應,準備好引物、酶和水的反應體系,設置程序95℃預變性5 min,90℃變性30 s,65℃退火30 s,72℃延伸30 s,共40個循環,72℃延伸5 min,進行基因擴增,采用2-ΔΔCt法計算miR-142-5p和 WWP1 mRNA的相對表達,以U6為內參基因,各基因序列見表1。

表1 基因序列
1.3.4 熒光素酶報告實驗 預測miR-142-5p和WW-P1的結合片段,用RT-PCR擴增miR-142-5p上兩者的結合片段,構建WWP1野生質粒(WWP1 WT)、突變質粒(WWP1 MUT)和miR-142-5p,分別或同時對PC-3細胞進行轉染,用Dual Luciferase報告基因試劑盒檢測各組熒光素酶活性。
1.3.5 Transwell小室實驗檢測細胞侵襲能力 在4℃條件下稀釋配制Matrigel凝膠,吸取100 μL左右凝膠均勻加入小室上層,然后將小室放在孔板內,分別于37℃下放置2 h,室溫超凈臺內再進行風干4 h;取轉染成功的各組PC-3細胞,PBS洗滌后換用無血清培養基重懸細胞,計數調整細胞密度,以5×104每小室的密度加入,然后放入培養箱中培養48 h;48 h后將Transwell小室取出,棄去培養基,采用酒精棉簽擦去上層Matrigel凝膠及未穿膜的細胞。另取干凈的24孔板,將小室置于其中,采用4%多聚甲醛進行固定30 min。棄去固定液,配制結晶紫染液,對染色細胞10 min,PBS洗3遍,棉簽擦去未結合的染料,適當風干后,顯微鏡下觀察,隨機選取5個視野計數不同處理組的穿膜細胞數量。
1.3.6 劃痕實驗檢測細胞遷移能力 取上述各組PC-3細胞,采用24孔板接種密度為1×105/mL的腫瘤細胞,待細胞單層密度生長至90 %左右,采用10 μL Tip頭對細胞進行劃痕操作。采用無血清不完全培養基對劃痕脫落的細胞進行輕柔的沖洗,重復3次,棄去培養基,然后加入新鮮培養基將其置于培養箱中繼續培養24 h。分別于0和24 h時后,顯微鏡下觀察并采集照片,然后進行細胞遷移距離的測量,統計分析各轉染組細胞的相對遷移距離并計算劃痕愈合率。細胞劃痕愈合率(%)=(各實驗組劃痕愈合面積/各實驗組劃痕面積)×100%。
1.3.7 蛋白質印跡實驗檢測相關蛋白表達水平 取上述各組PC-3細胞,消化后重懸計數并調整細胞密度為1×105個/mL,并接種于6孔板中加入等量的DMSO進行培養48 h后,棄去培養基,4℃預冷PBS洗滌細胞3次,冰上加入蛋白裂解液裂解40 min,裂解完成后提取細胞總蛋白,利用BCA蛋白定量試劑盒測定蛋白濃度,隨后將獲得的蛋白按配膠、上樣、電泳、電轉、封閉、孵育一抗、孵育二抗、顯影的步驟檢測樣品中侵襲遷移相關蛋白(E-cadherin,N-cadherin和Vimentin)的相對表達水平,以GADPH蛋白為內參對照。
1.3.8 流式細胞儀檢測細胞凋亡率 取上述各組PC-3細胞,消化后重懸計數并調整細胞密度為1×105個/mL,收集培養液于流式管中,六孔板中的細胞用PBS洗滌一次,加入0.5 mL 0.25%胰酶消化細胞,待細胞變圓且有部分細胞脫落,即加入培養基終止消化,用移液槍輕輕吹打細胞,使細胞懸浮。收集于上一步的流式管中,300 g離心5 min。加入1 mL PBS重新懸浮細胞,300 g離心5 min,沉淀用300 μL的Binding Buffer重懸加入5 μL Annexin V-PE,混勻后避光孵育10 min,加入5 μL 7-AAD,混勻后避光孵育5 min,上機檢測。
1.4 統計學方法
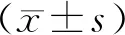
2 結果
2.1 癌組織及癌旁組織中miR-142-5p和WWP1 mRNA表達情況
采用RT-PCR檢測20例患者癌組織及癌旁組織中miR-142-5p和WWP1 mRNA表達情況發現,癌組織中miR-142-5p相對表達水平為(0.68±0.16),顯著低于癌旁組織中(1.88±0.22),差異存在統計學意義(t=19.727;P<0.05)。癌組織中WWP1 mRNA相對表達水平為(2.07±0.24),顯著高于癌旁組織(0.24±0.13),差異存在統計學意義(t=32.027;P<0.05),見圖1。

圖1 癌組織及癌旁組織中miR-142-5p和WWP1 mRNA表達情況
2.2 miR-142-5p和WWP1靶向性驗證結果
經過靶點預測miR-142-5p和WWP1存在結合位點,采用熒光霉素實驗檢測發現加入兩種野生純合子時熒光霉素活性顯著降低(P<0.05);突變質粒組熒光霉素活性無顯著改變(P>0.05),見圖2。

注:**表示P<0.05;Ⅰ為miR-142-5p和WWP1結合靶點預測;Ⅱ為miR-142-5p和WWP1靶向性熒光霉素驗證結果。
2.3 各組細胞中miR-142-5p和WWP1 mRNA表達
采用RT-PCR檢測各組細胞中miR-142-5p和WWP1 mRNA表達情況發現,相比NC組,miR-142-5p組miR-142-5p相對表達水平顯著升高,WWP1 mRNA相對表達水平顯著降低(P<0.05)。相比NC組,WWP1組miR-142-5p相對表達水平顯著降低,WWP1 mRNA相對表達水平顯著升高(P<0.05)。相比WWP1組,miR-142-5p+WWP1組miR-142-5p相對表達水平顯著升高,WWP1 mRNA相對表達水平顯著降低(P<0.05),見圖3。
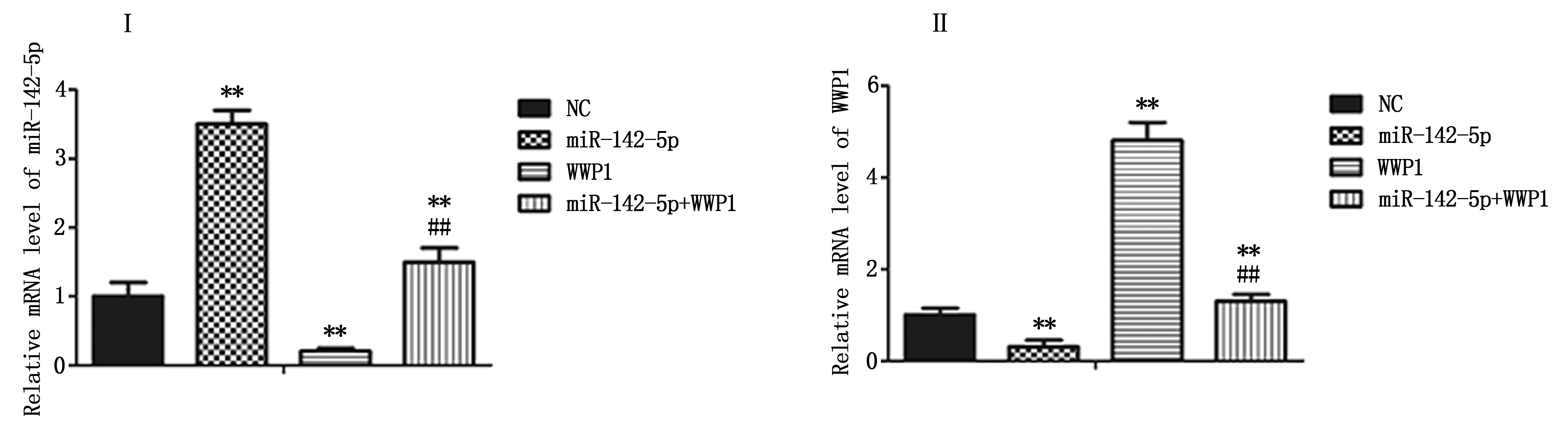
注:與NC組相比,**為P<0.05;與WWP1組相比,##為 P<0.05;Ⅰ為各組細胞中miR-142-5p的相對表達水平;Ⅱ為各組細胞中WWP1 mRNA的相對表達情況。
2.4 miR-142-5p靶向作用WWP1對PC-3細胞侵襲和遷移能力影響
采用Transwell小室實驗檢測各組細胞侵襲能力發現,相比NC組,miR-142-5p組單位面積內侵襲細胞數目顯著降低,WWP1組單位面積內侵襲細胞數目顯著升高(P<0.05);相比WWP1組,miR-142-5p+WWP1組單位面積內侵襲細胞數目顯著降低(P<0.05)。采用劃痕實驗檢測各組細胞遷移能力發現,相比NC組,miR-142-5p組24 h后細胞劃痕愈合率顯著降低,WWP1組24 h后細胞劃痕愈合率顯著升高(P<0.05);相比WWP1組,miR-142-5p+WWP1組24 h后細胞劃痕愈合率顯著降低(P<0.05),見圖4。

注:與NC組相比,**為P<0.05;與WWP1組相比,##為 P<0.05;Ⅰ為Transwell小室拍照;Ⅱ為單位面積侵襲細胞數目;Ⅲ為劃痕實驗0 h和24 h拍照圖;Ⅳ為劃痕愈合率;A為NC組;B為miR-142-5p組;C為WWP1組;D為miR-142-5p+WWP1組。
2.5 miR-142-5p靶向作用WWP1對PC-3細胞侵襲和遷移相關蛋白表達影響
采用蛋白質印跡實驗檢測各組細胞侵襲和遷移相關蛋白表達發現,相比NC組,miR-142-5p組E-cadherin蛋白相對表達水平顯著升高,N-cadherin和Vimentin相對表達水平顯著降低(P<0.05);相比NC組,WWP1組E-cadherin蛋白相對表達水平顯著降低,N-cadherin和Vimentin相對表達水平顯著升高(P<0.05);相比WWP1組,miR-142-5p+WWP1組E-cadherin蛋白相對表達水平顯著升高,N-cadherin和Vimentin相對表達水平顯著降低(P<0.05),見圖5。

注:與NC組相比,**為P<0.05;與WWP1組相比,##為 P<0.05;Ⅰ為侵襲和遷移相關蛋白印跡圖;Ⅱ為侵襲和遷移相關蛋白相對表達水平;A為NC組;B為miR-142-5p組;C為WWP1組;D為miR-142-5p+WWP1組。
2.6 miR-142-5p靶向作用WWP1對PC-3細胞凋亡影響
流式細胞儀檢測發現,相比NC組,miR-142-5p組細胞凋亡率顯著升高,WWP1組細胞凋亡率顯著降低(P<0.05);相比WWP1組,miR-142-5p+WWP1組細胞凋亡率顯著升高(P<0.05),見圖6。

注:與NC組相比,**為P<0.05;與WWP1組相比,##為 P<0.05;Ⅰ為流式細胞檢測結果圖;Ⅱ為細胞凋亡率;A為NC組;B為miR-142-5p組;C為WWP1組;D為miR-142-5p+ WWP1組。
3 討論
PCa已成為僅次于肺癌的癌癥相關死亡的主要原因之一,尋找有效的診斷和治療方法對PCa患者非常重要[7]。越來越多的證據表明,miRNAs可能調控各種癌癥過程,并有作為惡性腫瘤的特異性生物標志物的潛力[8]。研究表明,許多miRNA可以靶向調控相關蛋白,改善腫瘤細胞的惡性生物學特征,達到治療腫瘤的作用[9]。Su等[10]研究表明:miR-142-5p靶向作用MCL 1可以調控卵巢癌細胞凋亡。WWP1是一種 HECT家族的 E3 泛素連接酶,在WWP1蛋白中包含922個氨基酸殘基,含1個 C2 結構域,4個 WW結構域和1個 HECT 結構域,其分子量約為105000[10]。近年來研究發現WWP1在腫瘤組織中異常表達[11]。Jia等[12]研究表明:WWP1在黑色素瘤中呈高表達,降低其表達可有效抑制黑色素瘤的發展。本研究檢測了前列腺組織中WWP1和miR-142-5p的表達情況發現,相比正常的癌旁組織,PCa組織中WWP1呈異常高表達,miR-142-5p呈異常低表達。這與前人研究其他腫瘤組織中的WWP1和miR-142-5p表達相一致。同時在本研究中,我們通過以PC-3細胞作為研究對象,通過生物信息學以及雙熒光素酶報告試驗確定WWP1與miR-142-5p存在靶向性發現,同時加入野生純合子的WWP1和miR-142-5p組熒光霉素活性顯著低于其他各組,說明WWP1上存在于miR-142-5p結合的位點,miR-142-5p可以靶向作用WWP1調控PC-3細胞的相關生物學特征。Wang等[13]研究表明:降低miR-142可以上調WWP 1表達表明miR-142與WWP 1存在靶向結合性,與本研究得出的結論相一致,在本試驗中這一驗證結果為后續的實驗奠定了理論基礎。
腫瘤較強的增殖和侵襲能力是促進腫瘤惡化的重要原因[14]。因此本研究采用了Transwell小室實驗[15]和劃痕實驗[16]檢測了PC-3細胞的侵襲和遷移能力,發現miR-142-5p靶向作用WWP1后PC-3細胞單位面積侵襲細胞數目和劃痕愈合率顯著降低,說明miR-142-5p靶向作用WWP1可以抑制PC-3細胞的侵襲和遷移能力。上皮間充質轉化則是影響腫瘤侵襲和遷移的主要因素[17]。E-cadherin蛋白表達的下降和Vimentin蛋白表達的升高被認為是上皮間充質轉化發生的主要標志[18]。N-cadherin為N黏附蛋白,其表達量高說明其黏附能力降低,升高其表達會使得腫瘤細胞間的黏附能力下降,運動能力增強[19]。本研究檢測這幾種蛋白發現,E-cadherin可以通過多個途徑影響腫瘤的浸潤與轉移,同時在多種腫瘤中也發現Vimentin蛋白表達的上調[20]。在本研究中,miR-142-5p靶向作用WWP1后E-cadherin蛋白相對表達水平顯著升高,N-cadherin和Vimentin相對表達水平顯著降低,說明miR-142-5p靶向作用WWP1使得腫瘤的侵襲和遷移能力降低,其作用機制可能是通過抑制PC-3細胞的上皮間質轉化過程來實現的。腫瘤細胞的凋亡也是其重要生物學特征,促進腫瘤細胞的凋亡可以有效抑制腫瘤的發展[21]。基于此本研究檢測了各組體外培養的PC-3細胞的凋亡情況發現,相比NC組,miR-142-5p組細胞凋亡率顯著升高,WWP1組細胞凋亡率顯著降低;相比WWP1組,miR-142-5p+WWP1組細胞凋亡率顯著升高,說明miR-142-5p靶向作用WWP1可以促進腫瘤細胞的凋亡,通過促進其凋亡調控PCa的發展。
綜上所述,PCa組織中miR-142-5p表達水平低于正常前列腺組織,WWP1水平高于正常組織。miR-142-5p靶向作用WWP1是通過抑制上皮間質轉化過程來抑制前列腺PC-3細胞的侵襲和遷移,同時促進其凋亡。但本研究也存在一定的不足之處,因為時間和經費的限制,尚未對miR-142-5p靶向作用WWP1促進PC-3細胞凋亡的機制進行深入探究,在后續的研究中將進一步深入探究miR-142-5p靶向作用WWP1對PC-3細胞凋亡的機制。

