黃芪誘導人肺癌A549細胞凋亡及作用機制的初步研究
李成亮 王 同
2020年全球最新癌癥負擔數據顯示肺癌是目前世界上發(fā)病率排行第二的惡性腫瘤,且是導致癌癥死亡的主要原因(占癌癥死亡總數的18%)[1]。肺癌病理分型包括非小細胞肺癌和小細胞肺癌。非小細胞肺癌在臨床上最為多見。鑒于目前臨床上肺癌放化療治療的耐藥性增加,以及這些傳統(tǒng)療法的毒性,需要一種新的、無毒的抗癌治療方法。最佳的治療方法是能夠區(qū)分不同類型的細胞,以減少副作用,而植物是一個有希望的來源。植物性或衍生性化合物通常對正常細胞無毒。所有現代醫(yī)學的四分之一直接或間接來源于植物[2]。黃芪是一種在臨床治療中常用的中藥,現代藥理學表明具有提高免疫、臟器保護、抗腫瘤等療效。既往研究表明黃芪能有效抑制肝癌[3]、胰腺癌[4]、胃癌[5]腫瘤細胞的生長,但少有文獻報道黃芪對人肺癌A549細胞體外增殖和凋亡的影響。本文通過研究黃芪在體外對人A549細胞增殖和凋亡的作用,初步探討其促進A549細胞凋亡可能的分子機制。
1 材料與方法
1.1 細胞株
人非小細胞肺癌A549細胞株由安徽醫(yī)科大學第二附屬醫(yī)院科研實驗中心饋贈
1.2 藥物
黃芪注射液,規(guī)格10 ml/支(每1 ml相當于黃芪生藥2 g),購于神威藥業(yè)集團。臨用前原液使用培養(yǎng)基稀釋到所需濃度。
1.3 試劑
RPMI-1640培養(yǎng)基、青霉素-鏈霉素溶液(100X)、胰蛋白酶、CCK-8試劑盒購于武漢普諾賽生命科技公司;胎牛血清購于美國Gbico公司;Annexin-V-FITC/PI試劑盒購于七海復泰生物科技公司;兔多抗survivin、兔多抗bax、兔多抗bcl-2購于美國Affinity公司;引物委托擎科生物科技公司合成。
1.4 方法
1.4.1 細胞培養(yǎng)及分組 細胞培養(yǎng):將配置好的含10%胎牛血清、1%青-鏈霉素的RPMI-1640培養(yǎng)基放入37 ℃恒溫水浴鍋中預熱。凍存的細胞從液氮中取出后,凍存管迅速置于37 ℃水浴鍋中,完全解凍后,將細胞懸液吸到15 ml離心管中,離心管加入4 ml完全培養(yǎng)基重懸細胞,1000 rpm離心,吸取上清液,丟棄。加入完全培養(yǎng)基4 ml重懸細胞,然后將A549細胞株置于37°、5% CO2,相對濕度為90%的培養(yǎng)箱中無菌培養(yǎng)。當培養(yǎng)基變黃時進行換液,棄除舊培養(yǎng)液,3 ml PBS清洗細胞培養(yǎng)瓶兩遍,然后加入完全培養(yǎng)基4 ml,重新放入細胞培養(yǎng)箱中繼續(xù)培養(yǎng)。
分組:實驗設空白對照組(不加藥物,濃度為0 g/ml)和4組不同濃度的黃芪藥物干預組:1組(0.1 g/ml)、2組(0.5 g/ml )、3組(1.0 g/ml)、4組(1.6 g/ml)。各組藥物濃度均使用完全培養(yǎng)基進行稀釋得到。
1.4.2 CCK-8法檢測黃芪注射液對人非小細胞肺癌A549細胞增殖的影響 取對數生長期的A549細胞調成單細胞懸液5×104個/ml,以每孔100 μl接中到96孔板,加入了細胞的96孔板放入培養(yǎng)箱中繼續(xù)培養(yǎng)12 h,待細胞貼壁。12 h后,實驗組分別加入含有終濃度為0.1 g/ml、0.5 g/ml、1.0 g/ml、1.6 g/ml的藥物100 μl,每孔總體積為200 μl。每種藥物濃度設4個復孔,空白對照組只加完全培養(yǎng)基100 μl。以僅含有200 μl的完全培養(yǎng)基,不接種細胞的空白組作為調零孔。將空白對照組、實驗組細胞置于96孔板中,于37 ℃、5% CO2培養(yǎng)箱中分別培養(yǎng) 24 h、48 h。然后,每孔加入10 μl CCK-8試劑,培養(yǎng)箱內繼續(xù)培養(yǎng)4 h 。然后在酶標儀450 nm 波長處檢測各孔的吸光度值(OD值),各孔吸光度值調零后計算抑制率,抑制率(%)=(1-實驗組OD值/空白對照組OD值)×100%。
1.4.3 Annexin-V-FITC/PI雙染法檢測黃芪注射液對人非小細胞肺癌A549細胞凋亡的影響 取生長狀態(tài)良好的A549細胞,調整細胞密度為1×105個/ml,以每孔接種2 ml接種于6孔板,然后放入37 ℃、5% CO2的培養(yǎng)箱中繼續(xù)培養(yǎng)。當6孔板中細胞大約鋪滿孔的70%左右時棄去孔內舊培養(yǎng)基,然后每孔加入濃度為0.1 g/ml、0.5 g/ml、1.0 g/ml和1.6 g/ml的藥物各 2 ml,并設置空白對照組,只加 2 ml完全培養(yǎng)基,分別放入培養(yǎng)箱中繼續(xù)培養(yǎng)24 h、48 h。到時間后收集細胞,按照凋亡試劑盒操作:加入Annexin V-FITC抗體5 μl,輕輕混勻,室溫避光孵育15 min。加入PI抗體10 μl,輕輕混勻。冰浴避光放置5 min。在30 min內進行流式細胞儀檢測。
1.4.4 RT-PCR檢測黃芪注射液干預A549細胞后Survivin mRNA、Bcl-2 mRNA及Bax mRNA水平的變化 由Genbank獲取凋亡相關基因(Survivin、Bcl-2、Bax)和內參(GAPDH)上下游序列,并委托擎科生物科技公司合成。實驗分為5組,對照組為不加藥組,去除孔內舊培養(yǎng)液后加入 2 ml PBS清洗2次,然后加入2 ml 完全培養(yǎng)基。其余4組為實驗組:棄去孔內舊培養(yǎng)液后加入2 ml PBS清洗2次,再向每孔中加入2 ml濃度分別為0.1 g/ml、0.5 g/ml、1.0 g/ml、1.6 g/ml的藥物,再放入培養(yǎng)箱中繼續(xù)培養(yǎng)48 h。TRIzol法提取A549細胞總RNA并測定RNA濃度,逆轉錄獲得cDNA后再進行PCR擴增反應,最后進行實時熒光定量PCR檢測。根據公式△Ct=△Ct目的基因-△Ct內參基因,△△Ct=△Ct實驗組-△Ct空白對照組進行計算,最終數據以2-△△Ct為結果進行分析。
1.4.5 采用Western Blot方法檢測黃芪注射液干預A549細胞后凋亡相關蛋白Survivin、Bcl-2及Bax表達水平的變化 實驗分組及藥物處理同1.4.4,待培養(yǎng)48 h后加入裂解液冰上裂解30 min,4 ℃下12000 rpm離心5 min,BCA法測定蛋白濃度后取40 μg樣品與上樣緩沖液混合,煮沸10 min,進行SDS-PAGE電泳,轉PVDF膜。將膜在含5%脫脂奶粉的TBST中室溫下封閉2 h,隨后加入一抗(兔多抗survivin、兔多抗bax、兔多抗bcl-2,1∶1000稀釋),4 ℃孵育過夜。第二天加入HRP標記羊抗兔二抗(1∶50000稀釋),ECL化學發(fā)光試劑檢測。以GAPDH為內參,以條帶灰度值測定Bcl-2、Bax、Survivin蛋白的相對表達量。
1.5 統(tǒng)計分析
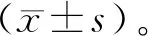
2 結果
2.1 黃芪注射液對A549細胞體外增殖的影響
CCK-8法檢測黃芪注射液不同濃度、不同時間段對A549細胞體外增殖的影響,結果顯示:黃芪注射液干預后能明顯抑制A549細胞的增長,且具有一定的濃度依賴性和時間依賴性。比較4個實驗組和空白對照組的抑制率,差異均具有統(tǒng)計學意義(P<0.01)。單因素方差分析顯示:在同一時間段,隨著藥物濃度的增加,藥物對細胞的增殖抑制率增加,差異具有統(tǒng)計學意義(P<0.01)。在同一藥物濃度下,黃芪對A549細胞的增殖抑制率48 h高于24 h,差異具有統(tǒng)計學意義(P<0.01)。結果見表1、圖1。

表1 不同濃度的黃芪注射液干預A549細胞24h、48h后對增殖的影響

圖1 不同濃度的黃芪注射液對A549細胞的抑制率
2.2 黃芪注射液對人非小細胞肺癌A549細胞凋亡的影響
流式細胞術結果顯示,不同濃度的黃芪注射液干預24 h后細胞凋亡率分別為(8.42±0.32)% 、(13.83±0.42)%、(18.86±0.29)%、(23.12±0.23)%。干預48 h后凋亡率為(13.02±0.39)%、(18.34±0.68)%、(24.95±0.58)%、(32.88±0.90)%。空白對照組24 h凋亡率為(6.17±0.20)%、48 h凋亡率為(5.61±0.10)%。各實驗組凋亡率高于對照組,且相同濃度的黃芪注射液48 h的凋亡率高于24 h。各實驗組與空白對照組相比差異均有統(tǒng)計學意義(P<0.01),不同濃度的黃芪干預組之間差異具有統(tǒng)計學意義 (P<0.01)。
2.3 黃芪注射液對A549細胞凋亡相關基因表達的影響
與空白對照組相比,經藥物干預48 h后,隨著藥物濃度的增加,A549細胞Survivin mRNA、Bcl-2 mRNA表達降低(P<0.05),Bax mRNA表達增加(P<0.01),差異具有統(tǒng)計學意義。以GAPDH為內參,2-△△Ct為結果進行分析。結果見表2,圖2。

表2 黃芪注射液對A549細胞凋亡相關基因表達的影響
2.4 黃芪注射液對A549細胞凋亡相關蛋白表達的影響
黃芪注射液作用A549細胞48 h后,通過western blot檢測Bcl-2、Bax、Survivin蛋白的表達情況,以Survivin/GAPDH、Bcl-2/GAPDH 、Bax/GAPDH表示蛋白的相對表達含量,結果顯示:隨著藥物濃度的升高,Survivin蛋白、Bcl-2蛋白表達量逐漸減少(P<0.05),Bax蛋白表達量逐漸增加(P<0.01)。結果見表3,圖3、4。

圖2 RT-PCR檢測Survivin mRNA、Bcl-2 mRNA和Bax mRNA表達結果

表3 黃芪注射液對A549細胞凋亡相關蛋白表達的影響
3 討論
近年來肺癌的治療出現了許多新策略,如分子靶向治療、免疫治療、中醫(yī)藥治療。通過多種途徑明顯改善了患者的預后。但盡管如此,全身化療仍是肺癌不可替代的基礎治療手段。長期暴露于特定的化療藥物后,腫瘤細胞對一系列具有不同結構和功能的藥物產生交叉耐藥性,這種現象被稱為多藥耐藥性(MDR)。MDR由許多不同的機制共同作用后產生,凋亡逃逸是其中一個重要的機制。最近的證據有力地表明,癌細胞中的幾種因子可以增強抗癌藥物誘導的細胞凋亡的抵抗力。
Survivin包含一個桿狀病毒凋亡抑制重復序列(BIR)蛋白結構域,該結構域將其歸類為凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族成員[6]。目前研究發(fā)現,Survivin對細胞凋亡的抑制分子機制如下[7]:Survivin通過直接抑制負責誘導和執(zhí)行凋亡的caspase;Smac/DIABLO與細胞色素C一起從線粒體釋放到胞漿中,Smac/DIABLO可以通過結合和抑制IAP蛋白的抑制效應來促進細胞凋亡;Survivin可能通過結合和隔離Smac/DIABLO間接抑制caspase活性,從而阻止Smac/DIABLO與其他IAP結合,從而抑制細胞死亡,促進癌細胞存活。近年來研究發(fā)現,在大多數人類腫瘤細胞中都可以檢測到Survivin,包括結腸癌[8]、乳腺癌[9]、肺癌[10]等,但在正常成人組織卻罕見其表達。目前僅在正常成人的結腸隱窩的底部[11]、胎盤組織[12]中有所發(fā)現。這些特點說明Survivin基因與細胞增殖之間有著密不可分的聯(lián)系。余江濤等[13]發(fā)現survivin基因在甲狀腺癌組織和細胞中呈高表達,沉默其表達可誘導甲狀腺癌細胞凋亡。賈富鑫等[14]發(fā)現survivin基因在胰頭癌組織的表達升高,且與胰頭癌的發(fā)生發(fā)展及預后密切相關。
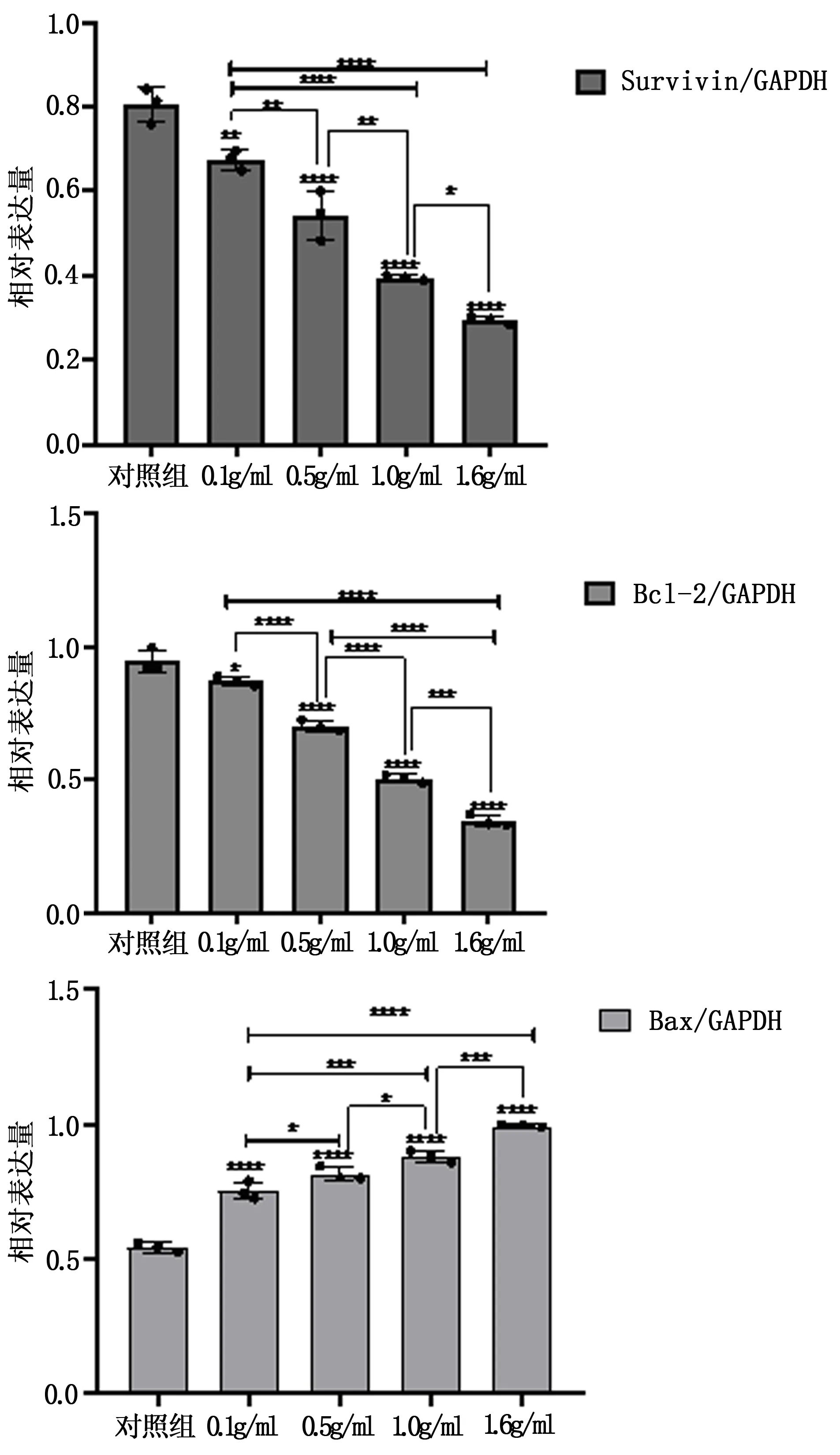
圖3 Survivin蛋白、Bcl-2蛋白和Bax蛋白的相對表達情況

圖4 不同濃度黃芪注射液作用A549細胞48 h后Survivin、Bcl-2、Bax蛋白質電泳圖
Bcl-2基因發(fā)現于B細胞濾泡性淋巴瘤的t(14;18)染色體易位斷裂點,Bcl-2家族蛋白也是調控細胞凋亡的關鍵因子。Bcl-2家族包括三類,第一類抑制凋亡(BCL-2,BCL-XL,BCL-W,MCL1,BCL-B),而第二類促進凋亡( BAX,BAK and BOK ),第三類不同的BH3-Only蛋白具有一個保守的BH3結構域,它可以結合并調節(jié)抗凋亡的bcl-2蛋白,從而促進細胞凋亡[15]。Bcl-2家族主要參與線粒體凋亡途徑,目前認為機制如下:在接收到不同的凋亡刺激后,兩個重要的促凋亡蛋白Bax和Bak通過形成線粒體外膜通透性(MOMP)復合物來啟動細胞凋亡[16]。MOMP的形成導致細胞色素C和其他因子從線粒體膜間間隙釋放出來,進而激活關鍵的caspase級聯(lián)。Bcl-2蛋白家族的抗凋亡和促凋亡蛋白之間的相互作用可以抑制或激活MOMP,并決定細胞的命運[17]。裴巖巖、張璐等[18-19]體外實驗研究發(fā)現Bax mRNA和蛋白表達水平上調,Bcl-2 mRNA和蛋白表達水平下調,能抑制人乳腺癌MCF-7細胞、腎癌ACHN細胞增殖并誘導腫瘤細胞凋亡。
隨著科學技術的進步,很多中草藥作用機制的逐步被闡明。黃芪提取物中抗腫瘤的主要活性成分為黃芪甲苷。安小翠等[20]研究發(fā)現黃芪甲苷可以通過調節(jié)氧化應激和NF-κB信號通路實現抑制肝癌細胞HepG2的增殖并促進其凋亡。曹艷等[21]研究發(fā)現在體外黃芪甲苷能夠通過抑制細胞外信號調節(jié)激酶(ERK)信號通路減少細胞MMP-2和MMP-9的表達而發(fā)揮抑制胃癌細胞侵襲的能力。本實驗通過對細胞凋亡相關機制的研究,發(fā)現:黃芪注射液能有效抑制人非小細胞肺癌A549細胞的體外增殖。這可能與藥物下調Survivin 、Bcl-2基因的轉錄和蛋白質表達,上調Bax基因的轉錄和蛋白質表達,從而促進細胞凋亡有關。希望隨著分子生物學的發(fā)展,更多的中藥提取物可以作為臨床治療過程中的輔助抗腫瘤藥物,進而提高腫瘤細胞凋亡率,降低腫瘤細胞多藥耐藥,進一步改善患者預后。

