EAE小鼠腦和脊髓維生素D受體蛋白表達差異研究
朱俊羽, 楚 蘭, 徐 竹, 高子丹, 丹珍卓瑪
多發性硬化(Multiple Sclerosis,MS)是一種以中樞神經系統炎性脫髓鞘為主要特點的免疫性疾病,病損主要累及皮質、近皮質、腦室周圍、視神經、小腦、腦干和脊髓[1]。以20~40歲的青壯年多發,女性更常見[2]。MS的病因尚不明確,流行病學研究顯示MS在各地區發病率差異顯著,越接近赤道、日照時間越長的地區,發病率越低,且維生素D的缺乏與MS發病率呈負相關[3]。在兩項分別對健康對照和美國非西班牙裔白人MS患者以及瑞典MS患者的維生素D水平研究中,早期低維生素D水平是疾病活動和進展的重要危險因素[4]。實驗性自身免疫性腦脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)是經典的MS動物模型[5],目前已經有的多項研究均提示1α,25-二羥基維生素D3 (1α,25-(OH)2D3,骨化三醇)能夠控制EAE的發展[6,7],在對EAE補充1α,25-(OH)2D3后發現,鼠的神經元凋亡損傷減少,神經干細胞出現生長,中樞神經系統病理變化得到改善[8]。此外,Gargari等[9]發現,1α,25-(OH)2D3可使MS患者外周血單核細胞表達白細胞介素-6、白細胞介素-17基因下調,減緩疾病進展。但同時也有單純使用1α,25-(OH)2D3達不到保護性作用的報道[10]。
1α,25-(OH)2D3是維生素D在體內經過兩次羥化后的活性代謝產物,與維生素D受體(Vitamin D Receptor,VDR)結合后發生磷酸化,并與維甲酸類受體(Retinoic X Receptor,RXR)形成 1α,25-(OH)2D3-VDR-RXR 復合物。此復合物通過胞內信號轉導調節細胞的基因轉錄程序,激活靶基因,調控整個細胞功能,分泌各種細胞因子,調節免疫功能[11]。既然1α,25-(OH)2D3具有調節免疫平衡的作用,但是僅補充1α,25-(OH)2D3又并不能完全遏制MS的發展。因此有必要對介導1α,25-(OH)2D3發揮生物學作用的VDR進行研究。本研究以EAE小鼠為對象,對比其中樞神經系統不同區域和不同神經功能評分時VDR蛋白表達情況,期望從中找到VDR的表達規律,為進一步實驗奠定基礎。
1 材料及方法
1.1 動物 實驗選擇8~10周齡的C57BL/6雌性小鼠,體重18~20 g,由貴州醫科大學實驗動物中心統一購入。本次研究已通過貴州醫科大學動物實驗倫理委員會審查(編號:1901081)。
1.2 試劑 MOG35-55多肽楚肽生物公司,弗式完全佐劑(CFA)購自美國Sigma公司,佐劑用卡介苗購自石家莊開創生化公司,注射用百日咳毒素購自美國Listbio公司,Rabbit anti-VDR購自美國Affinity公司,Rabbit anti-GAPDH購自杭州賢至公司,Goat anti-Rabbit IgG(H+L)購自武漢普美克公司。
1.3 建立EAE動物模型[12]MOG35-55溶液與含卡介苗的CFA等體積混勻制成抗原乳劑。用4%水合氯醛腹腔注射麻醉小鼠后,在小鼠脊柱兩側以250 μg/只的劑量多點皮內注射抗原乳劑。分別在免疫當天即0 d和免疫2 d對小鼠經腹腔注射百日咳毒素稀釋液,200 ng/只。健康對照組(n=6)小鼠不做任何處理。每日觀察并記錄小鼠飲食、活動及體重變化,連續21 d。
1.4 評分及分組 根據Weaver’s 15分法[13]對小鼠進行神經功能評分:尾巴可正常抬高,無無力癥狀評0分;尾巴張力減低或尾巴遠端癱瘓評1分;尾巴全癱評2分;四肢無無力癥狀或步態異常評0分;單個肢體步態不穩、跛行評1分,單個肢體輕癱,行走有拖拽評2分,單個肢體全癱(腳掌上翻)評3分。尾巴和每個肢體累加得出總分,死亡記為15分,其中有無力癥狀表現,但程度不到1分的記為0.5分。評分由兩名實驗員分別完成并記錄。
從免疫0 d開始到21 d,神經功能評分為0分,即為0分組(n=6);免疫21 d神經功能評分>0分且<6分,即為低分組(n=6);免疫21 d神經功能評分≥6分,即為高分組(n=6)。
1.5 透射電子顯微鏡觀察腦組織髓鞘結構 處死小鼠后取部分腦組織,3%戊二醛固定,脫水處理后,經高純化鉛液染色處理后在透射電子顯微鏡(FEI Tecrai G2 Spirit)下對髓鞘結構進行觀察。
1.6 Western Blot檢測組織VDR蛋白表達情況 取EAE組和健康對照組組織提蛋白,SDS-PAGE凝膠電泳檢測各組織VDR蛋白表達情況。VDR (1∶1000),GAPDH (1∶1000)一抗4 ℃過夜,山羊抗兔IgG(1∶2000)二抗室溫孵育2 h,Bio-Rad 凝膠成像系統對條帶顯影后Image J統計分析結果。
2 結 果
2.1 EAE小鼠體重及24 h食量變化情況 EAE低分組和高分組都在發病前出現體重下降、24 h食量下降,0分組和健康對照組體重波動平穩;隨著免疫天數的增加,低分組體重逐漸趨近0分組和健康對照組體重水平,高分組體重下降明顯。在免疫前期0分組24 h食量較高分組、低分組、健康對照組多,后期四組小鼠24 h食量相近(見圖1、圖2)。
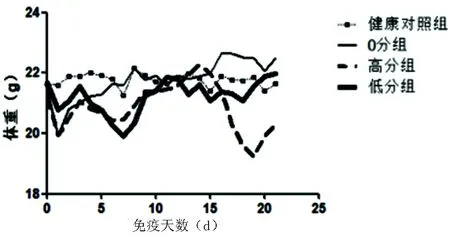
圖1 健康對照組與0分組、高分組、低分組EAE小鼠免疫后到21 d體重變化
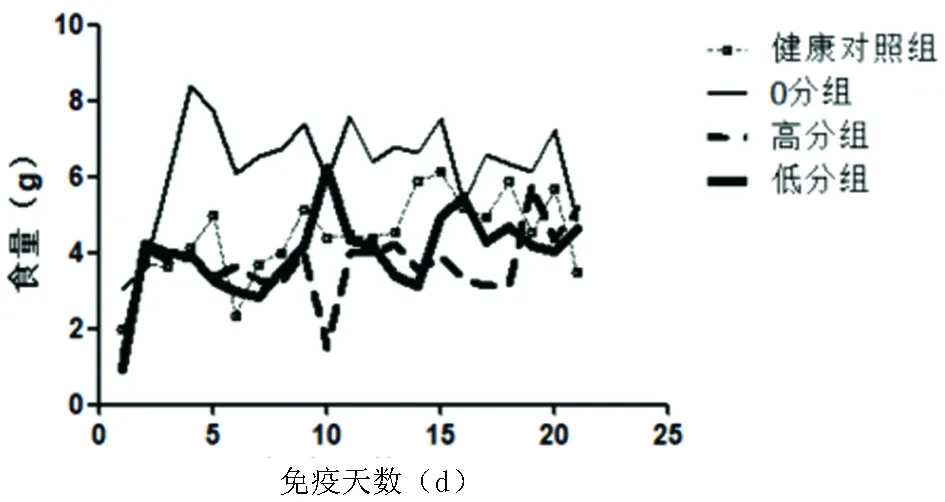
圖2 健康對照組與0分組、高分組、低分組EAE小鼠免疫后到21 d 24 h食量變化
2.2 EAE小鼠神經功能評分 小鼠免疫后出現精神萎靡,懶動,皮毛粗糙無光澤,偶有寒顫、體溫稍高癥狀,EAE高分組和低分組小鼠免疫后12 d開始出現尾巴無力,遠端下垂,后逐漸累及雙后肢和前肢,造成明顯運動障礙,小鼠神經功能評分逐漸增加,到免疫18 d,低分組小鼠神經功能評分開始降低,高分組小鼠評分持續增加,到免疫21 d沒有繼續增加;0分組和健康對照組沒有出現明顯的肢體運動障礙,神經功能評分均為0分(見圖3、圖4)。
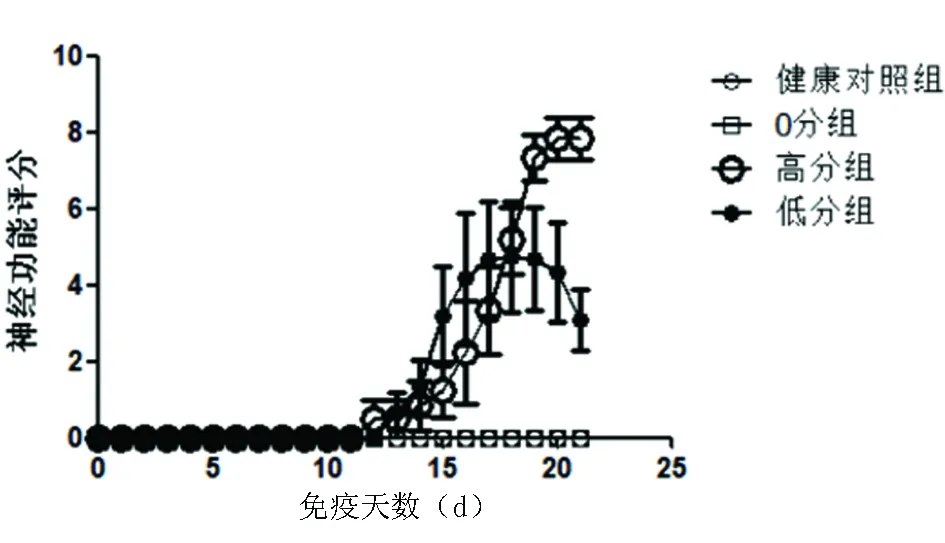
圖3 健康對照組與0分組、高分組、低分組EAE小鼠免疫后到21 d神經功能評分變化
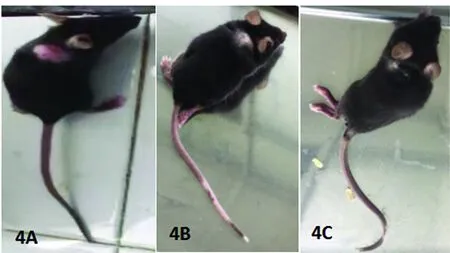
4A:EAE小鼠尾巴遠端下垂,無力,神經功能評分1分;4B:EAE小鼠尾巴全癱,左后肢無力、行走拖拽,右后肢全癱,腳掌上翻,神經功能評分7分;4C:EAE小鼠尾巴全癱,雙后肢全癱,左前肢無力,神經功能評分9分
2.3 EAE腦組織髓鞘結構變化 在透射電子顯微鏡下,健康對照組小鼠髓鞘橫截面呈黑色環形,形態結構連續,無空泡、增粗和分層等損傷表現;EAE 0分組小鼠部分髓鞘結構呈斷裂、分層、空泡變性;EAE高分組小鼠髓鞘損害嚴重,環形結構不完整;EAE低分組小鼠髓鞘雖然完整,但有明顯增粗、分層樣改變(見圖5)。

5A:健康對照組(100 nm,10000×),髓鞘橫截面為黑色連續環形結構(↑);5B:EAE0分組(100 nm,10000×),部分髓鞘斷裂,呈分層、空泡變性(↑);5C:EAE高分組(100nm,10000×),大片髓鞘損害,環形結構消失(↑);5D:EAE低分組(100 nm,10000×),髓鞘橫截面呈增粗、分層樣改變(↑)
2.4 EAE高分組不同腦區及脊髓VDR蛋白表達情況 比較EAE高分組與健康對照組的皮質、白質、小腦、腦干和脊髓的VDR蛋白表達,發現5個部位VDR蛋白的表達較健康對照組均呈不同程度的下降趨勢,其中腦干和脊髓的VDR蛋白表達明顯低于健康對照組,差異有統計學意義(P=0.046,P=0.009),其余部位VDR蛋白表達下降,差異無統計學意義(見表1、圖6)。
表1 健康對照組和EAE高分組腦和脊髓組織的VDR蛋白表達情況比較
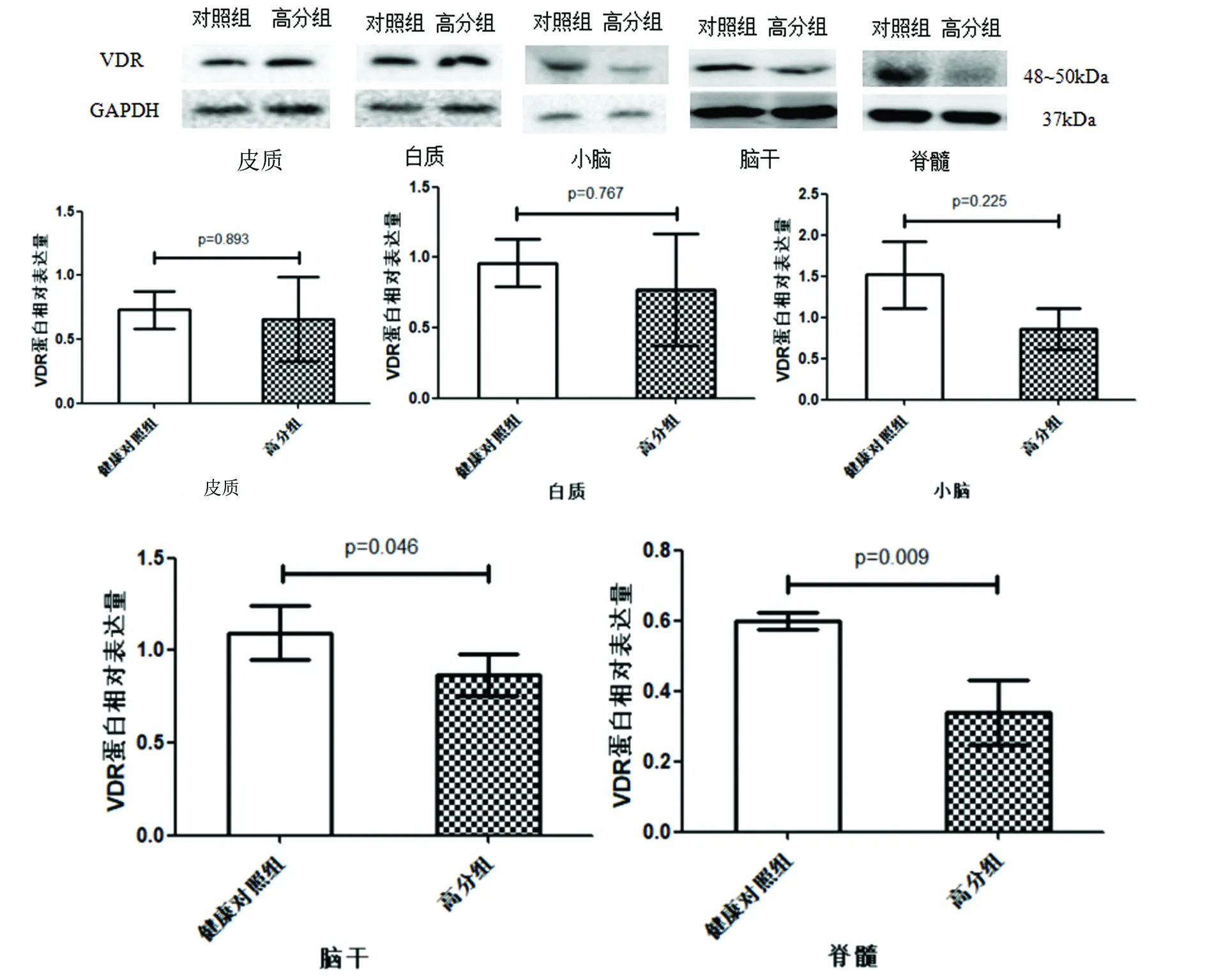
圖6 健康對照組和EAE高分組腦和脊髓組織的VDR蛋白表達比較
2.5 EAE各組脊髓組織中VDR蛋白的表達情況 分別檢測EAE 0分組、高分組、低分組的VDR蛋白表達,并與健康對照組相比較,發現VDR在EAE各組的脊髓組織中都表現為下降趨勢,且都低于健康對照組,差異有統計學意義(0分組P=0.005,高分組P=0.009),其中以低分組較健康對照組下降更明顯,差異有統計學意義(P<0.0001)。EAE各組VDR蛋白表達水平兩兩比較,發現高分組較0分組低,差異無統計學意義(P=0.716),低分組較0分組VDR蛋白表達進一步下降,有統計學意義(P=0.003),同時低分組較高分組下降,有統計學意義(P=0.013)(見表2、圖7)。
表2 健康對照組和EAE脊髓組織各疾病嚴重程度階段VDR蛋白的表達比較
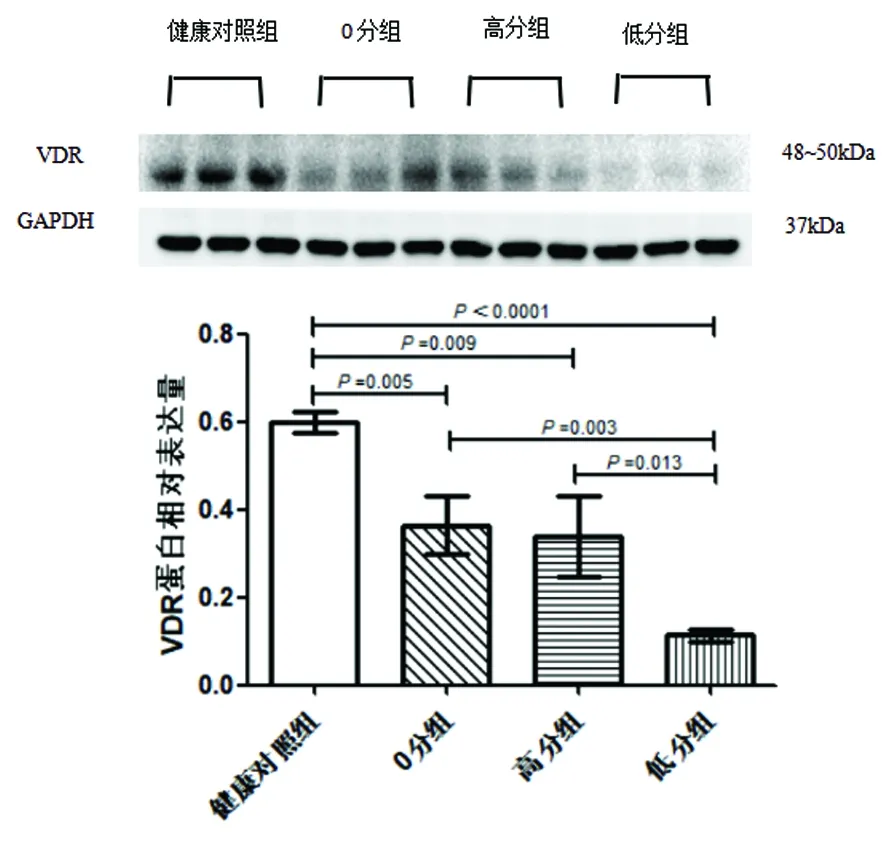
圖7 健康對照組和0分組、高分組、低分組脊髓組織VDR蛋白的表達比較
3 討 論
MS最常見的臨床病程分型為:復發-緩解型(relapsing-remitting,RR)、原發進展型(primary-progressive,PP)、繼發進展型(secondary-progressive,SP)和進展復發型(progressive-relapsing,PR)[14]。其中,約80%~85%的MS患者最初表現為復發-緩解病程,隨著每次的復發,患者可能會遺留不同程度的肢體功能障礙和(或)感覺障礙[2]。臨床上最常使用擴展殘疾狀態量表(Expanded Disability Status Scale,EDSS)對MS患者功能系統和運動情況進行綜合評價,以評估患者疾病嚴重程度和指導后續治療方案[15]。
根據MS女性多發的流行病學特點,本實驗選擇雌鼠進行EAE模型建立。而以MOG35-55為抗原誘導的EAE表現為復發-緩解病程,發病高峰期為14~20 d[16,17]。對EAE小鼠神經功能評分常用5分法或者10分法[18~20],本次實驗需要根據EAE小鼠神經功能評分進行分組,而Weaver’s 15分法對小鼠每個肢體運動情況都有細化的評分,并采用累計計分的方式,相較常用的評分方法更能滿足實驗需求;而且EAE小鼠發病通常由尾巴開始,逐漸累及四肢,Weaver’s 15分法對四肢的細化評分能更好的體現小鼠疾病的進展情況以及癥狀緩解情況,故本實驗最終選擇了Weaver’s 15分法對EAE小鼠進行行為學評估。但是在造模的過程中出現了EAE小鼠疑似由于小腦和腦干脫髓鞘引起的軸向旋轉運動[21],在后續的實驗中不同的評分方案相結合也許更能客觀地量化EAE的神經功能損傷情況。
實驗以21 d為終點,根據Weaver’s 15分法和EAE小鼠由尾巴逐漸累及四肢的發病特點,當評分=0時,EAE小鼠沒有表現明顯運動障礙,設為0分組;當評分>0分且<6分時,小鼠肢體運動障礙多表現為輕癱或者步態不穩,設為低分組;當評分≥6分時,小鼠出現單側或者雙側肢體全癱或者累及雙側或單側前肢,設為高分組。通過對健康對照組和各組EAE小鼠體重、食量的記錄,觀察到EAE高分組和低分組小鼠在發病前會出現體重明顯下降,這與相關文獻描述一致[5,17],0分組小鼠沒有觀察到典型的發病情況,體重也沒有明顯下降。在食量沒有明顯減少的情況下,高分組體重隨神經功能評分增加呈持續降低,而低分組體重逐漸趨近0分組和健康對照組,神經功能評分也逐漸降低。
通過在透射電子顯微鏡下觀察健康對照組和各組EAE小鼠髓鞘結構的變化,健康對照組髓鞘橫截面呈黑色環形,結構連續,無空泡、增粗和分層等損傷表現。EAE各組的髓鞘都有不同程度的損傷,以高分組髓鞘環形結構消失為最嚴重,這與高的神經功能評分相對應;低分組髓鞘明顯增粗、分層,結合該組神經功能評分在免疫后18 d降低的表現,推測該組更接近EAE的緩解狀態;值等注意的是0分組雖然神經功能評分為0分,但是電鏡下髓鞘結構不連續,且有空泡樣的破壞,說明單單只靠神經功能評分鑒別EAE的發病與否可能還欠完善。
根據電鏡結果提示EAE高分組髓鞘破壞最嚴重,所以實驗選擇對EAE高分組和健康對照小鼠的皮質、白質、小腦、腦干、脊髓的VDR蛋白表達進行檢測,發現所檢測部位的VDR蛋白表達均呈下降趨勢,但是在腦干、脊髓下降趨勢顯著,這與EAE在腦干和脊髓病變最為顯著的結果相一致[12]。
接下來,考慮到EAE小鼠免疫后首發無力癥狀均表現在尾部,然后累及雙后肢,且VDR在脊髓下降趨勢更顯著,所以實驗進一步選擇脊髓為主要研究部位,對EAE 0分組、高分組、低分組脊髓組織VDR蛋白表達進行檢測,并兩兩比較,發現VDR在EAE各組的脊髓組織中都低于健康對照組,EAE各組之間VDR蛋白表達水平兩兩比較后,發現0分組、高分組、低分組呈逐漸下降趨勢。VDR的表達水平與EAE病情程度的關系需要進一步實驗說明。
本次研究分別檢測了VDR在EAE小鼠腦和脊髓的表達情況,以及EAE各組神經功能評分的小鼠脊髓組織的表達水平,有助于完善我們對EAE小鼠模型中VDR的認識;同時為尋找1α,25-(OH)2D3的最佳治療時機和VDR表達之間的相關性提供理論依據,也為后期EAE進行進一步的1α,25-(OH)2D3干預實驗和更多的臨床分析研究提供參考。

