線粒體未折疊蛋白反應在癲癇海馬神經中的變化及線粒體特異性抗氧化劑對其影響
謝南昌, 于曉夢, 王曉藝, 杜麗媛, 劉鳳霞, 張婉婉, 連亞軍
癲癇是常見的神經系統疾病,其中約30%患者盡管予以合理的藥物治療,仍反復發作,稱為藥物難治性癲癇,因此明確癲癇的發病機制及尋找新的治療靶點尤為重要[1]。近年來研究表明線粒體功能障礙可能是癲癇的核心發病機制[2]。線粒體未折疊蛋白反應(mitochondrial unfolded protein response,mtUPR)是指在應激條件下,各種錯誤折疊的蛋白質在線粒體內聚集,線粒體為了維持自身蛋白質的穩態而啟動的一種保護性應激反應,即通過啟動由核 DNA 編碼線粒體伴侶蛋白(如HSP60)和蛋白酶(如CLpP)等基因群轉錄活化,誘導其相關蛋白表達增加以恢復線粒體功能[3]。適度的mtUPR可以促進線粒體蛋白穩態恢復,是早期發生的線粒體保護反應,而過度的mtUPR則會通過HSP60調控的PINK1/Parkin途徑引發過度線粒體自噬,最終導致細胞凋亡[4]。
線粒體是活性氧(reactive oxygen species,ROS)產生的主要場所,癲癇發作導致線粒體功能受損使ROS生成增加,線粒體膜電位降低,線粒體鈣超載進而氧化應激過度發生,誘導DNA、脂質和蛋白質發生氧化損傷,在線粒體內錯誤折疊和聚合,從而激活mtUPR[5]。Mito-TEMPO是一種線粒體靶向超氧化物歧化酶,具有清除超氧化物和烷基自由基的能力,可以減少線粒體ROS生成,發揮抗氧化應激的作用,改善細胞氧化損傷[6]。已有研究表明Mito-TEMPO可減輕脂多糖誘導肺動脈內皮細胞的線粒體氧化應激[7]和腎纖維化中的線粒體功能障礙[8],但Mito-TEMPO在癲癇海馬神經損傷中的作用仍未可知。
本研究中,我們采用氯化鋰-匹魯卡品(pilocarpine,PILO)建立癲癇持續狀態大鼠模型,觀察癲癇發作過程中mtUPR的動態變化;并進一步探討線粒體特異性抗氧化劑(Mito-TEMPO)對癲癇mtUPR及線粒體損傷的作用和機制。
1 材料與方法
1.1 動物與造模 本次研究已經通過鄭州大學動物實驗倫理的批準,并且按照國際動物研究指南進行。成年雄性Wistar鼠(鄭州大學實驗動物中心提供),重量在220~250 g,飼養溫度適宜 (20±2)℃,標準飼料喂養,自由攝食水,自然光照照射,自然通風換氣。隨機分為空白對照組(CON組)、致癇組(PILO組)(2 h、8 h、24 h和72 h 4個亞組)、Mito-TEMPO組和PILO + Mito-TEMPO組4組。建立大鼠癲癇持續狀態模型[9],所有大鼠均腹腔注射氯化鋰(127 mg/kg)進行預處理,20 h后給予腹腔注射東莨菪堿(1 mg/kg)以拮抗PILO的外周膽堿能反應,30 min后予以腹腔注射PILO(30 mg/kg)。對照組用等體積的0.9%生理鹽水代替PILO。PILO+Mito-TEMPO組在PILO注射前20 min予以腹腔注射Mito-TEMPO(20 mg/kg)。按照改良后的Racine分級法判定癲癇發作等級。癲癇持續1 h后,腹腔注射地西泮(10 mg/kg)以終止發作。致癇組分別在大鼠癲癇持續狀態后2 h、8 h、24 h和72 h后斷頭處死。
1.2 儀器與試劑 氯化鋰、匹魯卡品(Sigma,USA);Rhodamine123 (Sigma,USA);線粒體內熱休克蛋白HSP60、線粒體蛋白酶LONP1、CLpP抗體 (CST,USA);β-actin、CHOP抗體(Santa Cruz,USA);全蛋白提取試劑盒(中國碧云天公司);組織線粒體分離試劑盒(上海杰美基因醫藥科技有限公司);辣根過氧化物酶標記的山羊抗兔抗體(北京晶美生物工程有限公司);線粒體特異性抗氧化劑Mito-TEMPO(MedChemExpress,USA)。
1.3 分離線粒體 從海馬組織中分離出線粒體[10]。首先將取出的新鮮海馬組織快速放入預冷的分離培養基中(0.25 mol/L 蔗糖,10 mmol/L Tris-HCL,pH 7.4,1 mmol/L MEDTA 和250 μg /mL BSA),徹底清洗組織,將組織制備成10%的勻漿,然后在650×g條件下離心10 min,去除細胞核和組織碎片,收集上清液然后進一步以10000×g離心10 min。緩慢抽出上清液,用分離培養基清洗兩次沉淀的線粒體碎片,然后6500×g離心10 min后重新沉淀,整個過程溫度控制在0~4 ℃。然后按照說明書,并用X-rhod-1對線粒體進行染色,在激發波長575 mm和發射波長605 mm的條件下,用分光光度計測定其熒光特性。
1.4 線粒體ROS生成水平檢測 用活性氧熒光探針(DCFDA)測定線粒體ROS生成水平[11]。將線粒體碎片(0.4 mg/L)置于DCFDA (2 μmol/L)溶液中,在25℃下孵育30 min,在激發波長485 nm和發射波長530 nm條件下測量DCA熒光,通過各單位的熒光強度來表示線粒體ROS生成水平。
1.5 線粒體膜電位檢測 采用Rhodamine123檢測線粒體膜電位水平。避光配置Rhodamine123工作液,向0.9 ml Rhodamine123染色工作液中加入0.1 ml總蛋白量為30 μg的純化的線粒體,37 ℃、5%CO2的孵育箱中孵育5 min。隨后10000×g離心10 min,使線粒體顆粒化,最后使用熒光顯微鏡,在激發波長507nm,發射波長529 nm條件下檢測各組熒光強度。
1.6 Western Blot檢測相關蛋白表達 從各組完整海馬組織和線粒體碎片中提取蛋白質,然后用BCA蛋白定量試劑盒測量蛋白質濃度[12]。在每個梳孔內加入等量的蛋白(30μg/孔),然后進行SDS凝膠電泳,然后進行轉膜,一抗孵育,HSP60 (1∶1000)、LONP1(1∶1000)、CLpP(1∶1000)和β-actin(1∶5000),后4 ℃過夜,洗膜后加入辣根過氧化物酶標記抗兔二抗(1∶5000),37 ℃孵育1 h,用增強化學發光試劑盒檢測蛋白條帶,使用光密度值表示各組蛋白表達量。
1.7 透射電鏡觀察線粒體超微結構 取小塊海馬組織塊,于2.5%戊二醛溶液中固定2 h,PBS浸洗15 min×3次,1%鋨酸固定2 h,PBS浸洗15 min×3次,4 ℃條件下乙醇梯度脫水,室溫丙酮脫水15 min×3次,包埋,切取海馬冠狀切片,3%醋酸鈾-枸櫞酸鉛雙染色,待超薄切片干燥后,透射電鏡下觀察。
1.8 Nissl染色觀察海馬神經元損傷 各組大鼠分別予以用10%的水合氯醛(100 mg/kg)麻醉,固定于解剖板上,用4%多聚甲醛緩灌注大鼠心腔,然后在PBS緩沖液(pH 7.4)中分離出完整大腦,分離出的各組腦組織用石蠟包埋24 h,然后冠狀切取厚度約10 μm的連續切片。按照常規方法用甲苯胺藍作Nissl染色,在高倍鏡(400×)下計算大鼠海馬CA3區存活的錐體細胞[13]。
2 結 果
2.1 癲癇海馬神經中線粒體ROS生成和線粒體膜電位的變化及Mito-TEMPO對其影響 與CON相比,在致癇后2 h,線粒體ROS水平開始增加,72 h達到最大水平;膜電位開始降低,72 h降到最低水平,差異有統計學意義(P<0.05)。與PILO組相比,PILO + Mito-TEMPO組ROS水平明顯降低,線粒體膜電位明顯升高,差異有統計學意義(P<0.05)(見圖1、圖2)。
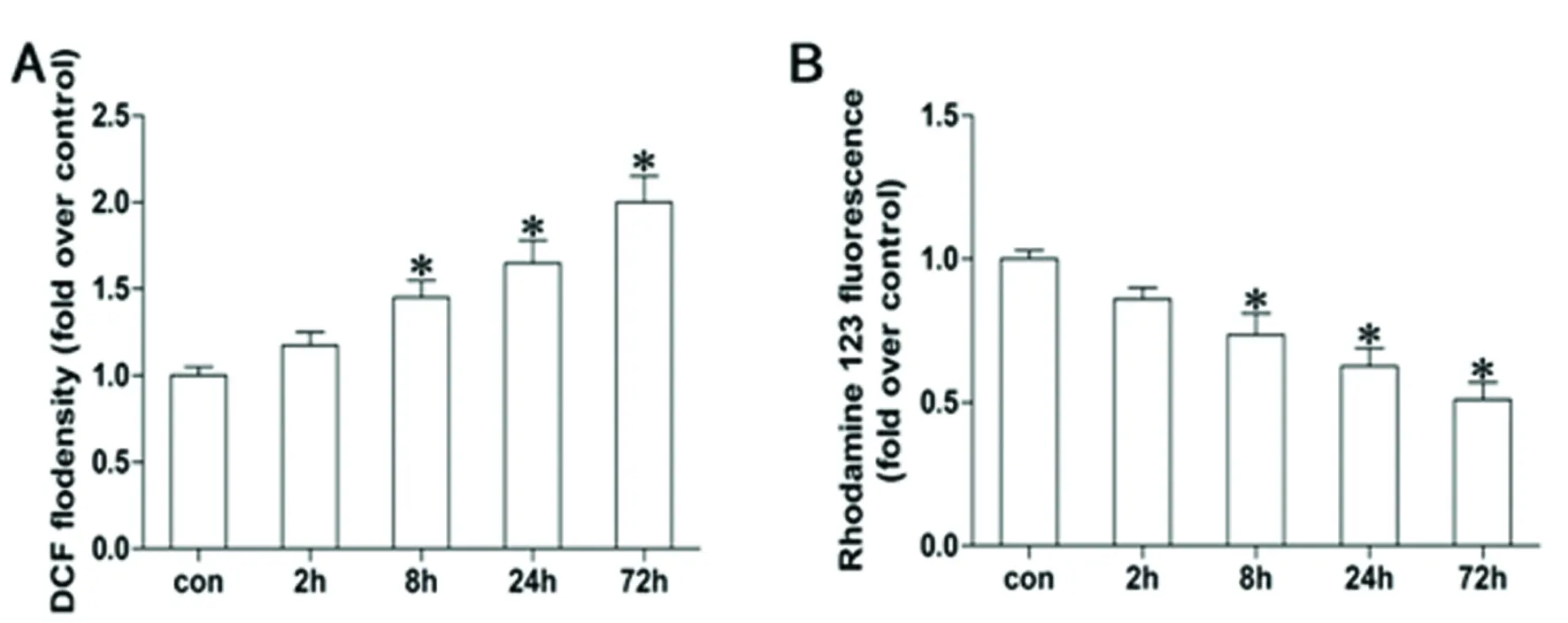
圖1 A:各致癇組海馬神經線粒體ROS生成變化;B:各致癇組海馬神經元線粒體膜電位變化
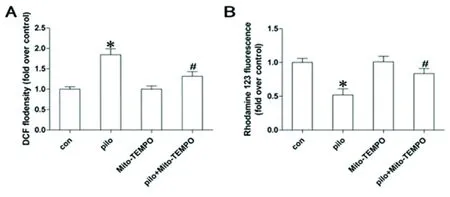
圖2 A:各組海馬神經線粒體ROS生成變化;B:各組海馬神經元線粒體膜電位變化
2.2 癲癇海馬神經中mtUPR相關蛋白HSP60、LONP1 和CLpP表達變化及Mito-TEMPO對其影響 與CON組相比,PILO組HSP60、LONP1、CLpP表達量增加,差異有統計學意義(P<0.05)。與PILO組相比,PILO + Mito-TEMPO組HSP60、LONP1 和CLpP 表達水平降低,差異有統計學意義(P<0.05)(見圖3)。
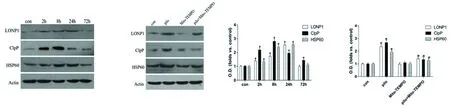
圖3 A:致癇后海馬神經元LONP1、CLpP和HSP60的表達水平變化;B:各組海馬神經元LONP1、CLpP和HSP60的表達水平變化
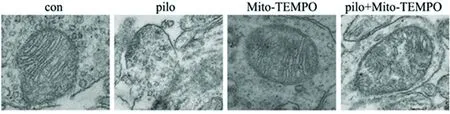
2.3 癲癇海馬神經線粒體超微結構變化及Mito-TEMPO對其影響 電鏡下顯示,CON組和Mito-TEMPO組大鼠海馬神經元超微結構完整、清晰,線粒體無損傷;PILO組海馬神經元的線粒體結構模糊,線粒體嵴腫脹明顯,并且部分線粒體存在內外膜的崩解;PILO + Mito-TEMPO組可見線粒體結構相對完整,內外膜連續,線粒體嵴略腫脹,結構尚可辨認(見圖4)。
2.4 癲癇海馬神經損傷及Mito-TEMPO對其影響 CON組大鼠CA3區錐體神經元結構清晰,形態完整,排列緊密,染色稍深,胞漿內含有豐富的尼氏小體。PILO組明顯可見海馬神經元結構出現損傷,結構模糊,排列稀疏,尼氏小體數量大量減少。與PILO組比較,PILO + Mito-TEMPO組海馬神經元結構損傷明顯減輕,可見大體輪廓,排列稍致密,尼氏小體數量增多。Mito-TEMPO組與CON組相比,差異不明顯(見圖5、表1)。
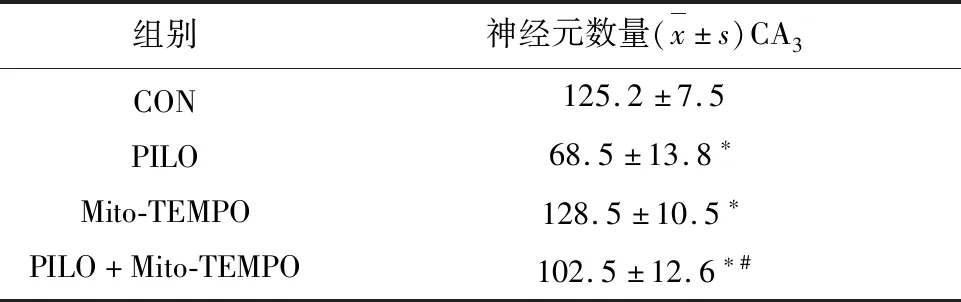
表1 各組大鼠海馬CA3區存活的神經數目比較(0.5 mm)
A CON組;B PILO組;C Mito-TEMPO組;D PILO+Mito-TEMPO組
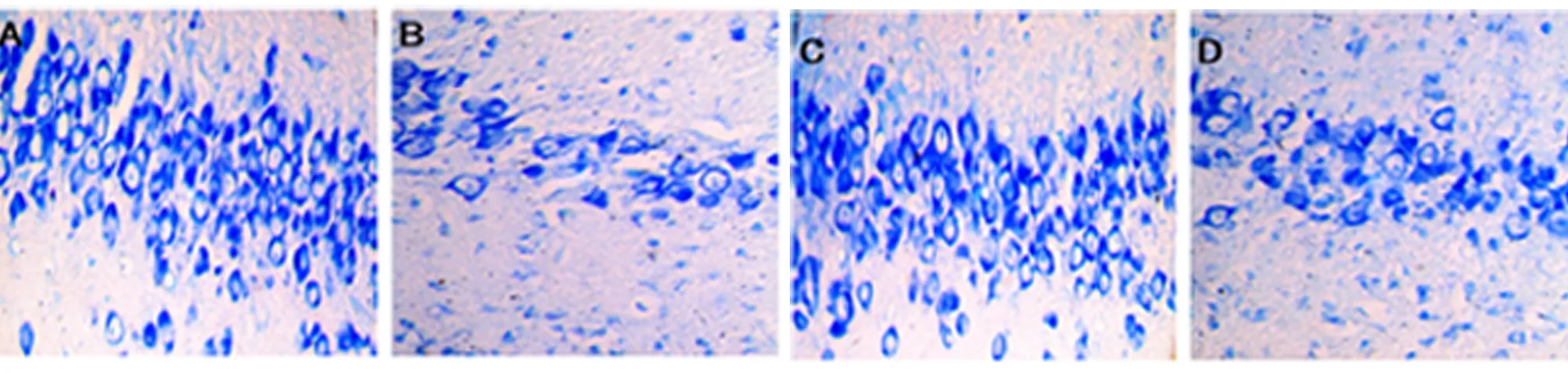
圖5 各組大鼠海馬神經元CA3區Nissl染色(Nissl染色,×400)
3 討 論
近期研究發現過度的mtUPR參與應激狀態下線粒體自噬過程,致使線粒體損傷加重,加劇細胞損傷及凋亡[4]。本研究發現,癲癇發作使線粒體超微結構損傷嚴重,線粒體ROS生成增加,線粒體膜電位降低,mtUPR相關蛋白HSP60、LONP1、CLpP1表達增加,表明mtUPR參與癲癇發生發展過程;而采用線粒體特異性抗氧化劑Mito-TEMPO干預,則明顯緩解mtUPR發生及線粒體結構功能損傷,表明Mito-TEMPO可能通過調控mtUPR對癲癇海馬神經損傷發揮保護作用。
生理條件下,線粒體在代謝的過程中會產生一定量的自由基活性氧簇和活性氮簇,但是由于機體內存在正常的抗氧化系統,可維持其動態平衡[14]。如果這種平衡被打破,就可造成線粒體氧化應激,引起一系列線粒體功能障礙,進而導致疾病的發生。已有研究表明氧化應激及線粒體功能障礙參與很多神經系統退行性疾病的發生發展過程,如阿爾茲海默病、帕金森病等[15,16]。本研究發現,與CON組相比,PILO組線粒體ROS生成量增加,膜電位下降,提示癲癇發作時海馬神經內存在氧化應激發生,并且持續性的氧化應激可能會進一步破壞線粒體功能,加劇癲癇發作并進一步引起海馬神經損傷。
mtUPR在維持線粒體蛋白穩態中發揮重要作用[17]。目前研究表明,線粒體功能障導致線粒體積累并產生大量未折疊或錯誤折疊蛋白質,引起線粒體內蛋白穩態失衡,當線粒體中積累了大量損傷蛋白質,超過了線粒體中伴侶蛋白和蛋白酶處理能力時,就會觸發mtUPR[18]。本研究發現與CON組相比,PILO組海馬神經中CHOP、HSP60和CLpP表達量顯著增加,提示癲癇海馬神經中mtUPR被激活,并且過度的mtUPR會導致癲癇海馬神經損傷,加重其凋亡;而線粒體特異性抗氧化劑Mito-TEMPO可降低癲癇海馬神經線粒體ROS生成,恢復線粒體膜電位,使CHOP、HSP60和CLpP表達量下降,減輕海馬神經元損傷,提示線粒體特異性抗氧化劑Mito-TEMPO可能通過調控mtUPR恢復部分受損的線粒體功能,對癲癇神經元損傷發揮保護作用。
綜上所述,PILO致癇大鼠海馬神經中mtUPR激活,線粒體特異性抗氧化劑可能通過減少ROS生成,抑制mtUPR,從而發揮癲癇海馬神經保護作用。本研究為癲癇的治療提供了新的治療思路。

