PEI改性的硅化磁性納米吸附劑去除廢水中Cu2+性能研究
楊佳佳,王介楷,王凱,張直峰
(山西師范大學 生命科學學院,山西 太原 030031)
高效去除銅離子是含銅廢水末端處置的基本環節。近年來,離子交換[1]、化學沉淀[2]、膜處理[3]、吸附法[4]等技術均用于含銅廢水的處理,其中,吸附法因處理成本低而被普遍采用[5]。然而,常規吸附劑多存在吸附容量小、回收再利用困難等不足。目前,以納米Fe3O4為基底的吸附劑因可通過外加磁場快速回收而備受青睞[6]。
本研究基于聚乙烯亞胺(PEI)分子中胺基可有效螯合Cu2+的機理[7-8],通過對納米Fe3O4硅烷化包覆,并通過丙烯酸甲酯將PEI交聯于硅烷化Fe3O4表面,制備了一種復合磁性納米吸附劑(圖1),以期為含銅廢水中Cu2+高效去除提供一種新的吸附材料。
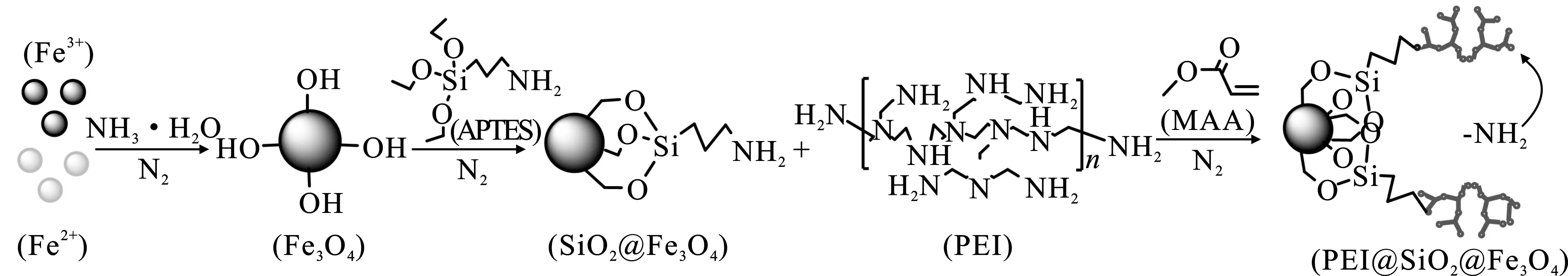
圖1 PEI@SiO2@Fe3O4制備路線Fig.1 Preparation process of PEI@SiO2@Fe3O4
1 實驗部分
1.1 材料與儀器
聚乙烯亞胺(PEI,分子量1 000)、硫酸亞鐵、硫酸銅、三氯化鐵、(3-氨基丙基)三乙氧基硅烷(APTES)、丙烯酸甲酯(MA)、二乙基二硫代甲酸鈉均為分析純。
TecnaiG2F20S-TWIN場發射透射電鏡;VSM-Versalab振動樣品磁強計;Varian 660傅里葉紅外分光光度計;UV-759紫外可見光分光光度計。
1.2 PEI修飾的復合磁性納米吸附劑的制備
磁性納米Fe3O4采用共沉淀法制備[9];PEI修飾的硅烷化Fe3O4參照文獻報道的原理制備[10]。首先將2.0 g Fe3O4超聲分散在200 mL無水乙醇中,攪拌30 min后,邊攪拌邊滴加10 mL APTES于反應溶液中,60 ℃反應7 h,所得產物用乙醇反復清洗并真空干燥,得到預制備的硅烷化Fe3O4納米顆粒(SiO2@Fe3O4)。將2.0 g SiO2@Fe3O4超聲分散在50 mL乙醇中,并加入20 mL MA與0.6 g PEI,反應7 h后,將所得產物用乙醇洗5次,50 ℃真空干燥后備用。
1.3 吸附條件優化
于100 mL離心管中分別加入不同初始濃度的Cu2+溶液50 mL(pH=6.0),并加入50 mg PEI@SiO2@Fe3O4,在室溫下振蕩(轉速140 r/min)反應20 min后,用磁鐵將PEI@SiO2@Fe3O4分離,通過二乙基二硫代甲酸鈉分光光度法(GB-7474—87)測定溶液中Cu2+濃度,采用公式(1)計算PEI@SiO2@Fe3O4對Cu2+的吸附量(Q,mg/g):
(1)
式中C0、Ce——吸附前后溶液中Cu2+濃度,mg/L;
V——溶液體積,L;
M——PEI@SiO2@Fe3O4的質量,g。
在考察Cu2+初始濃度對PEI@SiO2@Fe3O4吸附Cu2+影響的基礎上,按照上述實驗程序進一步考察溶液pH值、吸附時間、溫度對PEI@SiO2@Fe3O4吸附Cu2+的影響,所有實驗均重復3次。
1.4 吸附模型分析
1.4.1 吸附動力學模型 在50 mL初始濃度為 40 mg/L 及80 mg/L Cu2+溶液(pH=6.0,0.1 mol/L HCl調節)加入50 mg PEI@SiO2@Fe3O4,室溫下吸附反應40 min后分別采用準一級動力學模型方程(式2)和準二級動力學模型方程(式3)對實驗數據進行擬合分析[11],其中:
準一級動力學模型方程:
ln(Qe-Qt)=lnQe-K1t
(2)
式中Qt、Qe——吸附t時間時及達到吸附平衡時Cu2+的吸附量,mg/g;
K1——準一級動力學速率常數,min-1。
通過ln(Qe-Qt)對吸附時間(t)作圖從斜率和截距得到K1和Qe值。
準二級動力學模型方程:
(3)
式中 K2——準二級動力學速率常數,g/(mg·min)。
通過t/Qt對吸附時間(t)作圖從斜率和截距得到速率常數(K2)和Qe。
1.4.2 吸附等溫線模型 將50 mg PEI@SiO2@Fe3O4加入到50 mL 10~120 mg/L梯度濃度的Cu2+溶液(pH=6.0)中,于25 ℃振蕩吸附反應 20 min 后,采用Langmuir模型方程(式4)及Freundlich模型方程(式5)對實驗數據進行擬合分析[11-12]。
(4)
lnQe=lnKF-bFlnCe
(5)
式中Ce——吸附平衡時Cu2+的濃度,mg/L;
Qe——吸附平衡時的Cu2+吸附量,mg/g;
KL——Langmuir模型吸附常數,L/mg;
Qmax——最大吸附容量,mg/g;
KF和bF——Freundlich模型吸附平衡常數。
1.5 再生性能分析
選擇0.05 mol/L的Na2EDTA溶液(pH=4.5,稀硝酸調節)為解析劑[13],并以pH=4.5的酸性水溶液作為對比,將50 mg吸附有Cu2+的PEI@SiO2@Fe3O4(Cu2+計算吸附量為65.17 mg/g)分別置于10 mL Na2EDTA溶液及pH=4.5的酸性水溶液中,充分振蕩40 min后,分離PEI@SiO2@Fe3O4,測定溶液中Cu2+濃度,計算解析率;PEI@SiO2@Fe3O4經蒸餾水清洗后,再連續進行3次的吸附-解析實驗,考察吸附劑的重復利用性能。
1.6 應用性能分析
參照我國《銅、鎳、鈷工業污染物排放標準(征求意見稿)》,配制Cu2+濃度為10倍于排放標準限值的模擬廢水(Cu2+10 mg/L,Zn2+40 mg/L,Ni+10 mg/L,Cd2+1 mg/L pH=6.0),于500 mL模擬廢水中加入100 mg PEI@SiO2@Fe3O4,攪拌反應 30 min 后測定模擬廢水中Cu2+濃度,同時以 10 mg/L Cu2+溶液為對比,并依據式(6)計算Cu2+的去除效率(R,%)
(6)
式中C0、Ce——吸附前后模擬廢水中Cu2+濃度,mg/L。
2 結果與討論
2.1 PEI@SiO2@Fe3O4表征結果
通過TEM對PEI@SiO2@Fe3O4形貌分析顯示(圖2A):單純的Fe3O4呈球形分布(圖2A鑲嵌圖),經修飾后PEI@SiO2@Fe3O4仍呈近球形分布,但粒徑增加,粒徑介于10~40 nm之間;紅外光譜分析顯示(圖2B):在588 cm-1處PEI@SiO2@Fe3O4有一個明顯的特征吸收峰,對應于Fe3O4的Fe—O的伸縮振動;相比于Fe3O4,經修飾后,2 908 cm-1歸屬于 —Si—O鍵伸縮振動,1 630 cm-1及1 541 cm-1處特征峰歸屬于 —CO—NH— 鍵及 —NH2的伸縮振動[14],說明SiO2及PEI成功交聯于Fe3O4表面。由圖2C可知,PEI@SiO2@Fe3O4飽和磁強度約為 33.71 emu/g,滿足磁分離的要求。

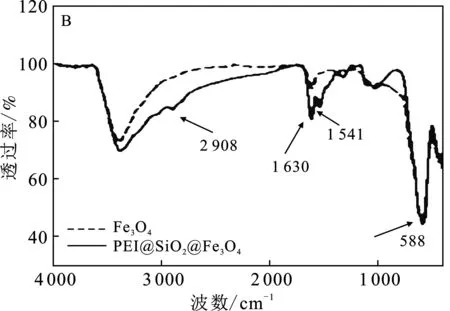

圖2 PEI@SiO2@Fe3O4結構表征Fig.2 Structural characterization of PEI@SiO2@Fe3O4 A.PEI@SiO2@Fe3O4TEM形貌,鑲嵌圖為Fe3O4 TEM形貌;B.PEI@SiO2@Fe3O4紅外光譜圖;C.PEI@SiO2@Fe3O4磁滯回線
2.2 最佳吸附條件
2.2.1 Cu2+初始濃度 通過考察Cu2+初始濃度對PEI@SiO2@Fe3O4吸附Cu2+效果的影響顯示(圖3A),隨著Cu2+濃度的增加,PEI@SiO2@Fe3O4對Cu2+的吸附量逐漸增加,當Cu2+濃度>80 mg/L時,PEI@SiO2@Fe3O4對Cu2+的吸附量不再明顯變化,歸因于隨著Cu2+濃度增加,PEI@SiO2@Fe3O4表面的吸附位點逐漸被Cu2+所占據,吸附趨于飽和。因此,選擇80 mg/L 的Cu2+溶液進行后續實驗。
2.2.2 pH值 由圖3B可知,隨著溶液pH增加,PEI@SiO2@Fe3O4對Cu2+的吸附量隨之增加。說明在酸性條件下不利于PEI@SiO2@Fe3O4對Cu2+的吸附。在低pH值條件下,PEI分子中的胺基(—NH2)會通過質子化形成 —NH3+[9],對Cu2+產生靜電排斥作用,阻礙了其分子中胺基與Cu2+的絡合;此外,溶液中大量的H+會與Cu2+競爭結合PEI@SiO2@Fe3O4表面吸附位點,使吸附容量減少[15]。盡管溶液pH值>7.0時,吸附量會繼續增加,但考慮到部分Cu2+在堿性條件會形成Cu(OH)2而使溶液中Cu2+剩余濃度降低[16],為考察PEI@SiO2@Fe3O4對Cu2+真實吸附容量,吸附過程在pH=6.0的條件下更為適宜。
2.2.3 吸附時間 由圖3C可知,隨著吸附時間的增加,PEI@SiO2@Fe3O4對Cu2+的吸附量隨之增加,20 min后吸附量不再明顯變化,一方面可能與吸附劑表面吸附活性位點有關,另一方面隨著溶液中Cu2+濃度的降低,濃度梯度差推動力越來越小,Cu2+在PEI@SiO2@Fe3O4內部擴散的阻力逐漸增加,吸附過程趨于平衡[17]。因此,在20 min內PEI@SiO2@Fe3O4對Cu2+吸附即可達到吸附平衡。
2.2.4 吸附溫度 通過考察溫度對PEI@SiO2@Fe3O4吸附Cu2+影響顯示(圖3D),隨溫度升高,PEI@SiO2@Fe3O4吸附Cu2+的吸附量呈現出一定的下降趨勢,說明該吸附過程是一個自發的過程,在室溫下更有利于吸附反應的進行。
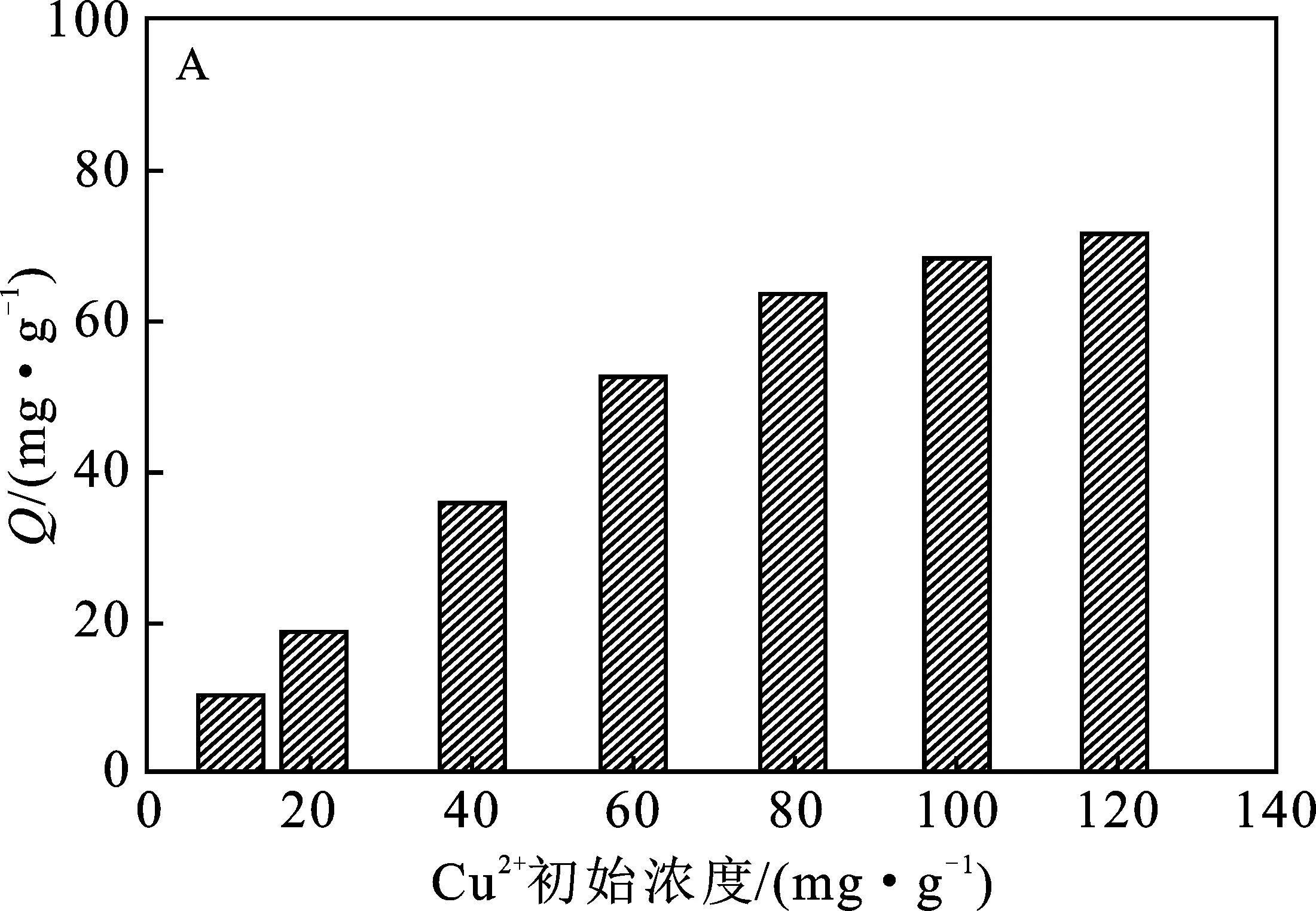
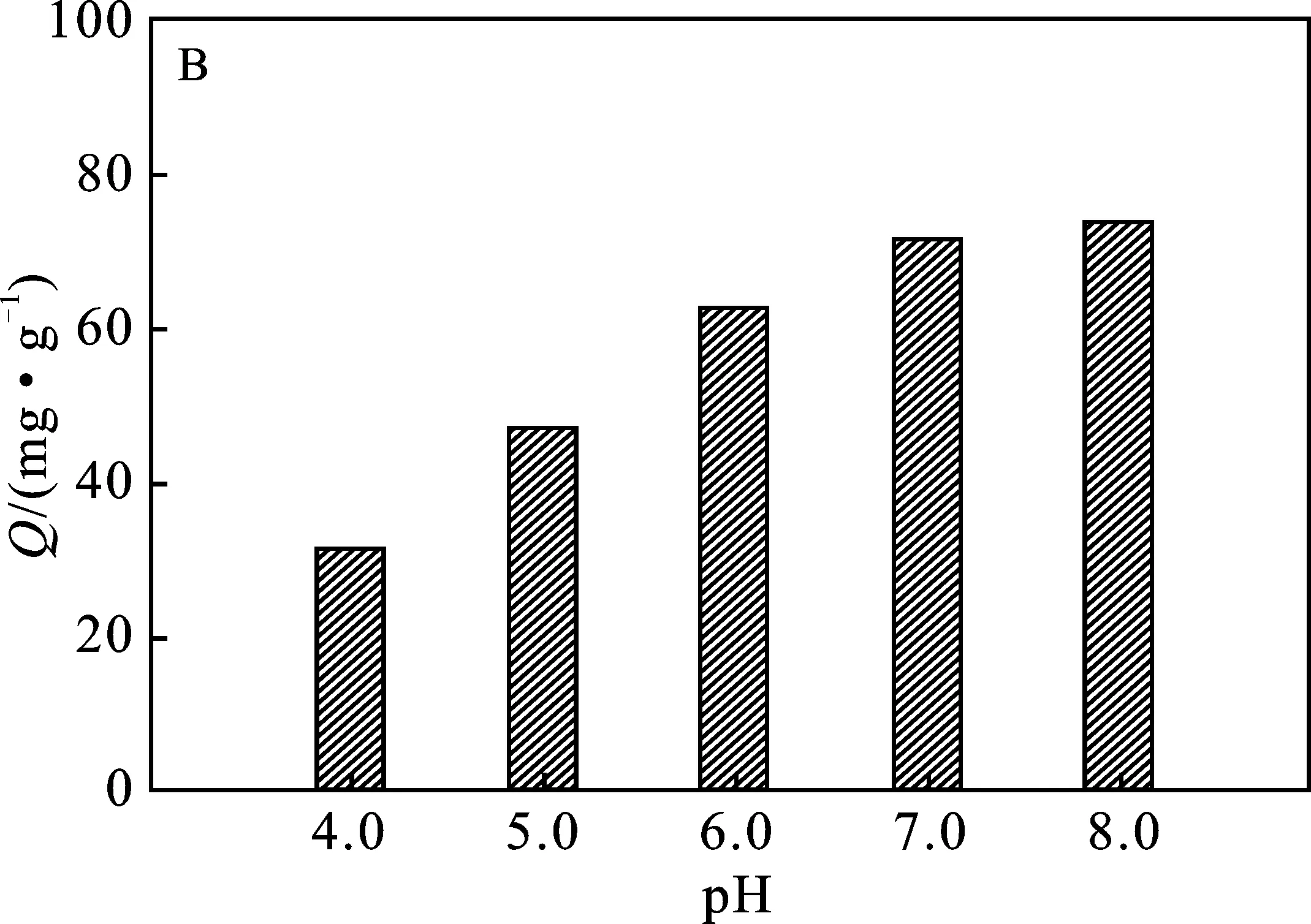
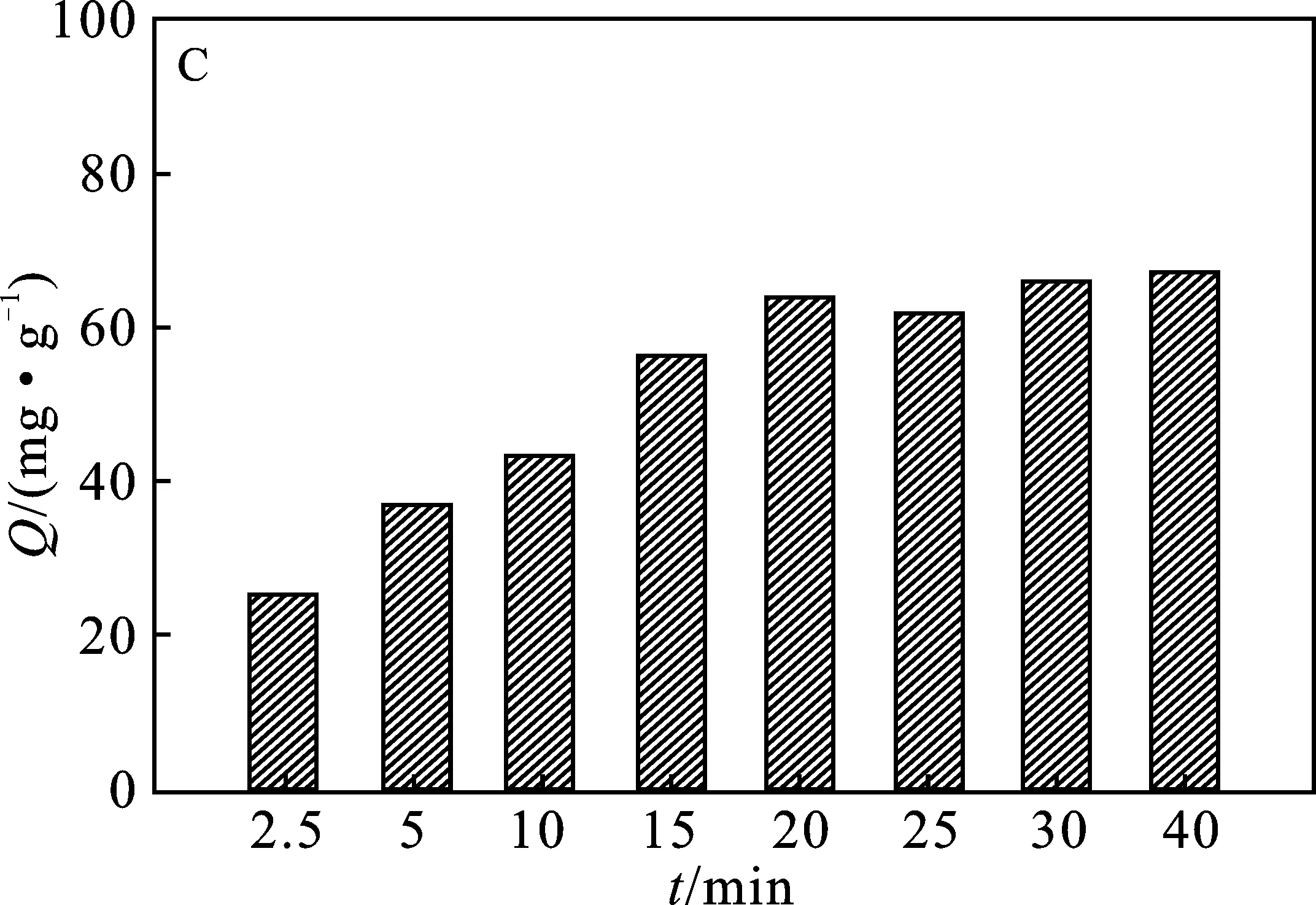
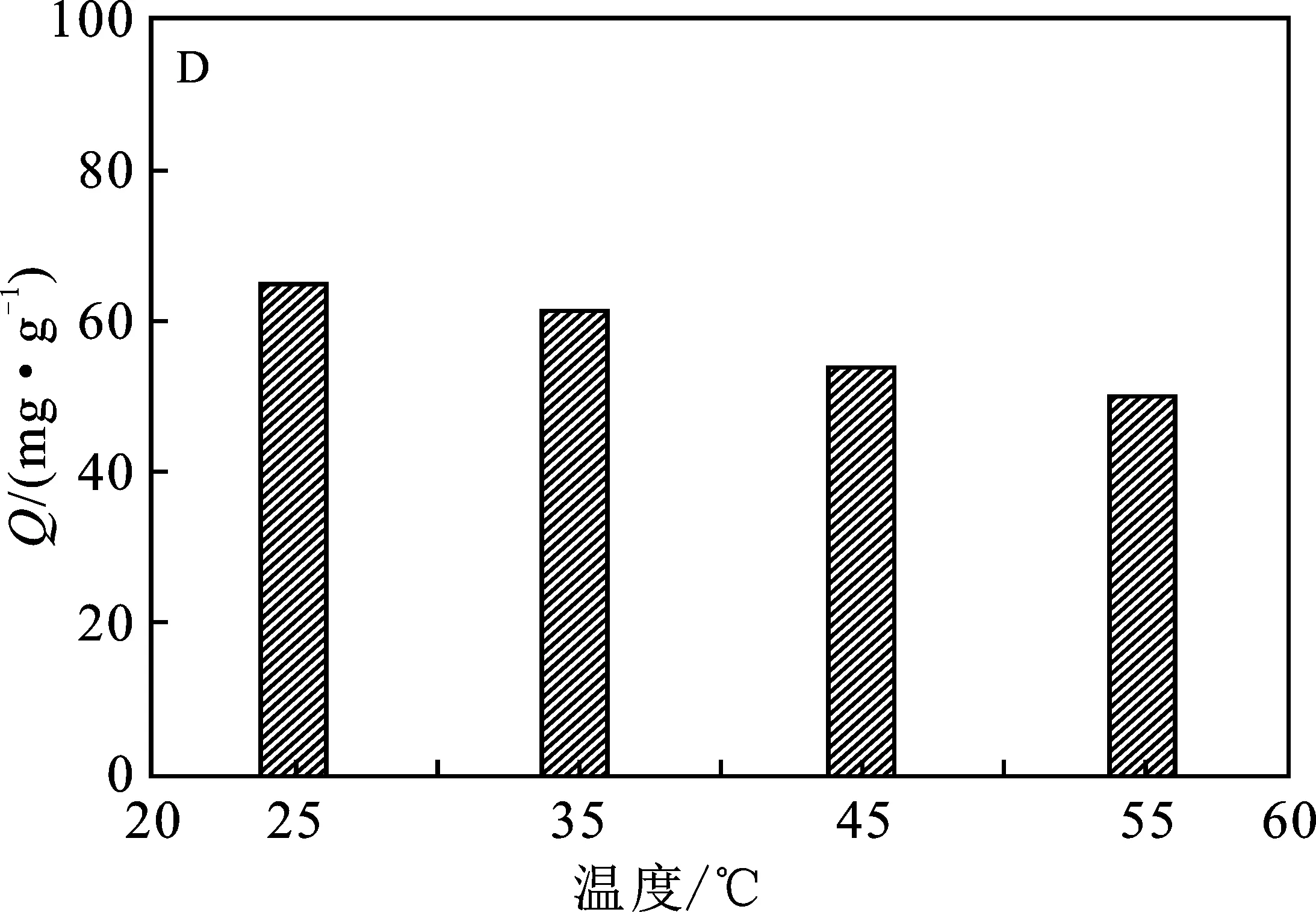
圖3 Cu2+初始濃度(A)、溶液pH值(B)、吸附時間(C) 和溫度(D)對PEI@SiO2@Fe3O4吸附Cu2+的影響Fig.3 The effects of initial Cu2+ concentration(A),pH value (B),time (C) and temperature (D) on the adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.3 吸附模型
2.3.1 吸附動力學模型 采用準一級吸附動力學和準二級吸附動力學模型對實驗數據進行擬合(圖4A),所獲得的參數分析見表1。
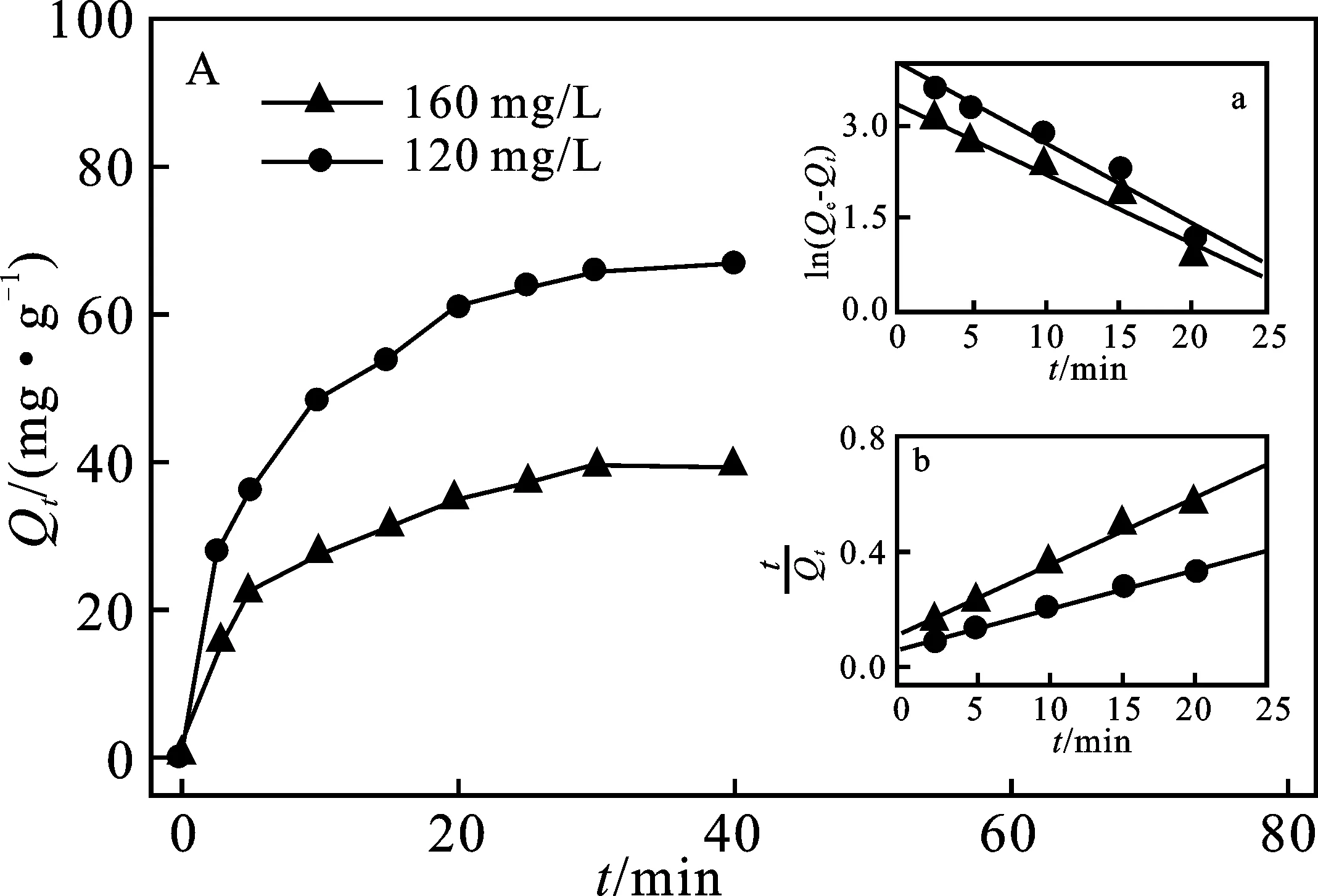

圖4 PEI@SiO2@Fe3O4吸附Cu2+ 動力學(A)和等溫模型(B)曲線Fig.4 The adsorption kinetics (A) and the adsorption isotherm model of Cu2+ onto PEI@SiO2@Fe3O4 order kinetics model plots(B) A鑲嵌圖:a.準一級動力學模型;b.準二級動力學模型 B鑲嵌圖:a.Langmuir模型方程擬合曲線;b.Freundlich模型方程擬合曲線
由表1可知,準二級動力學模型相關系數(R2)明顯高于準一級動力學模型,且計算的平衡吸附量(Qcal)與實驗實際值Qe更為接近,說明PEI@SiO2@Fe3O4吸附Cu2+更符合準二級動力學模型,PEI@SiO2@Fe3O4對Cu2+的吸附以化學吸附為主[18],同時反映了在初始吸附階段Cu2+可快速與PEI分子中胺基與酰胺基團螯合而吸附于PEI@SiO2@Fe3O4表面。
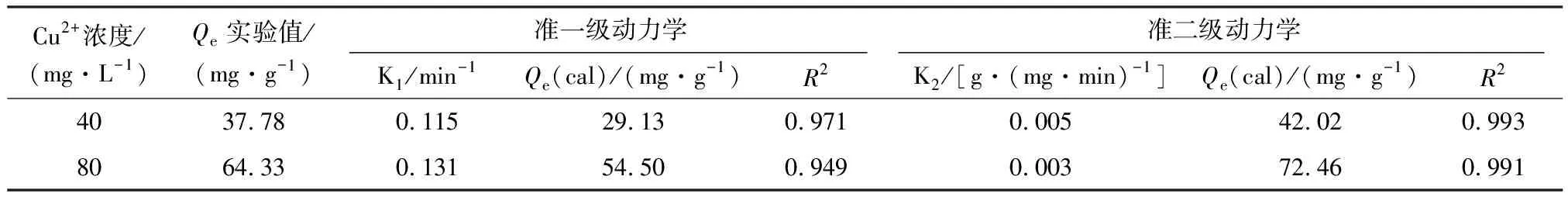
表1 PEI@SiO2@Fe3O4吸附Cu2+的準一級和準二級動力學方程擬合參數Table 1 Kinetic parameters of pseudo-first-order and pseudo-second-order kinetic models for adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.3.2 吸附等溫模型 通過PEI@SiO2@Fe3O4對不同濃度的Cu2+進行吸附,吸附量與溶液中剩余Cu2+濃度關系見圖4B;采用Langmuir及Freundlich等溫線模型方程對吸附數據進行擬合所得圖形見 圖4B 鑲嵌圖,相關參數見表2。由圖4B及表2可知,與Freundlich等溫線模型相比,Langmuir模型方程相關系數更高,因此PEI@SiO2@Fe3O4對Cu2+的吸附遵循Langmuir等溫吸附模型。以上結果說明PEI@SiO2@Fe3O4對Cu2+吸附為表面單層吸附,且KL介于0~1之間,吸附過程非常容易進行[18]。基于Langmuir等溫方程計算,PEI@SiO2@Fe3O4對Cu2+最大吸附容量為71.94 mg/g。

表2 PEI@SiO2@Fe3O4吸附Cu2+等溫吸附模型參數Table 2 The parameters of the adsorption model for the adsorption Cu2+ by PEI@SiO2@Fe3O4
與目前報道的PEI修飾的麥秸 (48.6 mg/g)[4]、PEI修飾的纖維素納米纖維(52.3 mg/g)[19]、玉米穗狀氧化鋅(16.1 mg/g)[20]等吸附劑相比,PEI@SiO2@Fe3O4對Cu2+具有較高的吸附容量。盡管PEI@SiO2@Fe3O4對Cu2+吸附容量低于蛭石基納米水合氧化鋯(96.23 mg/g)[21],木質素/殼聚糖復合物(283 mg/g)[22]等吸附劑,但PEI@SiO2@Fe3O4可通過外加磁場從凈化廢水中快速回收并能再次循環利用。
2.4 解析及重復利用
采用0.05 mol/L Na2EDTA溶液對吸附有Cu2+的PEI@SiO2@Fe3O4進行再生性能分析,得到解析效率為84.47%,而采用pH=4.5的酸性溶液解析效率僅為63.82%,說明0.05 mol/L Na2EDTA溶液可有效用于PEI@SiO2@Fe3O4的再生。經過4次吸附-解析附循環后(圖5),PEI@SiO2@Fe3O4對Cu2+的吸附量從65.17 mg/g下降到24.54 mg/g,主要由于多次循環會造成部分吸附劑損失,此外部分未被解析的Cu2+還會占據PEI@SiO2@Fe3O4表面的吸附位點。但由圖5可知,3次循環吸附后,PEI@SiO2@Fe3O4對Cu2+的吸附容量仍保持在初始吸附容量的58.98%,說明PEI@SiO2@Fe3O4至少可重復利用3次。

圖5 吸附-解析次數對PEI@SiO2@Fe3O4 吸附 Cu2+的影響Fig.5 Effect of adsorption-desorption cycles on adsorption of Cu2+ by PEI@SiO2@Fe3O4
2.5 應用性能分析
通過分析模擬廢水表明,PEI@SiO2@Fe3O4對模擬廢水中Cu2+的去除效率為76.53%,Cu2+剩余濃度2.347 mg/L。與單純的Cu2+溶液中去除效率(92.61%)相比,去除效率下降了16.08%,可能由于其它金屬離子產生一定的競爭吸附。通過進一步優化PEI@SiO2@Fe3O4用量顯示,隨PEI@SiO2@Fe3O4用量增加模擬廢水中Cu2+去除效率逐漸增加,當PEI@SiO2@Fe3O4用量為280 mg/L時,模擬廢水中Cu2+濃度到達排放限值以下,表明PEI@SiO2@Fe3O4具有較好的實際應用性能,但在實際廢水處理中,還有待依據廢水中Cu2+濃度對PEI@SiO2@Fe3O4用量進一步優化。

圖6 PEI@SiO2@Fe3O4用量對模擬廢水中Cu2+去除率 及剩余Cu2+濃度(鑲嵌圖)的影響Fig.6 Effect of PEI@SiO2@Fe3O4 dosage on removal rate and Cu2+ concentration(insert) of Cu2+ in simulated wastewater
3 結論
(1)以分子結構中富含胺基的PEI為表面修飾劑制備了一種磁性納米吸附劑(PEI@SiO2@Fe3O4),所制備的吸附劑在室溫、pH=6.0、吸附 20 min 的條件下可實現Cu2+的有效吸附,對Cu2+的最大吸附量為71.94 mg/g;吸附過程符合準二級動力模型及Langmuir等溫吸附模型。
(2)PEI@SiO2@Fe3O4可通過Na2EDTA溶液再生且至少可重復利用3次,通過對模擬含銅廢水中Cu2+的吸附去除證實PEI@SiO2@Fe3O4可作為一種新的磁性吸附劑用于工業廢水、選礦尾水中Cu2+的凈化處置。

